豬骨骼肌衛星細胞體外分離培養研究進展
喻宗崗,馬海明,2
(1.湖南農業大學動物科學技術學院,長沙 410128;2.嶺南現代農業科學與技術廣東省實驗室,廣州 510640)
豬的解剖結構和生理特征與人相似,因此可以作為人類疾病研究的模型[1]。為比較病理模型的優劣,研究發現,豬假性肥大肌營養不良癥(duchenne muscular dystrophy,DMD)模型的病理狀態比鼠模型中更接近于人[2-3]。因此,豬肌肉疾病模型比小鼠模型更有優勢。骨骼肌衛星細胞在出生后機體骨骼肌發育、維持和再生等生命活動中都發揮著重要的作用[4]。骨骼肌衛星細胞不僅是肌纖維細胞核的來源,而且能促進纖維的肥大[5-6]。被激活的骨骼肌衛星細胞可以誘導肌細胞增殖、分化,并促使肌細胞與肌纖維融合[7]。骨骼肌衛星細胞不僅有增殖分化的潛能,而且可被招募參與骨骼肌運動[8],在肌纖維損傷修復和再生過程中發揮重要作用[9-10]。因此,骨骼肌衛星細胞也可以作為肌肉生長發育的良好體外研究模型[11]。
骨骼肌衛星細胞最早由Mauro[12]于1961年在青蛙腿肌上分離獲得,它位于肌纖維質膜和基底膜之間[13],主要分布于慢肌纖維中[14]。之后陸續建立了細胞自然貼壁培養法、熒光激活細胞分選法和磁珠激活分選法等方法。自然貼壁法耗時、低效,熒光激活分選法依賴昂貴的儀器,磁珠法獲得的細胞活力低[15]。通過添加酶可以適當縮短分離時間,并獲得高純度、高活力的細胞,但是目前酶消化法仍存在酶使用種類、劑量、消化時間不統一,離心過濾時離心力和濾徑大小不一、離心過濾次數不一致等問題。作者通過對分離骨骼肌衛星細胞的取材、消化、過濾、離心、體外培養、鑒定等基本步驟進行綜述,期望為體外獲得高純度、高活力的豬骨骼肌衛星細胞,建立規范有效的分離方法提供參考。
1 骨骼肌衛星細胞分離
1.1 取材
1.1.1 取材部位 骨骼肌衛星細胞分離有直接分離法和肌纖維分離法2種。Doumit等[16]于1992年利用直接分離法首次從4~8周齡豬的半膜肌中分離出肌源衛星細胞;Bekoff等[17]于1997年利用肌纖維分離法在小鼠骨骼肌中分離獲得肌源衛星細胞。Wilschut等[18]于2010年建立豬單纖維分離法,自此陸續從崗上肌[19]、趾長伸肌[20]、三角肌群[21]、背最長肌[22-24]、半腱肌、半膜肌[24-25]、股二頭肌[26-27]、腓腸肌[28]、三頭肌[29]、后腿肌、菱形肌[11,30]、第三腓骨肌[28]、脛骨前肌[4]等肌肉組織中分離出了豬骨骼肌衛星細胞(圖1A)。因背最長肌相較四肢的小肌群更大,取材最容易,常被用于分離骨骼肌衛星細胞。
1.1.2 取材時期 分離豬骨骼肌衛星細胞的材料可取自胎兒期至幼齡期,如60胚齡[31-32]、1日齡[4,33]、3日齡[19,27]、4日齡[26,28]、5日齡[24]、7日齡[34]、4~6周齡[23]、1月齡[19]、2月齡[35]、5月齡[36]和25周齡[34](圖1B)。其中最常用的是出生后1日齡豬,并且1~7日齡豬占到85%以上,最大日齡為25周齡。豬日齡越大肌肉的體積越大,取材相對越容易,然而,隨著時間的延長肌肉中骨骼肌衛星細胞的數量越少,其增殖分化潛能也會越低,因此要獲得足夠數量且分化潛能高的骨骼肌衛星細胞應取材于1日齡豬背最長肌。另外,即使取自同時期的同一部位,不同品種骨骼肌衛星細胞的增殖能力也存在差別[37],如中國大蒲蓮豬骨骼肌衛星細胞的增殖能力高于長白豬[7]。

p60 d,60胚齡;d,出生后天數;w,出生后周齡;mon,出生后月齡p60 d,60 embryo age;d,Days after birth;w,Weeks after birth;mon,Months after birth圖1 肌肉組織取樣部位(A)和時期(B)及其使用百分率Fig.1 Sampling site (A) and period (B) of muscle tissues and their percentage of use
1.2 消化
根據分離豬骨骼肌衛星細胞使用酶的種類,將分離方法分為單酶消化法和多酶消化法,單酶有鏈酶蛋白酶[38-39]、膠原酶D[34]、蛋白酶[24,27,40-41]、蛋白酶ⅩⅣ[31,42]、胰蛋白酶[25,43-44]、Ⅰ型膠原蛋白酶[45-52]、Ⅱ型膠原蛋白酶[7,29,53-63](圖2)。Ⅱ型膠原蛋白酶是最常用的酶,不同的酶有最佳的使用方法。Ⅱ型膠原蛋白酶能有效消化肌肉組織中的結締組織,用0.2% Ⅱ型膠原蛋白酶消化2 h最佳(圖3A、3D)。Ⅰ型膠原蛋白酶最佳使用方法是0.2%消化1~2 h(圖3B、3E)。蛋白酶使用量有4種規格(圖3C),最佳消化時間是1 h(圖3F)。

圖2 消化酶及其使用百分率Fig.2 Digestive enzymes and their percentage of use
聯合使用2種酶的方法有膠原酶+Ⅹ型胰蛋白酶[19]、Ⅰ型膠原酶+胰蛋白酶[4,23,64-65]、Ⅱ型膠原酶+胰蛋白酶[66]、蛋白酶+Ⅺ型膠原蛋白酶[67-68](圖2),其中,0.1%~0.2%Ⅰ型膠原酶+0.25%胰蛋白酶應用最多,也有聯合使用胰蛋白酶+膠原酶+DNA酶3種酶分離骨骼肌衛星細胞的[11,24]。羅桂芬等[21]比較了鏈霉蛋白酶、胰酶及膠原酶消化法的分離效果,發現鏈酶蛋白酶消化法與其他酶消化法相比,可獲得數量最多的骨骼肌衛星細胞,但細胞活力沒有差異。因為不同的酶作用于不同的底物,膠原蛋白酶主要作用于肌束,鏈酶蛋白酶和胰蛋白酶作用于基底膜和肌膜,促使骨骼肌衛星細胞的釋放[69]。聯合使用多種酶消化肌肉組織中的異質物,雖然能有效去除雜質,但是延長了消化時間。1日齡豬肌肉組織中含有最多的是結締組織,因此使用Ⅱ型膠原蛋白酶是最有效的分離方法。

A、D,分別為Ⅱ型膠原蛋白酶的使用濃度和消化時間使用百分率;B、E,分別為Ⅰ型膠原蛋白酶的使用濃度和消化時間使用百分率;C、F,分別為蛋白酶的使用濃度和消化時間使用百分率A and D,The concentration of type Ⅱ collagenase and the percentage of digestion time respectively;B and E,The usage percentage of concentration and digestion time of type Ⅰ collagenase,respectively;C and F,The usage percentage of protease concentration and digestion time,respectively圖3 3種常用單酶使用條件Fig.3 Application conditions of three common single enzymes
1.3 過濾和離心
骨骼肌中包含血管、神經等結締組織(圖4),分離肌衛星細胞時需要過濾和離心除去結締組織以獲得高純度的細胞。分離豬骨骼肌衛星細胞有不過濾、過濾1次和過濾多次3種方式(圖5A)。1次過濾有20 μm[19,26]、40 μm[35,41,68]、70 μm[4]、100 μm[27,70]、100目[70]和300 mm[46]等多種濾徑參數(圖5B)。2次過濾有100 μm+40 μm[34,67,71]、100 μm+70 μm[11,30,57]、200目+400目[55-56,59,66]、200 mm+50 mm[53,60,62]、200 μm+70 μm[45]、70 μm+40 μm[31,42]、76 μm+37 μm[72]、500 μm+53 μm[38]7種(圖5C),其中200目+400目在2次過濾中應用最廣泛。3次過濾有100 μm+70 μm+40 μm[29,48,58,61,64]和100目+200目+400目[73]2種;其中100 μm+70 μm+40 μm是3次過濾的最佳方式(圖5C)。1次過濾雖然省時,但可能因過濾不足得到的細胞不純;3次過濾不僅延長了時間,還可能因過度過濾損傷細胞而降低細胞活力。因此,最優的過濾方式是200目+400目2次過濾法。
普通離心和密度梯度離心是骨骼肌衛星細胞常見的2種分離方式。普通離心有1次離心和多次離心2種,多次離心有多次單一離心力和多次不同離心力2種。300×g離心5 min(2次)[35]比1 000 r/min離心10 min然后1 000 r/min離心5 min[47](圖5D)時間短,相同分離效果下更為簡便。多次不同離心力中(圖5E),2 000 r/min離心5 min后1 000 r/min離心10 min[74]比300×g離心6 min后800×g再離心10 min[39]用時少,故而更簡捷。在用時上,3次離心中,1 500×g離心10 min、800×g離心10 min、800×g離心5 min比100×g離心5 min、1 000×g離心5 min(2次)[34]用時長,比1 200×g離心15 min、300×g離心5 min、1 200 g離心15 min[27]用時短,但是先高離心力能有效去除大塊碎屑,再低離心力去除細微雜質,還不至損傷細胞,造成細胞活力下降,是最好的3次離心法。Percoll密度梯度離心有3種70%、50%、40%[26,43],70%、50%、40%、25%[26,44]和60%、20%[11,30](圖5F),其中60%、20%密度梯度離心法因為成分較其他2種更簡單,因此最簡便。1次和2次離心雖能去除大部分被消化的結締組織,但是仍有殘留,所獲的細胞不純,因此,要有效去除雜質,3次離心法是最佳選擇。

圖4 骨骼肌結構模式圖[33]Fig.4 Skeletal muscle structure model diagram[33]

A,過濾次數使用百分率;B,1次過濾使用百分率;C,多次過濾使用百分率;D,1次離心使用百分率;E,多次離心使用百分率;F,密度梯度離心使用百分率A,The percentage of filtering times;B,The percentage of single filtration;C,The usage percentage of multiple filtration;D,The percentage of single centrifugation;E,The percentage of multiple centrifugal use;F,The percentage of density gradient centrifugation圖5 過濾和離心程序及其使用百分率Fig.5 Filtration and centrifugation procedures and their percentage of use
2 骨骼肌衛星細胞培養
根據分離目標分為成肌細胞、骨骼肌衛星細胞分離法和單纖維分離法。常用成肌細胞、骨骼肌衛星細胞分離法來獲得原代細胞。有研究比較了單核成肌細胞分離法和單纖維分離法獲得骨骼肌衛星細胞的優劣,結果發現單核成肌細胞分離法無法得到同質性高的成肌細胞,且其中的肌衛星細胞數量少,再生能力差;單纖維分離法得到的衛星細胞細胞增殖能力更強,且可以了解骨骼肌衛星細胞初始位置和遷移轉化等過程[20]。也有通過共培養骨骼肌衛星細胞和基質血管細胞來獲得骨骼肌衛星細胞的方法[75]。
離心后的細胞中含有成肌細胞和骨骼肌衛星細胞,為獲得單一的骨骼肌衛星細胞還需進一步分離純化。成肌纖維細胞貼壁早于肌衛星細胞,利用差速貼壁的特性,即可以獲得成肌細胞和肌衛星細胞[75-76]。體外培養豬肌衛星細胞的培養液包含基礎培養基、血清、抗生素和其他添加物等多種物質。對46篇文獻的培養液分析歸納獲得如下結果。
豬肌衛星細胞的培養基有6種,使用頻次最高的是DMEM/F12(圖6A)。血清因其中含有細胞生長必需的成分常被添加在培養基中,常見的添加方式有添加1種血清和添加2種血清。添加10%胎牛血清(FBS)比添加20% FBS更經濟。10% FBS+10%馬血清(HS)和10% FBS+10%豬血清(PS)使用較少(圖6B)。為防止外源微生物的污染,常在培養基中添加抗生素。在46篇研究中只有7篇未添加抗生素,抗生素使用率達到84%以上(圖6C)。在添加抗生素的報道中,1%青-鏈霉素(P/S)是必需成分,也有同時添加了青-鏈霉素和兩性菌素[11,26,28-30,43,47,49],還有同時添加了青-鏈霉素、兩性菌素和慶大霉素[44]。在培養液中添加谷氨酰胺和谷氨酰胺丙氨酸二肽可提高細胞的活性、促進細胞生長。部分還添加了基礎成肌纖維細胞生長因子(bFGF)、雞胚提取物(CEE)、氨基酸(AA)、4-羥乙基哌嗪乙磺酸(HEPES)和表皮生長因子(EGF)等物質(圖6D~6H),其中bFGF、CEE和EGF可提高細胞的貼壁率,AA為細胞生長提供營養,HEPES保證細胞生長的緩沖能力。在培養液中添加胞外基質(如明膠、鼠尾膠原、多聚賴氨酸、層黏連蛋白和纖維黏連蛋白)可有效提高細胞的貼壁率[77]。對于沒有損傷的細胞,有自然貼壁的能力,不用添加促貼壁的物質,增加添加物后細胞滲透壓和緩沖力會改變還需要添加緩沖液,因此,DMEM/F12+10% FBS+1% P/S是豬骨骼肌衛星細胞培養的最佳培養液。

①A,基礎培養基使用百分率;B,血清使用百分率;C,抗生素使用百分率;D,谷氨酰胺使用百分率;E,基礎纖維生長因子使用百分率;F,雞胚提取物使用百分率;G,氨基酸使用百分率;H,其他添加物的使用百分率。②DMEM,杜氏改良伊戈爾培養基;FBS,胎牛血清;HS,馬血清;PS,豬血清;FCS,小牛血清;PS,青-鏈霉素;Amp,兩性菌素;GTM,慶大霉素;bFGF,基礎成肌纖維細胞生長因子;CEE,雞胚提取物;NEAA,非必需氨基酸;AA,氨基酸;HEPES,4-羥乙基哌嗪乙磺酸;EGF,表皮生長因子;None,在46篇文獻中未使用該物質①A,The used percentage of basic medium;B,The used percentage of serum;C,The used percentage of antibiotics;D,The used percentage of glutamine;E,The used percentage of basic fiber growth factor;F,The used percentage of chicken embryo extract;G,The used percentage of amino acids;H,The used percentage of other additives. ②DMEM,Dulbecco’s modified Eagle’s medium;FBS,fetal bovine serum;HS,Horse serum;PS,Porcine serum;FCS,Fetal calf serum;P/S,Penicillin-streptomycin;Amp,Amphotericin;GTM,Gentamicin;bFGF,Basic fibroblast growth factor;CEE,Chicken embryo extract;NEAA,Nonessential amino acid;AA,Amino acid;HEPES,4-hydroxyethyl piperazine ethanesulfonic acid;EGF,Epidermal growth factor;None,The substance was not used in 46 literatures圖6 培養液各組分及其使用百分率Fig.6 Components of culture medium and their percentage of use
3 骨骼肌衛星細胞的鑒定
骨骼肌衛星細胞是多潛能干細胞,可以分化為成肌細胞和成脂細胞,因此可以使用成肌或成脂標志物來鑒定。根據標志基因在細胞中的位置可分為核標記、轉錄因子標記和細胞表面膜蛋白標記[78]。常見的核標記有配對盒基因3(PAX3)、PAX7;轉錄因子標記有生肌調節因子5(Myf5)、Myf4、肌分化因子(MyoD)、肌細胞生成素(MyoG)等,表面膜蛋白主要有m-鈣黏蛋白、α7-和β1-整合素、c-Met、C-X-C趨化因子受體4型(CXCR4)、多配體蛋白聚糖-3和多配體蛋白聚糖-4、降鈣素受體、顱腦損傷蛋白-1、CD34、血管細胞黏附分子-1(VCAM1)和神經細胞黏附分子-1 (NCAM1)[79-80]。肌衛星細胞標志基因有PAX7[7,43,47,53,56,60,63,66,81-83]和Myf5[27,40,67,84],成脂標志基因有脂蛋白脂酶(LPL)、過氧化物酶體增殖物激活受體(PPARγ)、脂肪細胞和定向分化因子1(ADD1)和固醇調節元件結合蛋白-1(SREBP-1)[67],成肌標志基因有PAX7[27,28,34]、MyoD、MyoD1[4,26-28,67,85]、MyoG[26,28,85]、Myf5[27,28,33,34]、肌球蛋白重鏈(MHC)[24]和結蛋白(Desmin)[4,24,28,30,55]。PAX7是鑒定骨骼肌衛星細胞的最佳因子。
免疫熒光(IF)、實時熒光定量PCR(qPCR)、流式細胞分析(FC)和免疫組化(IHC)是常用的鑒定方法(圖7)。不同的鑒定因子因其表達的部位和鑒定的簡便及有效性的不同而有所側重。Desmin使用IHC法鑒定最為有效(圖8A),Myf5用IF法鑒定效果最好(圖8B)。MyoD的鑒定方式中qPCR法相較IF法更為方便、經濟,因此被廣泛使用(圖8C)。PAX7使用IF法鑒定最有效(圖8D)。成脂細胞標志基因常用PCR法來鑒定,還可以使用油紅O染色法來鑒定[51]。相較于Desmin、Myf5和MyoD,PAX7在衛星干細胞、衛星細胞和成肌細胞上均有表達(圖9),因此是最佳的鑒定因子。
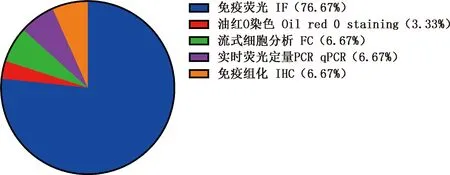
圖7 鑒定方法及其使用百分率Fig.7 Identification methods and their percentage of use
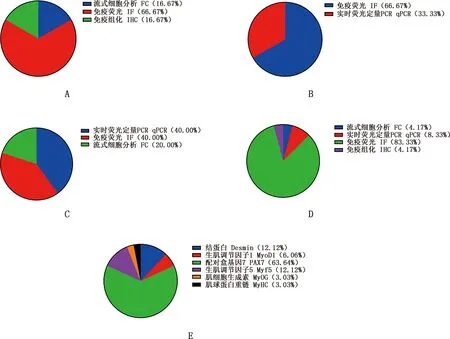
圖8 標記因子的鑒定方法及其使用百分率Fig.8 Identification method and application percentage of marker factors
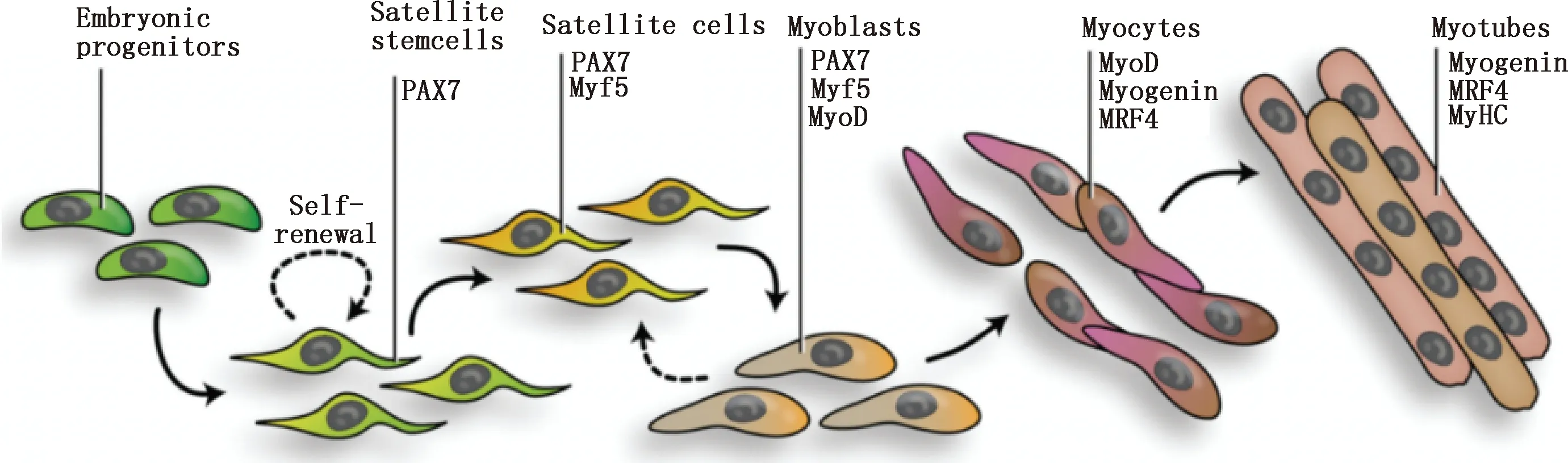
圖9 參與調控肌衛星細胞生長變化過程的標記因子[33]Fig.9 Marker factors involved in regulating the growth and changes of muscle satellite cells[33]
4 小 結
豬骨骼肌衛星細胞可以從不同時期的多種肌肉中分離,且各時期分離細胞的數量和增殖能力不同,部位決定著取材的便捷性,因此,常用1日齡豬的背最長肌分離豬骨骼肌衛星細胞。酶消化涉及到用酶種類及各酶使用方法,酶種類的增加可以有效去除肌肉中的雜質,但延長了消化時間,很可能因過度消化損傷細胞膜,降低細胞活力,所以使用單酶是比較保險的選擇。0.2% Ⅱ型膠原蛋白酶37 ℃消化2 h是最有效的消化方式。消化后的肌肉組織是細胞和異質碎屑的混合物,需要通過過濾和離心去除組織碎屑,獲得純細胞。單次過濾、單次離心難以有效去除雜質,多次過濾、離心可能會損傷細胞膜降低細胞活力,因此2次過濾加3次離心是最佳選擇,即400目+200目過濾,1 500×g離心10 min、800×g離心10 min、800×g離心5 min是最佳組合。
過濾離心后的細胞還包含成肌細胞,因此需進一步培養純化獲得單一的骨骼肌衛星細胞。成肌細胞在培養液中正常生長后會較早貼壁,因此可取貼壁后的上清繼續培養來獲得骨骼肌衛星細胞。培養液對細胞的正常生長至關重要,原代細胞在離體環境中需要充足的營養和無菌環境,DMEM/F12+10% FBS+1% P/S是細胞培養的常見培養液。骨骼肌衛星細胞可通過核標志、轉錄標志和膜表面標志等標志基因或衛星細胞標記、成肌細胞標記和成脂細胞標記因子來鑒定,PAX7基因廣泛表達于肌衛星細胞和成肌細胞,因此是最佳的鑒定基因。盡管qPCR、FC、IF和IHC等方法均可用來鑒定,但IF法更為直觀和準確,因此廣泛被使用。
為獲得純度、活力和分化潛能更高的豬骨骼肌衛星細胞,還需要規范和優化取材、消化、過濾、離心、培養和鑒定等步驟,建立簡便有效的體外分離培養程序。隨著新的鑒定方法的出現和新技術的普及,豬骨骼肌衛星細胞的分離培養也將更加高效便捷。

