鴨疫里默氏桿菌貴州流行株蜂膠滅活疫苗制備
馬光強,劉麗娟,陳國權,吳良濤,楊 均,劉軍澤,李瀟蒙,潘成文,周碧君
(1.黔南民族職業技術學院,都勻 558000;2.都勻市農業農村局,都勻 558000;3.貴州大學動物科學學院,貴陽 550025)
鴨疫里默氏桿菌(Riemerellaanatipestifer,RA)在世界各水禽養殖地區均有流行,該病原感染引起的雛鴨發病率和死亡率高,且近年來在中國呈上升趨勢,防控形勢愈發嚴峻,給中國養鴨業造成了巨大的經濟損失[1-5]。RA易對多種抗菌藥物產生耐藥性,臨床治療中抗菌藥物的濫用致使其耐藥性增強,對人類食品衛生安全造成威脅,因此,疫苗免疫被認為是防控該病的主要措施。RA血清型復雜,各血清型之間缺乏有效的交叉免疫保護,且不同養殖地區流行的RA血清型相差較大,需根據各地流行血清型制備滅活疫苗進行免疫防控[6-10]。
蜂膠(propolis)是蜜蜂從植物中采集的樹脂與自身分泌物混合而成的一種膠狀固體物,含維生素、脂肪酸、多糖等多種生物活性物質,具有抗氧化、抗微生物功能,可激活機體自身免疫系統,增加免疫細胞數量,增強機體免疫功能[11-14]。郭宇飛[15]研究對比了蜂膠佐劑、油佐劑和鋁膠佐劑對RA四價滅活疫苗的免疫效果,表明蜂膠佐劑疫苗具有保護力和抗體產生速度快、保護持續時間長等優勢。劉帥[16]研究對比了蜂膠佐劑和弗氏完全佐劑對殺鮭氣單胞菌滅活疫苗的免疫效果,表明蜂膠佐劑誘導機體產生的免疫效果更佳且產生的毒副作用更低。以上研究結果表明,蜂膠佐劑是一種效果良好的免疫佐劑,可用于滅活疫苗制備。本試驗用貴州省三穗縣分離的RA貴州流行株(RA-SS-8株)作為試驗菌株,以蜂膠為佐劑,進行滅活疫苗研制,以期為有效控制該地區鴨疫里默氏桿菌病奠定基礎,同時為蜂膠滅活疫苗制備和動物免疫試驗提供資料。
1 材料與方法
1.1 材料
1.1.1 試驗動物和菌株 1日齡未經免疫的清潔級麻鴨購自貴州同興農牧發展有限公司。試驗RA貴州流行株(RA-SS-8株),2019年7月分離于貴州省三穗縣某規模化養鴨場,已鑒定為RA血清2型,由貴州省動物疫病與獸醫公共衛生重點實驗室保存。
1.1.2 主要試劑及儀器 無菌脫纖維綿羊血(南京便診生物科技有限公司);胰酪大豆胨液體培養基(TSB,杭州微生物試劑有限公司);新生牛血清(浙江天杭生物科技有限公司);酵母粉和胰蛋白胨(OXOID公司);鴨傳染性漿膜炎二價滅活疫苗(1型Raf 63株+2型Raf 34株,天津瑞普生物技術股份有限公司);蜂膠(黃酮含量為17%,上海源葉生物科技有限公司);甲醛(含量為38%,西隴科學股份有限公司)。
紫外可見分光光度計(尤尼柯(上海)儀器有限公司);恒溫水浴振蕩器(上海新苗醫療器械制造有限公司);漩渦混勻器(SCILOGEX公司);電熱恒溫培養箱(上海一恒科學儀器有限公司);全溫培養搖床(上海新苗醫療器械制備有限公司)。
1.2 方法
1.2.1 RA貴州流行株的復蘇及生長曲線測定 取凍存的RA貴州流行株(RA-SS-8株),無菌操作下用接種環蘸菌液接種于巧克力瓊脂培養基上,于37 ℃、5% CO2培養箱內培養16~24 h,復蘇后觀察菌落特征做初步鑒定。挑取菌落形態典型的單個菌落接種于TSB培養基(含5%新生牛血清)進行增菌培養,經純化擴繁后作為種子菌液置于4 ℃保存。
分光光度法測定細菌生長曲線:將種子菌液按1∶100比例接種于LB培養基(含5%新生牛血清),置于37 ℃、180 r/min恒溫振蕩培養。初期每隔1 h在超凈工作臺中無菌取樣,在波長600 nm處測定光密度值(D600 nm值),當D600 nm值呈明顯上升后改為每0.5 h測定1次,在D600 nm值趨于穩定后改為每1 h測定1次,連續測定16 h,每個時間點重復測量3次后取平均值,每次取樣應留樣做好標記用于細菌平板計數,根據D600 nm值繪制標準曲線。
平板計數法測定細菌生長曲線:取不同時間段已測D600 nm值的備用菌液,混勻后用無菌PBS依次做10倍倍比稀釋(即100 μL待測菌液+900 μL無菌PBS),選取10-5、10-6、10-7和10-84個稀釋度,各取菌液100 μL涂布于巧克力瓊脂培養基上。每個梯度重復3次,待菌液完全吸收后于37 ℃、5% CO2恒溫箱內培養16 h。記錄每個平板上的菌落數,菌落數在30~300的平板計數有效,取有效計數值的平均值,根據相應的D600 nm值計算與活菌數的相關關系。
1.2.2 RA菌液制備 一級種子的增殖及鑒定:取鴨疫里默氏桿菌候選菌株,接種于含 5%新生牛血清的LB液體培養基中,37 ℃培養 16~22 h,劃線接種于含 5%新生牛血清的TSB培養基上,在含 5% CO2條件下,37 ℃培養 24~48 h,選 5~10 個圓形、凸起、透明、呈露珠樣的典型菌落,分別劃線接種于含 5%新生牛血清的TSB營養瓊脂斜面若干,37 ℃培養 24~48 h,作為一級種子,置 2~8 ℃保存,使用期不超過 7 d。二級種子的增殖及鑒定:取一級種子接種于含5%新生牛血清的LB液體培養基中,37 ℃培養 18~22 h,取樣用含 5 %新生牛血清的TSB營養瓊脂平板做純粹檢驗和活菌計數。置 2~8 ℃保存,使用期不超過 2 d。
1.2.3 RA貴州流行株蜂膠滅活疫苗的制備
1.2.3.1 滅活條件篩選 以濃度為38%的甲醛溶液作為滅活劑,采用化學滅活法對RA-SS-8株進行滅活處理。試驗分5個組,每個組4支試管,每支試管含5 mL菌液。各組分別用終濃度為0、0.1%、0.2%、0.3%和0.4%的甲醛溶液進行處理,分別于處理后6、12、18和24 h時各取100 μL涂布于巧克力瓊脂培養基上,于37 ℃、5% CO2的恒溫箱內培養24 h,根據結果確定最終的甲醛使用濃度。
1.2.3.2 蜂膠佐劑制備 將蜂膠置于-20 ℃冰箱冷凍24 h以上,取1 g蜂膠使其充分粉碎,溶于4 mL、95%乙醇中,于25 ℃恒溫水浴振蕩器中浸提72 h,期間漩渦振蕩數次。以5 000 r/min離心10 min,取上清過濾,用無菌PBS調整使其干物質含量為20 mg/mL,密封保存于4 ℃備用。
1.2.3.3 蜂膠疫苗制備 將滅活檢驗合格的菌液用無菌PBS重懸洗滌3次,并用無菌PBS調整菌液濃度為7.6×109CFU/mL。取制備的滅活菌液與蜂膠乙醇浸提液按1∶1(V/V)混合,攪拌至黃褐色混懸液獲得蜂膠滅活疫苗,無菌分裝于玻璃瓶內,經無菌檢驗合格后密封保存于4 ℃備用。
1.2.4 RA貴州流行株蜂膠滅活疫苗的檢驗
1.2.4.1 疫苗無菌檢驗 取制備好的蜂膠滅活疫苗100 μL涂布于巧克力瓊脂培養基上,于37 ℃、5% CO2恒溫箱內培養24 h,設置3個重復,觀察培養基中有無菌落生長,并做好記錄。
1.2.4.2 疫苗安全性檢驗 取菌液濃度為3.8×109CFU/mL的滅活疫苗,以2倍免疫劑量采用頸部皮下接種方式免疫10只雛鴨,記錄2周內免疫雛鴨的健康狀況及存活情況,在觀察期結束后隨機剖解免疫鴨進行大體病變觀察。
1.2.5 免疫鴨攻毒保護性試驗 將140只1日齡健康雛鴨飼養至7日齡以適應環境,將其隨機分成4組,35只/組。分別設為蜂膠滅活疫苗組、二價滅活疫苗組、PBS對照組和空白對照組,試驗動物分組與免疫見表1。對飼養至7日齡的健康雛鴨進行初免,2周后(即21日齡)對雛鴨進行二次免疫。各組接種量均為0.3 mL/只。將RA貴州流行株(RA-SS-8株)采用腿部肌內注射方法接種二免后14 d(35日齡)的試驗鴨,進行攻毒保護試驗(2×108CFU/(0.5 mL·只)),10只/組,隔離飼養,連續觀察7 d,記錄各組試驗鴨攻毒后的發病和死亡情況。取各組攻毒7 d后的試驗鴨心臟和肝臟組織,按常規方法制作組織切片進行組織病理學分析,對比各組免疫保護效果與其病理變化關系。

表1 試驗動物分組與免疫
2 結 果
2.1 RA貴州流行株生長曲線
2.1.1 RA貴州流行株生長曲線 通過分光光度法測定RA-SS-8株菌液隨培養時間變化的D600 nm值,由圖1可知,0~3 h時,細菌增殖緩慢,表明細菌生長處于遲緩期;3~10 h時,細菌增殖趨勢明顯增大,提示此時段細菌處于對數生長期;10 h以后,細菌增殖逐漸趨于平緩,表明細菌在向平穩期發展,隨著培養時間的延長,細菌最終進入衰亡期。通過分析細菌D600 nm值與培養時間的相關性可知,D600 nm值與時間的回歸方程在3~6 h時為y=0.085 6x-0.024 7(R2=0.994);3.5~6 h時為y=0.089 6x+0.043 4(R2=0.997);3.5~5.5 h時為y=0.093 5x+0.034 3(R2=0.9995)。其中以3.5~5.5 h時D600 nm值與時間的回歸方程的斜率最大,D600 nm值增長趨勢最明顯,相關系數R2最大,準確度最高(圖2)。

圖1 分光光度法測定RA生長曲線Fig.1 RA growth curve determined by spectrophotometry
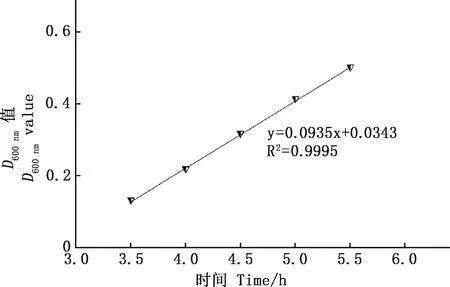
圖2 RA在3.5~5.5 h內D600 nm值與培養時間的線性關系Fig.2 The linear relationship between the D600 nm value of RA and the culture time in 3.5-5.5 h
2.1.2 RA貴州流行株D600 nm值與活菌數的相關性分析 通過平板計數法測定上述D600 nm值所對應的RA活菌數,建立RA在無菌PBS溶液中的D600 nm值與其活菌數的相關性曲線。結果顯示,RA菌液D600 nm值在0.1~0.8之間,D600 nm值與活菌數呈現出良好的線性關系,其回歸方程為y=490.26x-12.319(R2=0.997)(圖3)。在此區間,RA處于對數生長期,且D600 nm值與活菌數呈現良好的線性關系,是用作滅活疫苗制備的最佳時期。
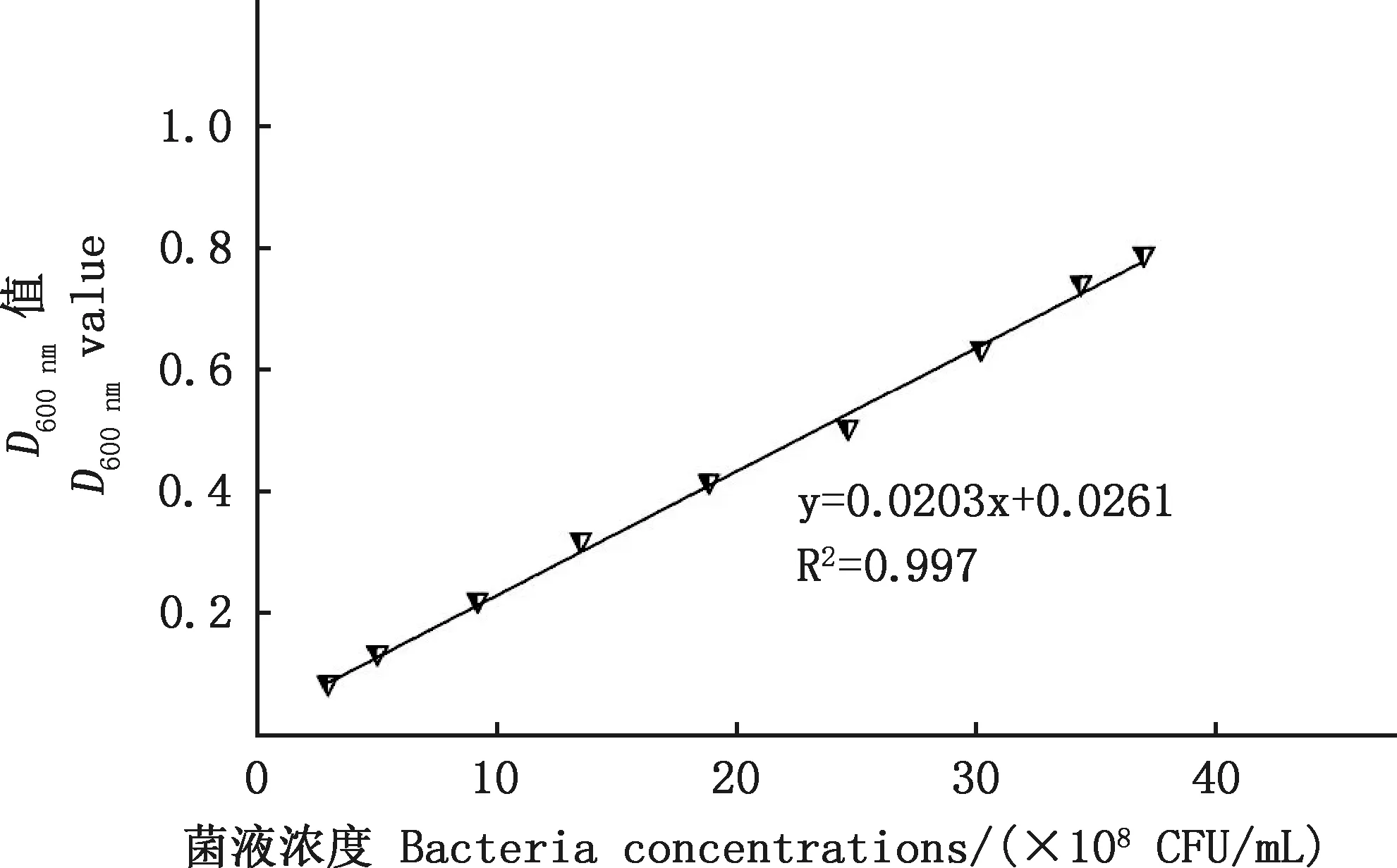
圖3 D600 nm值與RA活菌數相關性曲線Fig.3 Correlation curve between D600 nm value and number of RA viable bacteria
2.2 RA菌液制備
在實驗室條件下分別制備 3 批疫苗用菌液,純粹檢驗均合格,活菌計數結果顯示 3 批鴨疫里默氏桿菌貴州流行株(RA-SS-8株)菌液濃度分別為1.25×1010、1.27×1010和1.29×1010CFU/mL。
2.3 RA貴州流行株蜂膠滅活疫苗的制備
2.3.1 RA貴州流行株滅活條件篩選 由表2可知,未加甲醛處理組在各檢測時間段都有大量細菌生長;使用甲醛的各處理組在6 h后均未在巧克力瓊脂培養基上培養出細菌,表明RA滅活完全。為確保RA滅活完全,最終使用滅活條件為:甲醛終濃度0.2%,37 ℃、160 r/min滅活12 h。

表2 疫苗滅活條件篩選結果
2.4 RA貴州流行株蜂膠滅活疫苗的檢驗
將制備的滅活疫苗接種至巧克力瓊脂培養基上,于37 ℃、5% CO2的恒溫箱內培養24 h,觀察到所接種培養基上均無菌落生長,表明疫苗無菌檢驗合格。疫苗安全性檢驗中使用制備好的RA滅活疫苗通過2倍免疫劑量接種雛鴨,在隨后的2周觀察期中,接種鴨均未表現出不良反應,其攝食和運動功能無異常,且精神狀態良好;大體病變觀察未見明顯病變,表明所制備的疫苗安全性檢驗合格。
2.5 免疫鴨攻毒保護性試驗
2.5.1 攻毒保護率分析 免疫鴨攻毒保護試驗結果顯示,PBS對照組鴨從攻毒后第1天最先出現死亡,在攻毒后第3天全部死亡;蜂膠滅活疫苗組鴨從攻毒后第2天開始出現死亡,攻毒后第2~3天為死亡高峰期,耐受至攻毒后第4天后各試驗鴨均未再出現死亡;二價滅活疫苗組鴨未出現死亡。蜂膠滅活疫苗組和二價滅活疫苗組對RA-SS-8株的攻擊都具有良好的免疫保護作用,其中蜂膠滅活疫苗組保護率為70%,二價滅活疫苗組保護效果最佳,保護率可達100%(表3)。

表3 免疫鴨攻毒保護試驗結果
2.5.2 組織病理學分析結果 對攻毒后第7天各組試驗鴨病變較為嚴重的心臟和肝臟進行組織切片制作。心臟組織病理學觀察顯示,在免疫組中,纖維素性滲出物明顯減少,其中蜂膠滅活疫苗組與二價滅活疫苗組相比,前者除有極少量纖維素性滲出外,其余形態結構與后者相似,未見明顯病理變化(圖4A、4B);PBS對照組試驗鴨心外膜增厚,表面附有大量的纖維素性滲出物,有大量異嗜性粒細胞、單核細胞和淋巴細胞彌漫性浸潤(圖4C);空白對照組未見明顯病理變化(圖4D)。肝臟組織病理學觀察表明,在免疫組中,纖維素性滲出物明顯減少,其中蜂膠滅活疫苗組與二價滅活疫苗組相比,前者除有極少量纖維素性滲出外,其余形態結構與后者相似,未見明顯病理變化(圖4E、4F);PBS對照組試驗鴨肝臟被膜增厚,表面附有大量粉紅色網狀纖維素滲出,其間混有大量的淋巴細胞和異嗜性粒細胞浸潤,肝索結構紊亂,肝細胞腫脹變性(圖4G);空白對照組未見明顯病理變化(圖4H)。結果表明,蜂膠滅活疫苗和二價滅活疫苗對試驗鴨心臟和肝臟組織均具有良好的保護效果。

A~D,分別為蜂膠滅活疫苗組、二價滅活疫苗組、PBS對照組和空白對照組心臟;E~H,分別為蜂膠滅活疫苗組、二價滅活疫苗組、PBS對照組和空白對照組肝臟A-D,Heart of propolis inactivated vaccine,bivalent inactivated vaccine,PBS control and blank control groups,respectively;E-H,Liver of propolis inactivated vaccine,bivalent inactivated vaccine,PBS control and blank control groups,respectively圖4 試驗鴨心臟、肝臟組織病理變化(HE,200×)Fig.4 Histopathological changes in heart and liver of the test ducks (HE,200×)
3 討 論
目前,世界上已報道的RA血清型有20多種,而國內證實已存在的RA血清型共有18種,其中血清1型、2型、3型、4型在全國范圍內均有分布,其他血清型主要分布在西南和東北地區。近年來,貴州省除三穗縣外其他地區對RA血清型鮮有報道,傅心亮等[17]對貴州地區RA分離株進行血清型鑒定,結果發現以血清2型RA為主要流行菌株。吳征卓等[7]對貴州省三穗縣RA進行分離鑒定,結果證實6株RA分離株中4株為血清2型,2株為血清11型。雷云等[18-19]對分離自貴州省三穗地區某鴨場25日齡左右病死鴨的18株RA進行血清型鑒定,結果證實其中有11株鑒定為血清2型,4株鑒定為血清1型,1株血清6型和2株未定型。以上文獻資料證實血清2型RA為貴州地區主要流行菌株,鑒于此,本試驗選取血清2型RA分離株為試驗菌株,以蜂膠為佐劑成功研制滅活疫苗,為有效防控該病奠定基礎,同時對促進貴州省三穗麻鴨的健康養殖具有重要意義。
常用于研制RA滅活疫苗的免疫佐劑主要有油乳佐劑、鋁鹽佐劑和蜂膠佐劑。油乳佐劑能誘導機體產生有效的體液免疫和細胞免疫,但對機體的毒副作用較強;鋁鹽佐劑作為人類疫苗唯一使用的免疫佐劑,其毒副作用小,但佐劑活性較油乳佐劑低。蜂膠佐劑能增強機體的免疫功能且具有藥用價值。2008年,李淑娜[20]研制的RA、大腸桿菌二聯多價蜂膠疫苗安全性好、無副作用,二免后7 d進行RA攻毒保護試驗,其保護率可達90%。本試驗選用蜂膠作為RA貴州流行血清2型菌株佐劑研制蜂膠滅活疫苗,同時,將制備的RA蜂膠滅活疫苗以2倍免疫劑量采用頸部皮下接種方式免疫雛鴨并觀察2周,結果顯示,接種鴨均未表現出不良反應,同時,本試驗將制備的蜂膠滅活疫苗和商品化的二價油乳劑滅活疫苗分別免疫雛鴨,商品化疫苗組在注射部位發生局部炎癥反應,而蜂膠組無明顯異常現象,表明蜂膠滅活疫苗安全性更好,這與劉帥[16]研究結果相符。
本試驗還通過攻毒保護試驗評價蜂膠滅活疫苗組對RA人工感染的保護力,結果顯示,其免疫保護率為70%,較商品化疫苗組(100%)偏低,這與郭宇飛[15]和劉帥[16]的研究結果不符,原因可能是蜂膠滅活疫苗中抗原含量較商品化疫苗低從而誘導的免疫應答較差;其次是蜂膠滅活疫苗制備過程中乳化不完全,導致蜂膠顆粒與抗原粒子未能較好的相互交聯形成類免疫刺激復合物結構,從而影響免疫效果。但組織病理變化分析結果顯示,蜂膠滅活疫苗組和商品化疫苗組免疫鴨心臟、肝臟組織均未出現明顯病變,表明蜂膠滅活疫苗能為免疫鴨提供較為有效的保護力。
4 結 論
本試驗選取RA血清2型貴州流行株(RA-SS-8株)為基礎菌株,以蜂膠為佐劑制備滅活疫苗,成功制備了RA貴州流行株蜂膠滅活疫苗,可為蜂膠滅活疫苗制備和動物免疫試驗奠定基礎。

