影響高脂飲食誘導聯合鏈脲菌素建立2 型糖尿病大鼠模型存活率的實驗研究
朱貞洋 沈晶 陳晴晴 伍建林
1.大連大學附屬中山醫院放射科,遼寧大連 116001;2.攀枝花市中心醫院放射科,四川攀枝花 617067
糖尿病(diabetes mellitus,DM)是以高血糖為主要特征的慢性代謝性疾病,其發病率呈持續增長趨勢。中國DM人數已超過1.4億,以2型糖尿病(type 2 diabetes mellitus,T2DM)最為常見。T2DM 以持續高血糖、高胰島素血癥及胰島素抵抗為特征,臨床表現典型“三多一少”癥狀,但具體病因不明。有研究基于腸–腦軸探索腸道微生物對T2DM 及其并發癥的影響,并利用益生菌制劑治療T2DM 取得了進展。穩定可靠的T2DM 動物模型對研究其病因、病理及治療藥物開發至關重要,目前建立T2DM大鼠模型主要包括基因動物及藥物制備2 種模式,其中高脂飲食(high fat diet,HFD)誘導聯合鏈脲菌素(streptozotocin,STZ)是建立T2DM 動物模型有效且較為經濟的方法。本研究擬利用上述方法驗證其構建T2DM 大鼠模型的可行性及穩定性,并重點探究影響大鼠成模率及存活率的潛在因素。
1 材料與方法
1.1 動物及材料
雄性SD(sprague–dawley)大鼠,7~9 周齡,體質量180~220g,由遼寧長生生物技術股份有限公司提供[SCXK(遼)2020–0001]。STZ(美國Sigma公司),羅康全卓越精采型血糖儀(德國Roche 公司)。大鼠維持飼料:水分>10%、蛋白質25%、碳水化合物50%、脂肪5%及適量氨基酸和微量元素;高糖高脂飼料配方:66.5%維持飼料+10%豬油+20%蔗糖+2.5%膽固醇+1%膽酸鈉,均由小黍有泰(北京)生物科技有限公司提供[許可證號:SCXK(京)2018–0006]。大鼠飼養于大連大學附屬中山醫院動物實驗中心[SYXK(遼)2018–0005],并經大連大學附屬中山醫院實驗動物倫理委員會批準(審批號:202104012)。
1.2 動物分組及模型建立
80 只雄性SD 大鼠按購入時間隨機分為4 個批次5 個組別,分別為P1(=10)、P2(=20)、P3(=10)、P4(=30)及正常對照(normal contrast,NC)(=10)組。各組大鼠均在同一間實驗室飼養,自由攝取水和飼料,正式實驗前均適應性喂養1 周。T2DM 大鼠建模:P1~P4 組大鼠通過HFD 飼養5 周,然后禁食12h 后,均于次日上午8:00~9:00 以40mg/kg STZ溶液單次腹腔注射的方式建立T2DM 大鼠模型。STZ溶液配制方法:依據文獻[6]將STZ 溶于0.1mol/L pH 4.2~4.5 的檸檬酸鈉緩沖液中,最終濃度為0.1%。NC 組大鼠注射與體質量相符的檸檬酸鈉緩沖液,并以普通飼料喂養至實驗終止。STZ 溶液均現場配制并在30min 內完成注射,各組大鼠均由相同實驗人員、按相同操作手法給藥。
1.3 檢測指標
每周監測大鼠體質量,STZ 給藥前1 周及給藥后72h、1 周、2 周、3 周、4 周在空腹狀態下通過尾靜脈采血檢測空腹血糖(fasting blood glucose,FBG),測量當日上午7:00~9:00 禁食,下午13:00~15:00 測定。給藥后每日觀察記錄各組大鼠的一般狀況與生命體征,包括食量、飲水量、尿量、毛發顏色及精神狀態等,并記錄各組大鼠的存活時間,存活時間≥4 周者記錄為28d。查詢實驗室值班日志并記錄各模型組給藥后1 周內的實驗室溫度、濕度信息。STZ 給藥72 h 后,通過鼠尾靜脈采血測得FBG≥8.3 mmol/L 并伴有尿量及飲水量明顯增多則認為T2DM 模型成立。
1.4 統計學方法
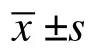
2 結果
2.1 T2DM 模型大鼠一般指標比較
模型組大鼠(P1~P4)HFD 飼養5 周后體質量顯著高于NC 組(=2.53,=0.01);模型組大鼠給藥后均伴有體質量明顯下降,顯著低于同期NC 組大鼠(<0.05),見表1。STZ 給藥前模型組和NC 組大鼠的FBG 比較差異無統計學意義(=-0.43,=0.66);給藥24h 后,模型組大鼠出現不同程度的多飲、多尿癥狀,且皮毛發黃、易脫落,多食癥狀不明顯,STZ 給藥后模型組大鼠FBG≥8.3mmol/L,顯著高于同期NC 組大鼠(<0.01),見圖1、表2。

圖1 STZ 給藥前后模型組與NC 組大鼠FBG 折線圖
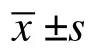
表1 STZ 給藥前后各組大鼠的體質量水平比較(,g)
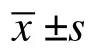
表2 STZ 給藥前后各組大鼠的FBG 比較(,mmol/L)
2.2 T2DM 模型組大鼠給藥早期與后期存活率比較
模型組大鼠給藥24h 后陸續出現死亡事件,給藥72h 模型組大鼠總存活率58.6%(41/70),NC組大鼠存活率100%(10/10),差異有統計學意義(=4.83,=0.03);給藥后期(4 周)模型組大鼠總存活率48.6%(34/70),NC 組大鼠存活率100%(10/10),差異有統計學意義(=7.39,=0.07)。P3 組大鼠死亡率最高,給藥早期(1 周)死亡率達50%(5/10),后期(4 周)死亡率達70%(7/10);P1 組大鼠死亡率最低,給藥早期、后期死亡率分別為20%(2/10)、30%(3/10);P2、P4 組大鼠早期死亡率分別為30%(6/20)、53%(16/30),后期死亡率分別為45%(9/20)、57%(17/30),模型P1~P4組間早期及后期存活率比較差異無統計學意義(早期:Fisher 值=4.88,=0.19;后期:Fisher 值=3.76,=0.31)。由圖2 可知,模型組大鼠給藥后1~3d 內的死亡率最高,給藥3d 后模型組大鼠多趨于穩定。結合檢驗,模型組大鼠給藥72h 內的總死亡率為41.4%(29/70),給藥72h~4 周的死亡率為12.2%(5/41),差異有統計學意義(=10.40,<0.01)。

圖2 模型組(P1~P4)與NC 組大鼠的生存分析
2.3 T2DM 模型組大鼠存活率的影響因素
本研究模型P1~P4 組的建模時間分別是本年度的5~8 月,實驗日志顯示建模空間環境的溫度均維持在(21±2)℃,但空氣濕度差異較大,即5、6 月份空氣相對濕度較低,分別為50%、62%,而7、8月份濕度分別高達71%、67%,均值為62.5%。基于濕度62.5%將模型組分為2 組:濕度<62.5%(P1+P2)組大鼠存活率顯著高于濕度≥62.5%(P3+P4)組(χ=4.72,=0.03),見表3。

表3 不同濕度環境下模型組大鼠STZ 給藥1 周后存活率比較
3 討論
穩定的動物模型對研究T2DM 及其并發癥具有重要的科研與臨床意義,藥物(STZ)誘導相較于手術造模和基因改造具有操作簡單和性價比高等特點。眾所周知,T2DM 病程早期以糖脂代謝紊亂及胰島素抵抗為主,病程晚期以胰島素相對缺乏為特征。因此,利用高脂飼料飼養一段時間引起實驗動物糖脂代謝紊亂并導致胰島素抵抗,再輔以小劑量STZ 破壞胰島β 細胞,能建立符合T2DM 病理生理狀態的動物模型。多數學者建議HFD 誘導時間為4~8 周,STZ 劑量以25~45mg/kg 為宜。本研究證實,HFD 飼養5 周聯合單次40mg/kg STZ 腹腔注射可成功構建SD 大鼠T2DM 模型,與既往研究一致。本研究在相同實驗條件下模型組大鼠存活率不盡相同,經回顧對比實驗各環節后發現,可能由于T2DM 建模時間選擇在夏季及本地區陰雨天較多,導致模型鼠的存活率下降,經統計分析后發現T2DM 大鼠存活率與環境空氣濕度有直接關系。
關于T2DM 動物模型成模標準尚存在爭議,但普遍以血糖升高合并T2DM 病征作為模型成功與否的判斷標準。本研究各個模型組大鼠在給藥72h后,存活大鼠FBG 均>8.3mmol/L,且連續檢測4 周血糖基本維持在較高水平,可認為T2DM 大鼠模型建立成功。T2DM 是以高血糖、高胰島素血癥及胰島素抵抗為特征的慢性系統性疾病,以肥胖者多見,多伴有典型“三多一少”癥狀。本研究中各組模型鼠亦有類似發現,表現為給藥后24h 內大鼠飲水量顯著增加,墊料呈明顯濕潤狀態,但與唐輝等研究不同,模型組大鼠多食癥狀并不明顯,推測由于長期高脂飼喂導致食欲下降所致。T2DM 大鼠不能有效利用葡萄糖,脂肪及蛋白質分解供能導致機體迅速消瘦。實驗中模型組大鼠高脂喂養5 周后體質量顯著高于NC 組,STZ 給藥后模型組大鼠體質量則出現明顯下降,給藥后1~4 周體質量均明顯低于NC 組,符合T2DM 高代謝、高消耗的特征,與Mayyas等研究結果相符。T2DM 大鼠模型建立1~4 周內,模型大鼠多飲、多尿癥狀均持續存在,FBG 維持在較高水平,體質量減低維持在338~364g,與既往研究相仿。
本研究STZ 給藥4 周模型組大鼠的總存活率為48.6%(34/70),顯著低于鐘尉等60%的存活率,其原因可能與STZ 純度、操作方法及實驗室環境等因素有關。本研究模型組大鼠給藥后72h 內的總死亡率顯著高于72h~4 周內死亡率,與既往研究相仿。目前普遍認為STZ 注射早期胰島β 細胞被破壞,大量胰島素釋放入血導致低血糖,是給藥72h內大鼠死亡的主要原因;給藥后期,T2DM 大鼠多因自身高代謝狀態、T2DM 并發癥及STZ 毒副作用死亡,但死亡率遠低于給藥早期。此外,實驗中個別大鼠因補水不及時導致在24h 內出現嗜睡并快速死亡,也提示T2DM 大鼠建模中提供充足飲水的重要性,因為缺水合并高血糖促使血漿滲透壓迅速增高而發生高滲性昏迷,是導致建模后期實驗動物突然死亡的重要誘因。另外,筆者還發現模型組大鼠給藥后1 周內死亡率亦存在較大差異,即P1 及P2組均低于50%,P3 及P4 組均高于50%。回顧實驗日志,建模時間為5~8 月,實驗室溫度基本恒定,但濕度卻有較大改變,不難發現,低濕度條件下大鼠存活率顯著高于高濕度條件,以此可認為空氣濕度是影響STZ 給藥后大鼠存活率的關鍵因素,低濕度環境造模更有助于提高大鼠的存活率。研究發現高濕度環境會導致大鼠免疫功能紊亂及多臟器損傷,筆者推測這亦是高濕度環境下T2DM 造模死亡率較高的原因之一。
本研究仍存在以下不足:①HFD 誘導聯合低劑量STZ 是建立T2DM 動物模型常規方法,本研究參考既往文獻將空腹血糖顯著升高及存在糖尿病特征作為模型建立標準,未結合生化指標綜合評估模型鼠狀態;②鑒于不能對大鼠實時監控,模型組大鼠給藥后存活時間粗略以“天”計算,與大鼠實際生存時間存在一些不可避免的誤差。另外,本研究設置的終點事件為“給藥后4 周”,觀察時間相對較短。
總之,本研究驗證了HFD 誘導聯合小劑量STZ單次腹腔注射建立較為穩定T2DM 大鼠模型的可行性,操作簡單,成模率較為理想,且研究中發現空氣濕度對模型鼠存活率有較大影響,較低的空氣濕度更有利于提高給藥后模型鼠的存活率,對后續類似研究有參考價值。由于T2DM 大鼠自身高代謝狀態及STZ 的毒副作用,給藥后24~72h 模型組大鼠死亡率最高,給藥1 周后T2DM 大鼠大多趨于穩定,此階段應注意模型大鼠的日常護理,尤其要保證飲水充足。

