Wnt/β-catenin通路介導的cSN50.1對高糖誘導HK-2細胞轉分化的影響
欒海艷 譚晶 趙曉蓮 孫潔 張國艷 辛華
(佳木斯大學 1 基礎醫學院,黑龍江 佳木斯 154007;2微生態-免疫調節網絡與相關疾病重點實驗室;3附屬第一醫院)
據流行病學調查顯示,我國65歲以上的糖尿病患者約為3 550萬,占世界糖尿病老年患者的1/4,居全球首位〔1〕。老年糖尿病的特點是患者年齡較大、病程較長,罹患慢性并發癥的風險和病情危重程度較高,其致殘和致死率也較其他患者更高〔2〕。糖尿病腎臟病(DKD)是糖尿病最常見和最嚴重的并發癥之一,且一旦出現,多數將發展成終末期腎病(ESRD),同時也是糖尿病致殘致死的重要原因〔3,4〕。因此,如何有效防治糖尿病腎臟病已成為臨床目前十分重要和急需解決的問題。本文擬分析人工合成的多肽cSN50.1對人腎小管上皮細胞HK-2轉分化的影響及其作用機制。
1 材料與方法
1.1材料 細胞:人腎近曲小管細胞HK-2來源于北京北納創聯生物技術研究院。主要試劑:細胞培養用試劑均來源于美國HyClone公司、浙江天杭生物科技股份有限公司、上海碧云天生物技術有限公司;CCK-8細胞增殖及毒性檢測試劑盒和XAV939〔β-連環蛋白(catenin)抑制劑〕、甘露醇、D-半乳糖均來源于大連美侖生物技術有限公司;α-平滑肌肌動蛋白(SMA)鼠抗人多克隆抗體,波形蛋白(Vimentin)、E-鈣黏蛋白(cadherin)、β-catenin、組蛋白(Histone)、β-肌動蛋白(actin)兔抗人多克隆抗體均來源于Affinity Biosciences公司;辣根過氧化物酶標記的山羊抗兔IgG和山羊抗鼠IgG均來源于武漢博士德生物工程有限公司;Western印跡及蛋白提取所用相關試劑均來源于上海碧云天生物技術有限公司和武漢博士德生物工程有限公司;cSN50.1多肽由吉爾生化(上海)有限公司合成。
1.2細胞培養 把HK-2細胞置于5%CO2,37℃的培養箱,用含15%胎牛血清和1%青-鏈霉素雙抗(100×)的DMEM培養液進行培養。當細胞生長至密度80%~90%時,用胰蛋白酶消化,按1∶3進行傳代。
1.3CCK-8細胞增殖實驗 將處于對數生長期的HK-2細胞消化后調整濃度至1.0×105個/ml,按100 μl/孔接種至96孔板,待其完全貼壁后,隨機分為0、10、30、50 μmol/L組,棄去培養液,分別給予相應濃度cSN50.1進行干預48 h,再加入CCK-8溶液10 μl/孔,培養箱中繼續孵育4 h;全自動酶標儀檢測各孔的光密度值(450 nm 波長)。
1.4細胞形態觀察實驗 將HK-2細胞消化后分為6組:對照組、HO組、HG組、cSN50.1各劑量組(10、30、50 μmol/L),對照組采用正常DMEM培養液進行培養,HO組采用含24.5 mmol/L甘露醇的DMEM培養液進行培養,HG組采用含高糖的DMEM培養液(25 mmol/L D-半乳糖)進行培養,cSN50.1各劑量組分別采用含10、30、50 μmol/L cSN50.1的高糖培養液進行培養48 h,再于倒置顯微鏡下觀察記錄各組HK-2細胞的形態變化情況。
1.5Western印跡實驗 將HK-2細胞分為5組:對照組、HO組、HG組、XAV939組和cSN50.1組。對照組、HO組、HG組培養條件同前,XAV939組采用含1 μmol/L的XAV939高糖DMEM培養液進行培養,cSN50.1組采用含30 μmol/L cSN50.1的高糖DMEM培養液進行培養(cSN50.1劑量由前述實驗結果選出),培養48 h后,采用Western印跡技術檢測各組HK-2細胞的蛋白表達情況。細胞總蛋白采用含1 mmol/L PMSF的RIPA裂解液提取后用于檢測α-SMA、Vimentin和E-cadherin蛋白表達情況;采用亞細胞結構胞核與胞質蛋白抽提試劑盒分別提取HK-2細胞的胞質和胞核蛋白后檢測其β-catenin蛋白的表達情況。二喹啉甲酸(BCA)法檢測已提取蛋白的濃度,95℃5 min進行蛋白加熱變性。按照每孔20 μg蛋白上樣,12%分離膠行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE);恒流200 mA進行濕轉;室溫條件下用5%的脫脂奶粉封閉1 h,再加入適宜比例的一抗,4℃過夜孵育。次日,用TBST洗液洗膜3次,室溫孵育相應的二抗1 h;再次TBST洗膜3次,電化學發光(ECL)顯影,采用凝膠成像分析系統曝光、拍攝和分析。細胞中α-SMA、Vimentin和、E-cadherin蛋白和胞質β-catenin蛋白的表達結果以目的蛋白與β-actin灰度值的比值來表示其相對含量,胞核β-catenin蛋白的表達結果以目的蛋白與Histone灰度值比值來表示其相對含量。
1.6統計學分析 采用SPSS22.0統計軟件進行t檢驗。
2 結 果
2.1cSN50.1對HK-2細胞增殖的影響 與0 μmol/L組(3.72±0.03)相比,10 μmol/L組和30 μmol/L組OD值(3.73±0.06、3.77±0.11)均無明顯變化(P>0.05),而50 μmol/L組(2.34±0.24)明顯降低(P<0.05)。
2.2cSN50.1對高糖誘導HK-2細胞形態的影響 對照組和HO組均呈“鋪路石”樣的典型上皮樣細胞形態;無明顯差異;HG組細胞變為長梭形,且大小和形態不一;給予cSN50.1干預后,10、30、50 μmol/L組長梭形細胞均明顯減少,但50 μmol/L組細胞數量有所減少。見圖1。

圖1 各組細胞形態(×100)
2.3cSN50.1對高糖誘導HK-2細胞中α-SMA、Vimentin和E-cadherin蛋白表達的影響 與對照組相比,HO組細胞中α-SMA、Vimentin和E-cadherin蛋白表達均無明顯變化(P>0.05),HG組α-SMA和Vimentin蛋白表達均明顯增高,而E-cadherin蛋白表達明顯降低(P<0.05)。給予XAV939干預后,與HG組相比,XAV939組α-SMA和Vimentin蛋白表達均明顯降低,E-cadherin蛋白表達明顯增高(P<0.05);給予cSN50.1干預后,與HG組相比,cSN50.1組細胞中α-SMA和Vimentin蛋白表達均明顯降低、E-cadherin蛋白表達明顯增高(P<0.05)。見表1,圖2。
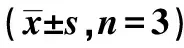
表1 各組細胞中α-SMA、Vimentin、E-cadherin和β-catenin蛋白表達
圖2 各組細胞中α-SMA、Vimentin和 E-cadherin蛋白表達
2.4cSN50.1對高糖誘導HK-2細胞中胞核內外β-catenin蛋白表達的影響 與對照組相比,HO組胞質和胞核中β-catenin蛋白表達無明顯變化(P>0.05),而HG組表達均明顯增高(P<0.05)。與HG組相比,給予XAV939干預后,胞質和胞核中β-catenin蛋白表達明顯降低(P<0.05);而給予cSN50.1干預后,β-catenin蛋白表達在胞質中無明顯變化(P>0.05),但在胞核中明顯降低(P<0.05)。見表1,圖3。
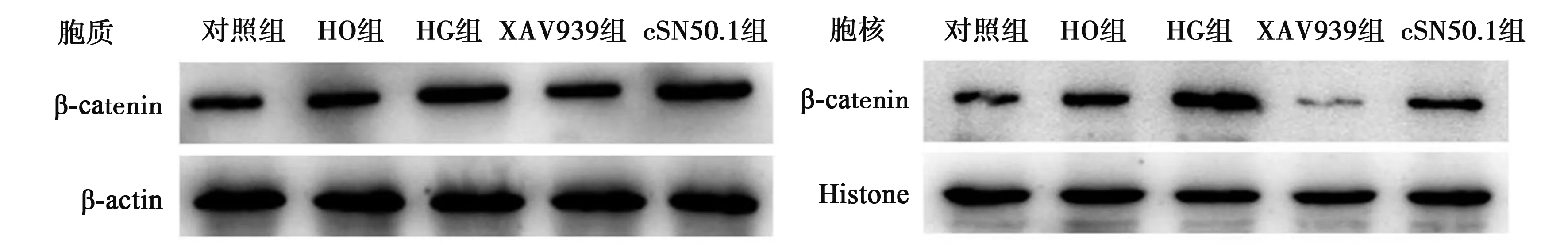
圖3 各組細胞中β-catenin蛋白的表達
3 討 論
腎小管間質纖維化(TIF)是早期糖尿病腎臟病的病理變化之一,當糖尿病患者尿白蛋白排泄率還處于正常范圍內時,作為早期腎小管間質病變的敏感生物標志物的腎損傷分子(KIM)-1就已經顯著升高,且增高程度與腎小管病變程度呈正相關〔5〕。腎小管間質纖維化不但在糖尿病腎臟病的發病時間和機制上均具有獨立性〔6,7〕,還是所有腎臟疾病發展至終末期腎衰竭的共同特征之一。且其發生發展過程中的最關鍵環節是腎小管上皮細胞-間充質轉分化(EMT),此時的小管上皮細胞已喪失了黏附特性,其表皮黏附分子E-cadherin的表達降低〔8〕,而間充質細胞表型蛋白α-SMA和Vimentin的表達則上升〔9〕,導致細胞外基質(ECM)大量堆積,細胞因子出現異常表達。本研究發現高糖誘導HK-2細胞中的α-SMA和Vimentin蛋白表達增高,E-cadherin蛋白表達降低,與相關研究報道一致〔10〕。
β-catenin是一種細胞骨架蛋白,是Wnt/β-catenin信號轉導通路中的關鍵性分子,在多種病因誘發的腎間質纖維化中均發揮重要作用〔11~13〕。β-catenin可與E-cadherin在細胞膜上結合形成細胞黏附連接復合體,通過介導同型細胞之間的黏附,來維持正常上皮細胞的完整性和極性,從而防止細胞遷移發生。當Wnt信號轉導通路被異常激活時,E-cadherin/β-catenin復合體將發生解聚,使細胞的黏附能力降低;同時胞質內游離的β-catenin則因為不能被及時磷酸化降解,大量在胞質內積聚,并被轉運入胞核內與TCF/LEF轉錄因子(TCF/LEF)結合,引起下游的致EMT和纖維化的靶基因表達增強,繼而腎小管上皮細胞基底膜被破壞,細胞發生轉分化和遷移,進而導致腎小管間質纖維化的發生和發展〔14,15〕。本研究結果表明Wnt/β-catenin信號轉導通路可能參與了高糖誘導的HK-2細胞轉分化。
cSN50.1是一種人工合成的細胞核轉運調節肽(NTM),為26 或28 個氨基酸片段連接的多肽,由人類成纖維細胞生長因子-4 疏水區信號序列(SSHR)和人核因子(NF)-κB1核定位序列組成。核轉運蛋白(importin)能識別胞質內中大分子量蛋白中的核定位信號(NLS),與之結合后形成復合物,再經核孔復合體(NPC)把其運輸到細胞核內,家族成員包括importin α和importin β,可以單獨或聯合起來完成核轉錄因子的入核轉運〔16,17〕。有文獻報道,cSN50.1能與importin α5和importin β1結合,競爭性抑制importin對核轉錄因子的入核轉運〔18,19〕。而importin β1又可以調控膠質瘤細胞中β-catenin的入核轉運〔20〕。本研究結果提示,cSN50.1能夠改善高糖誘導HK-2細胞轉分化,且該作用可能是通過調控β-catenin入核轉運,進而影響EMT相關因子表達實現的。

