下調miR-34a對PC12細胞阿爾茨海默病體外模型細胞凋亡和氧化損傷的影響
張麗 覃雪 何高見 羅愛華 高霞
(1達州市中心醫院老年病科,四川 達州 635000;2達州職業技術學院臨床醫學院;3達州市中心醫院心身醫學科)
阿爾茨海默病是一種慢性中樞神經系統疾病,其發病較為隱匿,主要表現為獲得性知識障礙、記憶力減退,常常伴隨有工作、生活等正常行為障礙〔1〕。阿爾茨海默病是僅次于心腦血管疾病、腦卒中、癌癥之后的影響老年人生活質量的常見疾病,阿爾茨海默病已經成為世界范圍內的熱點問題〔2〕。阿爾茨海默病的病理學特征為神經元丟失、大腦皮質萎縮及β-淀粉樣蛋白(Aβ)沉積形成老年斑等,目前阿爾茨海默病的發病機制還沒有完全闡明,其中Aβ神經毒性研究較為透徹〔3〕。Aβ沉積產生的老年斑是阿爾茨海默病發生的重要原因。Aβ25~35是阿爾茨海默病發生的關鍵毒性物質,其可以誘導神經細胞氧化損傷,促進細胞凋亡發生〔4〕。研究顯示,阿爾茨海默病還與miRNA的異常表達有關,miRNA參與影響神經細胞損傷過程〔5〕。miR-34a是一個在人體內廣泛表達的小分子RNA,參與細胞生長、凋亡等過程〔6〕。以前的研究發現,miR-34a在阿爾茨海默病中表達上調,并且抑制miR-34a可以提高caspase-3活化水平,miR-34a在阿爾茨海默病中可能發揮促進作用〔7,8〕。本研究以PC12細胞為研究對象,用Aβ25~35處理構建PC12細胞阿爾茨海默病體外模型,探討miR-34a在阿爾茨海默病神經細胞氧化損傷和細胞凋亡中的作用。
1 材料與方法
1.1材料 PC12細胞購自通派(上海)生物科技有限公司;p-蛋白激酶B(AKT)抗體購自美國Santacruze;Aβ25~35購自美國Sigma;inhibitor control、miR-34a inhibitor由上海吉瑪制藥技術有限公司合成;活性氧(ROS)水平檢測試劑盒購自上海前塵生物科技有限公司;AKT抗體購自美國Proteintech;Lipofectamine 2000購自美國Invitrogen;超氧化物歧化酶(SOD)水平檢測試劑盒購自碧云天生物技術有限公司;引物由廣州伯信生物科技有限公司合成;谷胱甘肽過氧化物酶(GSH-Px)水平檢測試劑盒購自北京雷根生物技術有限公司;活化的含半胱氨酸天冬氨酸蛋白水解酶(C-caspase)-3抗體購自美國Cell Signaling Technology。
1.2細胞分組及轉染 PC12細胞分為空白對照組(Control)組、Aβ25~35組、Aβ25~35+Anti-NC組、Aβ25~35+Anti-miR-34a組、Aβ25~35組、Aβ25~35+Anti-NC組、Aβ25~35+Anti-miR-34a組細胞分別在實驗開始時用含有Aβ25~35濃度為20 μmol/L的細胞培養液培養,Aβ25~35+Anti-NC組、Aβ25~35+Anti-miR-34a組細胞分別為轉染inhibitor control、miR-34a inhibitor的PC12細胞,細胞轉染步驟完全按照Lipofectamine 2000轉染試劑操作說明進行。
1.3實熒光定量(qRT)-聚合酶鏈反應(PCR)檢測miR-34a表達 Control組、Aβ25~35組、Aβ25~35+Anti-NC組、Aβ25~35+Anti-miR-34a組細胞培養24 h以后,收集細胞,在細胞中添加Trizol試劑,提取細胞中的總RNA,配制去除基因組DNA反應體系,包括:2 μl的5×gDNA Eraser緩沖液、200 μg總RNA、1 μl的gDNA Eraser,添加RNase free H2O至10 μl。在上述體系中添加1 μl PrimerScript RT Enzyme Mix I、3 μl的miRNA RT Primer、4 μl的5×PrimeScript緩沖液,添加RNase free H2O至20 μl,放在37℃孵育15 min,放在85℃孵育5 s,合成cDNA。配制PCR體系,包括:1 μl的cDNA模板、10 μl的SYBR Primer Ex Taq、0.4 μl的上游和下游引物,添加ddH2O至20 μl,PCR程序設置為:95℃預變性30 s;95℃變性5 s;60℃退火20 s,40個循環。根據反應得到的Ct值,按照2-△△Ct法計算miR-34a表達水平,內參為U6。引物序列為:U6上游:5′-CTCGCTTCGGCAGCACA-3′,下游:5′-AACGCTTCACGAATTTGCGT-3′;miR-34a上游:5′-GGCAGTGTCTTAGCTGGTTGTA-3′,下游:5′-GTGCAGGGTCCGAGGT-3′。
1.4四甲基偶氮唑藍(MTT)比色法檢測細胞增殖 PC12細胞按照Control組、Aβ25~35組、Aβ25~35+Anti-NC組、Aβ25~35+Anti-miR-34a組分組方法接種到96孔板內,放在37℃,5% CO2培養箱中培養24 h。取出培養板,在每個孔中添加10 μl的MTT溶液,放在37℃孵育4 h。然后將孔內的上清溶液棄掉,添加150 μl的二甲基亞砜溶液,震蕩反應10 min。酶標儀上測定每個孔450 nm OD值,以OD值代表細胞增殖能力。
1.5流式細胞術檢測細胞凋亡 Control組、Aβ25~35組、Aβ25~35+Anti-NC組、Aβ25~35+Anti-miR-34a組細胞培養24 h以后,收集細胞,用冰預冷以后的磷酸鹽緩沖液(PBS)反復懸浮洗滌2次以后,在細胞中添加200 μl的Binding緩沖液充分混合,再吸取5 μl碘化丙啶(PI)及膜聯蛋白V-異硫氰酸熒光素(Annexin V-FITC)溶液添加到細胞中,放在室溫條件下結合孵育15 min,用流式細胞儀檢測之前再添加300 μl的Binding緩沖液。
1.6Western印跡檢測細胞中C-caspase-3、p-AKT、AKT蛋白表達 Control組、Aβ25~35組、Aβ25~35+Anti-NC組、Aβ25~35+Anti-miR-34a組細胞培養24 h以后,收集細胞,添加RIPA蛋白裂解試劑,放在冰上裂解20 min,4℃,12 000 r/min離心10 min。收集上清溶液,用二喹啉甲酸(BCA)法測定提取蛋白濃度,放在-80℃保存備用。配制十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)凝膠,分離膠濃度為10%,濃縮膠濃度為5%。在蛋白上樣孔內添加30 μg的蛋白樣品,蛋白樣品在上樣之前需要與等體積的電泳緩沖液混合煮沸5 min。設置電泳電壓為100 V,電泳30 min以后,將電壓設置為120 V,繼續電泳2.5 h。取出凝膠,置于轉膜緩沖液中浸泡5 min。將聚偏氟乙烯(PDVF)膜也浸泡在轉膜緩沖液中。以400 mA的電流轉膜50 min。取出NC膜,放在含有5%牛血清白蛋白的封閉液中孵育結合2 h,然后將NC膜放在含有1∶200稀釋的C-caspase-3抗體、1∶600稀釋的p-AKT抗體、1∶800稀釋的AKT抗體中,放在4℃條件下孵育過夜。將PDVF膜置于1∶2 000稀釋的二抗溶液中,在室溫中孵育2 h。電化學發光(ECL)方法發光,分析條帶的灰度值。內參為GAPDH,分析目的條帶的表達變化。
1.7ROS、SOD、GSH-Px水平檢測 Control組、Aβ25~35組、Aβ25~35+Anti-NC組、Aβ25~35+Anti-miR-34a組細胞培養24 h以后,收集細胞,分別用ROS、SOD、GSH-Px水平檢測試劑盒檢測ROS、SOD、GSH-Px水平,步驟完全按照試劑盒說明進行。ROS水平檢測結果以Control組作為內參,分析相對熒光強度。
1.8AKT信號抑制劑對下調miR-34a的PC12細胞增殖、凋亡和ROS、SOD、GSH-Px水平影響 取轉染miR-34a inhibitor后的PC12細胞,用含有Aβ25~35濃度為20 μmol/L和LY294002濃度為50 μmol/L的細胞培養液培養,計為Aβ25~35+Anti-miR-34a+LY294002組,以Aβ25~35+Anti-miR-34a組作為對照,細胞培養24 h后,MTT法檢測細胞增殖,流式細胞術檢測細胞凋亡,Western印跡檢測細胞中C-caspase-3、p-AKT、AKT蛋白表達,試劑盒檢測ROS、SOD、GSH-Px水平,步驟同上。
1.9統計學分析 采用SPSS21.0軟件進行單因素方差分析。
2 結 果
2.1miR-34a inhibitor對Aβ25~35條件下PC12細胞中miR-34a表達的影響 與Control組(1.00±0.08)比較,Aβ25~35處理以后的PC12細胞中的miR-34a表達水平(1.90±0.12)明顯升高(P<0.05);轉染miR-34a inhibitor后的PC12細胞經過Aβ25~35處理以后,細胞中的miR-34a表達水平(0.75±0.06)較Aβ25~35+Anti-NC組(1.89±0.16)明顯下降(P<0.05)。提示miR-34a inhibitor下調Aβ25~35條件下PC12細胞中miR-34a表達水平。
2.2miR-34a inhibitor對Aβ25~35條件下PC12細胞增殖和凋亡影響 Aβ25~35處理以后的PC12細胞增殖能力明顯下降,細胞凋亡率明顯升高,細胞中C-caspase-3蛋白表達水平明顯升高(P<0.05);轉染miR-34a inhibitor后的PC12細胞經過Aβ25~35處理以后,細胞增殖能力明顯升高,細胞凋亡率明顯降低,細胞中C-caspase-3蛋白表達水平明顯降低(P<0.05)。見圖1、圖2、表1。提示miR-34a inhibitor提高Aβ25~35條件下PC12細胞增殖能力并減少細胞凋亡。
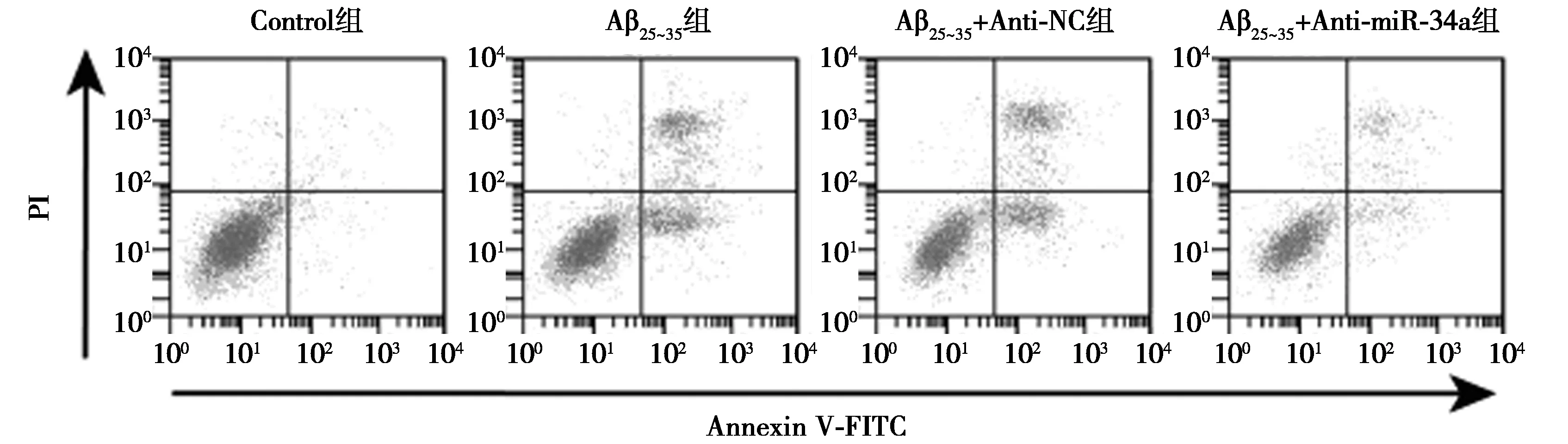
圖1 流式細胞術檢測細胞凋亡

1~4:Control組,Aβ25~35組,Aβ25~35+Anti-NC組,Aβ25~35+Anti-miR-34a組;圖3同圖2 Western印跡檢測C-caspase-3蛋白表達
表1 各組PC12細胞OD值、凋亡率和 C-caspase-3蛋白水平比較
2.3miR-34a inhibitor對Aβ25~35條件下PC12細胞中ROS、SOD、GSH-Px水平影響 Aβ25~35處理以后的PC12細胞中ROS水平明顯升高,SOD、GSH-Px水平明顯下降(P<0.05);轉染miR-34a inhibitor后的PC12細胞經過Aβ25~35處理以后,細胞中ROS水平明顯降低,SOD、GSH-Px水平明顯升高(P<0.05)。見表2。提示miR-34a inhibitor提高Aβ25~35條件下PC12細胞中抗氧化酶SOD、GSH-Px活性,減少細胞中ROS積累。
表2 各組PC12細胞中ROS、SOD、 GSH-Px水平比較
2.4miR-34a inhibitor對Aβ25~35條件下PC12細胞中AKT信號影響 Aβ25~35處理以后的PC12細胞p-AKT蛋白水平明顯下降(P<0.05);轉染miR-34a inhibitor后的PC12細胞經過Aβ25~35處理以后,細胞中p-AKT蛋白水平明顯升高(P<0.05)。見圖3、表3。提示miR-34a inhibitor提高Aβ25~35條件下PC12細胞中AKT信號激活水平。
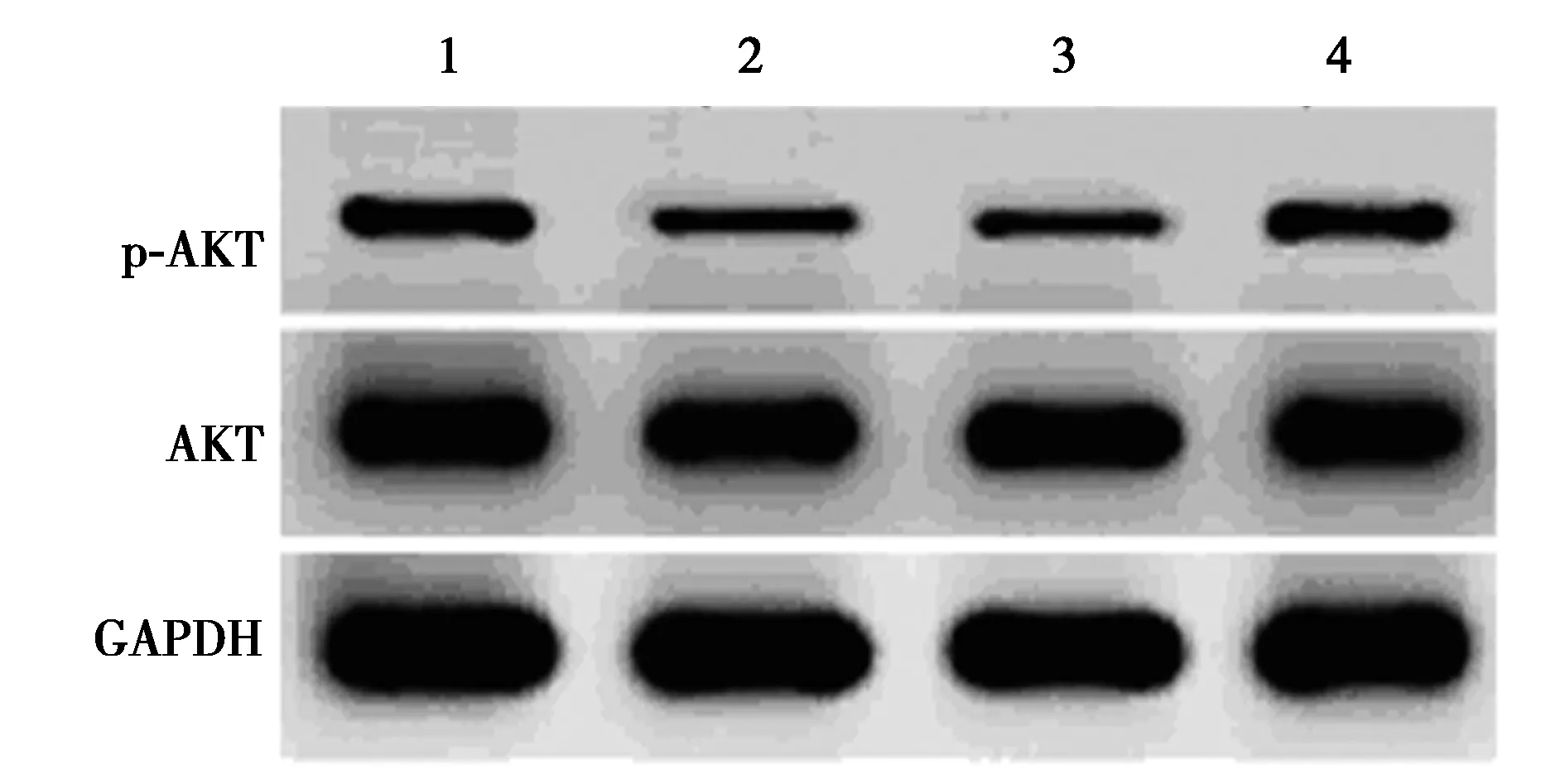
圖3 Western印跡檢測各組PC12細胞 p-AKT、AKT蛋白水平
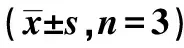
表3 各組PC12細胞中p-AKT、 AKT蛋白水平比較
2.5AKT信號抑制劑對miR-34a inhibitor激活Aβ25~35條件下PC12細胞中AKT信號的影響 AKT信號抑制劑處理后的轉染miR-34a inhibitor的Aβ25~35條件下PC12細胞中p-AKT蛋白水平明顯下降(P<0.05)。見圖4、表4。提示AKT信號抑制劑減弱miR-34a inhibitor對Aβ25~35條件下PC12細胞中AKT信號激活作用。
2.6AKT信號抑制劑對miR-34a inhibitor影響Aβ25~35條件下PC12細胞增殖、凋亡和ROS、SOD、GSH-Px水平的作用 AKT信號抑制劑處理后的轉染miR-34a inhibitor的Aβ25~35條件下PC12細胞OD值明顯降低,細胞凋亡率明顯升高,細胞中C-caspase-3蛋白水平明顯升高,細胞中ROS水平明顯升高,SOD、GSH-Px水平明顯下降(P<0.05)。見圖5、表5、圖6。提示AKT信號抑制劑逆轉miR-34a inhibitor對Aβ25~35條件下PC12細胞增殖、凋亡和ROS、SOD、GSH-Px影響。

1~2:Aβ25~35+Anti-miR-34a組,Aβ25~35+Anti-miR-34a+LY294002組;圖6同圖4 Western印跡檢測兩組PC12細胞 p-AKT、AKT蛋白水平
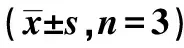
表4 兩組PC12細胞中p-AKT、 AKT蛋白水平比較
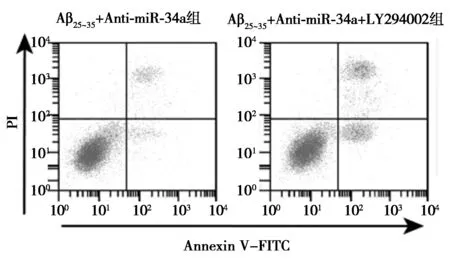
圖5 流式細胞術檢測兩組細胞凋亡
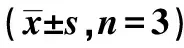
表5 兩組PC12細胞OD值、凋亡率、C-caspase-3蛋白水平和ROS、SOD、GSH-Px水平比較
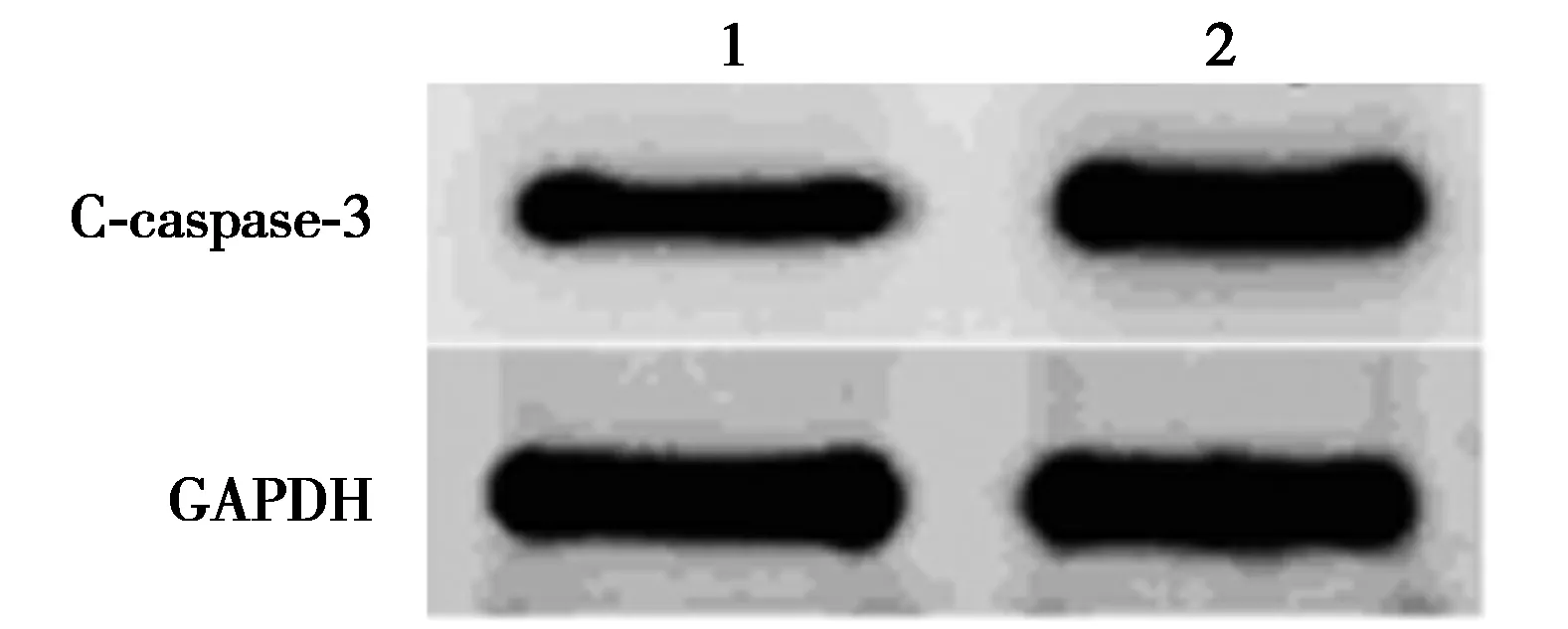
圖6 Western印跡檢測兩組C-caspase-3蛋白表達
3 討 論
Aβ是常用的體外研究阿爾茨海默病細胞模型誘導因子〔9〕。氧化損傷可以誘導細胞凋亡發生。研究顯示,機體內的SOD、GSH-Px等抗氧化酶活性下降以后,細胞內的ROS不能被及時清除而聚集在細胞內,過量的ROS能夠激活細胞內的caspase凋亡反應,誘導細胞凋亡發生〔10〕。caspase-3是caspase凋亡反應的下游因子,也是細胞凋亡的執行因子,其活化后形成C-caspase-3能夠不可逆的誘導細胞凋亡發生〔11〕。本研究結果提示Aβ25~35誘導PC12細胞凋亡和氧化損傷,說明構建了PC12細胞阿爾茨海默病體外模型。
miRNA是一種非編碼的RNA,其長度一般在20 nt左右,在自然界真核生物體內廣泛存在〔12〕。miRNA功能多樣,其參與不同類型細胞生長、凋亡、能量代謝、氧化應激等生理過程,miRNA是一個重要調控因子〔13〕。有研究報道顯示,miRNA還與多種人類疾病的發生有關,miRNA可能是疾病治療的分子標志物〔14〕。最近的研究顯示,miRNA參與阿爾茨海默病的發生,其與神經損傷有關〔15〕。以前的研究發現,miR-34a在阿爾茨海默病中表達上調,并且下調miR-34a可降低caspase-3活化水平〔6,7〕。本研究結果說明下調miR-34a可以改善PC12細胞阿爾茨海默病體外模型損傷,這與上述研究結果相符合,均證實下調miR-34a可能具有改善阿爾茨海默病的作用。
AKT信號通路在人體內的多個生理以及病理過程中均發揮重要作用,其可以影響細胞的生長、代謝、凋亡、衰老等過程,AKT磷酸化水平升高后標志著AKT信號通路被激活〔16~19〕。研究顯示,AKT在阿爾茨海默病中激活水平下降,并且抑制AKT信號通路促進Aβ25~35條件下PC12細胞凋亡和損傷〔20~22〕。本實驗顯示,AKT信號通路抑制劑可以逆轉下調miR-34a對Aβ25~35條件下PC12細胞增殖、凋亡和氧化損傷的作用,提示下調miR-34a通過激活AKT信號改善PC12細胞阿爾茨海默病體外模型損傷。
綜上,miR-34a在阿爾茨海默病中可能發揮促進作用,下調其表達可以減少PC12細胞阿爾茨海默病體外模型細胞凋亡,改善氧化損傷,作用機制與激活AKT信號有關。以后實驗中應探討miR-34a通過何種靶向調控機制影響AKT信號通路及細胞凋亡和氧化損傷。

