1株產纖維素酶細菌的內切-β-葡聚糖苷酶的分離純化及其酶學性質
郭建華, 蔣海嬌, 郭宏文, 鄒東恢, 王 燕
(齊齊哈爾大學食品與生物工程學院,黑龍江齊齊哈爾 161006)
纖維素酶在飼料工業、食品工業、洗滌工業及紡織工業中具有廣泛的利用前景。大多數細菌所產纖維素酶與真菌來源的酶性質不同,某些方面具有真菌酶不可替代的作用,因此細菌纖維素酶在工業生產中的地位逐漸提高。其中,產纖維素酶的芽孢桿菌逐漸成為近年研究熱點。自1960年來,對纖維素酶的分離純化開展了廣泛的科學探索。微生物所產纖維素酶是由多種酶組分組成的復雜酶系統,將酶從系統中分離純化出來是精確研究它們的前提。酶的分離純化技術有多種,一是可根據蛋白質熱穩定性差異進行分離純化;二是利用酶蛋白溶解特性的不同進行分離純化,可利用鹽分級沉淀或利用雙水相體系進行分離純化,如Liu等利用響應面法優化了雙水相體系(ATPS)對貝萊斯芽孢桿菌所產的纖維素酶的分離純化工藝;三是利用電泳和液相色譜技術分離純化,主要作用是檢測酶蛋白的分子量和純度;四是利用分子篩凝膠色譜、離子交換色譜等色譜層析分離純化,如江小妹等采用Q-瓊脂糖凝膠FF陽離子交換層析和葡聚糖G-100凝膠層析對團頭魴腸道菌株MA35所產的內切型纖維素酶進行分離純化,酶的比活力由22.3 U/mg提高至 30.6 U/mg。實際研究工作中,一般要采用多種分離技術對纖維素酶進行分離純化。Clare等利用4 mol/L蔗糖溶液透析、Q-Sepharose FF離子交換色譜和苯基Sepharose CL-4B疏水作用色譜對球形芽孢桿菌CE-3產生的纖維素酶進行純化,利用SDS-PAGE電泳檢測酶的分子質量。王婷婷等利用(NH)SO分級沉淀、DEAE Sepharose Fast Flow陰離子交換層析和Phenyl Sepharose 6 Fast Flow疏水層析,從文蛤(L.)中分離純化出1種纖維素酶,分離純化后的纖維素酶比活力達到40.33 U/mg,純化倍數達13.12。目前為止,在纖維素酶分離純化方面,存在著純化倍數較低、回收率低、純化不完全等問題,同時很多分離純化技術僅能局限于實驗室層面,影響對酶的特性的研究及其應用。針對來源和種類眾多的纖維素酶體系的各個組分,研究開發分離純化手段是提高純化倍數和提高回收率等問題的關鍵所在。
本研究以選育得到1株產纖維酶細菌的突變菌株為試驗菌株,利用硫酸銨鹽析、疏水相互作用色譜、離子交換層析及分子篩凝膠色譜從其發酵液中分離純化內切--葡聚糖苷酶(CMC酶),測定分離純化后的酶的純度、分子量及部分酶學特性,以期為菌株所產纖維素酶的應用提供實驗基礎。
1 材料與方法
1.1 試驗菌株
菌株DM-4,筆者所在實驗室從白酒酒醅中選育得到,經鑒定該菌為枯草芽孢桿菌()。試驗于2020年6—10月在齊齊哈爾大學食品與生物工程學院實驗室進行。
1.2 實驗方法
1.2.1 培養基 種子培養基:牛肉膏0.5%,蛋白胨1%,NaCl 0.5%,pH值7.5~7.6,121 ℃下滅菌30 min。
發酵培養基:麩皮(過80目篩)2.54%,蛋白胨0.92%,KHPO0.50%,NaCl 0.50%,硫酸鎂0.02%,pH值為6.0~6.5,121 ℃下滅菌30 min。
1.2.2 酶液的制備 將菌株DM-4接種在種子培養基上,置于恒溫搖床內,溫度37 ℃、轉速 180 r/min 條件下培養12 h作為種子。將種子液以5%接種量接種至發酵培養基內,溫度37 ℃、轉速231 r/min發酵36 h。將發酵液倒入離心管內,于溫度4 ℃、轉速5 000 r/min條件下離心10 min,得到粗酶液。
1.2.3 內切型--葡聚糖酶(CMC酶)活力的測定 內切型--葡聚糖酶(CMC酶)活力的測定見參考文獻[12]。
1.2.4 蛋白質含量的測定 280 nm()光吸收法:利用試驗用緩沖溶液將分光光度計調至零;利用分光光度計檢測樣品在280 nm波長下的吸光度。
或采用Folin-酚法測定,見參考文獻[13]。
1.2.5 內切--葡聚糖苷酶的分離純化
1.2.5.1 硫酸銨鹽析 將酶液裝入8個試管內(每管5 mL),放入冰水浴中,向管內緩慢加入粉末硫酸銨,使硫酸銨飽和度分別為20%、30%、40%、50%、60%、70%、80%和90%。4 ℃放置12 h,離心后測定酶液CMC酶活。
取300 mL離心除去菌體粗酶液,緩緩加入粉末硫酸銨至分級鹽析沉淀條件下限,4 ℃放置12 h,離心后測定清液體積。向清液中緩緩加入粉末硫酸銨至分級沉淀條件的上限,4 ℃放置12 h。離心棄上清,將沉淀溶于30 mL 0.1 mol/L檸檬酸0.2 mol/L NaHPO緩沖液(pH值7.0)中。
1.2.5.2 透析脫鹽 將透析袋剪成約20 cm長度,放入碳酸氫鈉(2%)和EDTA(1 mmol/L)混合溶液中,加熱沸騰10 min。清洗干凈放入EDTA(1 mmol/L)溶液中加熱沸騰10 min,降溫后浸在乙醇溶液(20%)中冰箱4 ℃存放。
取1 000 mL燒杯加入蒸餾水,加入攪拌轉子,將燒杯放在磁力攪拌器上,把復溶酶液倒入透析袋內,止水夾夾住末端,裝進燒杯內在4 ℃低溫下進行脫鹽。每2 h換水,將BaCl溶液滴入燒杯內,若無沉淀出現,則脫鹽過程結束,后利用聚乙二醇(分子量20 000)將酶液濃縮。
1.2.5.3 Sephadex G-25 凝膠色譜分離 通過Sephadex G-25 凝膠色譜層析對鹽析并脫鹽后的酶液脫色和交換緩沖液。柱型:2.6 cm×30 cm,洗脫液:0.02 mol/L PBS 緩沖液(pH值7.0,硫酸銨飽和度30%);流速:2 mL/min,每管6 mL。檢測每個管內液體的吸光度及CMC酶活力,混合具有活性的液體。
1.2.5.4 Phenyl-Sepharose HP 疏水相互作用色譜分離 柱型:2.6 cm×15 cm;起始緩沖液:0.02 mol/L PBS 緩沖液(pH值7.0,硫酸銨飽和度30%);洗脫液:0.02 mol/L PBS緩沖液(pH值為7.0);流速:2 mL/min。上樣后起始緩沖溶液恒流洗至吸光度()接近于0,再用起始緩沖溶液和等體積洗脫液進行線性梯度洗脫;每管收集6 mL。檢測每個管內液體的吸光度及CMC酶活力,混合具有活性的液體。
1.2.5.5 CM-Sepharose FF 弱陽離子交換色譜分離 將Phenyl-Sepharose HP分離收集的液體透析脫鹽,再利用CM-Sepharose FF進一步分離純化。
吸附pH值的確定:準備6個小燒杯,每個燒杯放入1 mL處理好的CM-Sepharose FF,采用濃度為0.02 mol/L PBS(pH值分別為5.0、5.5、6.0、6.5、7.0和7.5)5 mL漂洗樹脂10次,每個燒杯內PBS高出約1 cm,每個燒杯內移入1 mL酶液,混勻,靜置約10 min,取上清液檢測其殘留酶活,計算酶活殘留率(%),確定最佳吸附pH值。
柱型:2.6 cm×15 cm;起始緩沖液:0.02 mol/L PBS緩沖液(pH值為5.5、6.0);流速:2.0 mL/min;上樣后用起始緩沖液沖洗至接近于0,按照NaCl濃度遞增方向采用起始緩沖液和等體積含NaCl 0.8 mol/L(0.5 mol/L)的洗脫液進行梯度洗脫;每管收集6 mL。檢測每個管內液體的吸光度及CMC酶活力,混合具有活性的液體。
1.2.5.6 Superdex 75 凝膠色譜分離 將離子交換色譜后處理后的液體,透析脫鹽濃縮后通過Superdex 75進一步分離提純。柱型:Superdex 75 16/60 預裝柱;洗脫液:0.02 mol/L PBS緩沖液(0.5 mol/L NaCl,pH值7.0);洗脫液體積:120 mL;流速:1.0 mL/min;每管收集1 mL。檢測每個管內液體的吸光度及CMC酶活力,混合具有活性的液體。
1.2.5.7 純度檢測及分子量的測定 利用SDS-PAGE電泳檢測酶的純度。
1.2.6 內切--葡聚糖苷酶酶學特性測定
1.2.6.1 最適作用溫度及熱穩定性測定 取分離提純后的酶液稀釋后,在溫度30、35、40、45、50、55、60、65、70 ℃的水浴條件下測定CMC酶活力。
將上述酶液置于40、50、60、70、80 ℃的水浴中,每隔20 min檢測CMC酶活力,計算殘留率(%)。
1.2.6.2 最適作用pH值及pH穩定性測定 采用pH值分別為4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0和8.5的醋酸-醋酸鈉溶液制備羧甲基纖維素鈉溶液(1%)作為底物,取純化后的酶液適當稀釋后,檢測CMC酶活力。
取純化后酶液適當稀釋后分成6份,分別加入雙倍體積的pH值為4.0、5.0、6.0、7.0、8.0及9.0醋酸-醋酸鈉溶液,放入40 ℃水浴中,每20 min檢測CMC酶活1次,計算殘留率(%)。
1.2.6.3 酶的反應動力學常數和的測定 將純化后酶液利用醋酸-醋酸鈉溶液(pH值7.5)稀釋30倍,取1 mL加入1 mL采用醋酸-醋酸鈉溶液制備不同濃度的CMC-Na溶液(pH值7.5),使酶液進反應時底物濃度分別為10、8、6、4、2 g/L,反應溫度和pH值設在最適條件下。每種底物濃度分別于0、5、10、15、20、25 min采用DNS法測定還原糖含量。繪制還原糖含量與時間的變化曲線,進行二次回歸求得,利用L-B法作圖計算和。
2 結果與討論
2.1 酶的分離純化
2.1.1 硫酸銨沉淀 利用不同飽和度硫酸銨進行沉淀試驗確定鹽析條件,由表1可知,隨硫酸銨飽和度增加,上清中殘余酶活逐漸降低,當硫酸銨飽和度達70%時,上清液中的殘留酶活已降至1.02%。因此,確定硫酸銨的飽和度沉淀區間為20%~70%。沉淀采用緩沖液溶解后,再充分透析脫鹽。
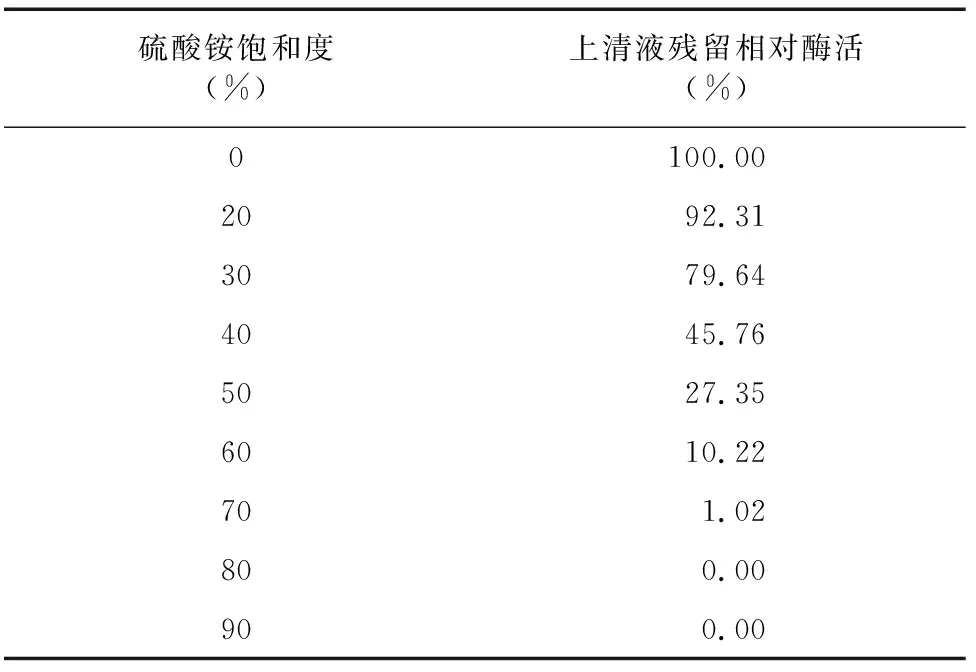
表1 硫酸銨不同飽和度的上清液酶活殘留率
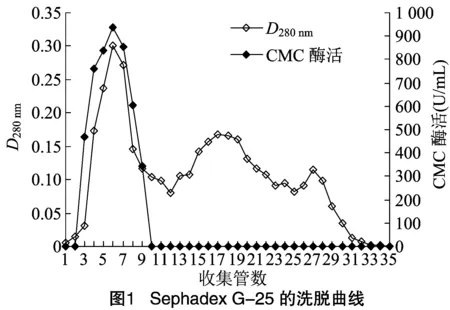
2.1.2 Sephadex G-25凝膠分離 本研究采用分子量范圍為100~5 000 u Sephadex G-25,對經20%~70%飽和度硫酸銨處理的酶脫色和初步分離,洗脫曲線。由圖1可知,洗脫時CMC酶組分首先被洗脫下來,可推測菌株DM-4所產CMC酶的分子量 > 5 000 u。酶的活性峰和蛋白峰相對應,提示Sephadex G-25凝膠去除色素和分離較小的雜質蛋白效果理想。
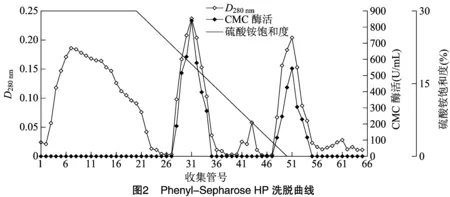
2.1.3 Phenyl-Sepharose HP 疏水相互作用色譜分離結果 經過Sephadex G-25凝膠分離后,收集的活性組分過度到硫酸銨飽和度為30%緩沖體系,進行下一步Phenyl-Sepharose HP分純。由圖2可知,恒洗過程中疏水性較弱的雜質去除了很多。在硫酸銨飽和度線性降低的梯度洗脫過程中分離出2個CMC酶活性組分,命名為CMC酶Ⅰ和CMC酶Ⅱ。CMC酶Ⅰ在梯度洗脫中期被洗脫下來,其活性較高,CMC酶Ⅱ在梯度洗脫結束時被洗脫下來,說明CMC酶Ⅱ 疏水性強于酶Ⅰ。
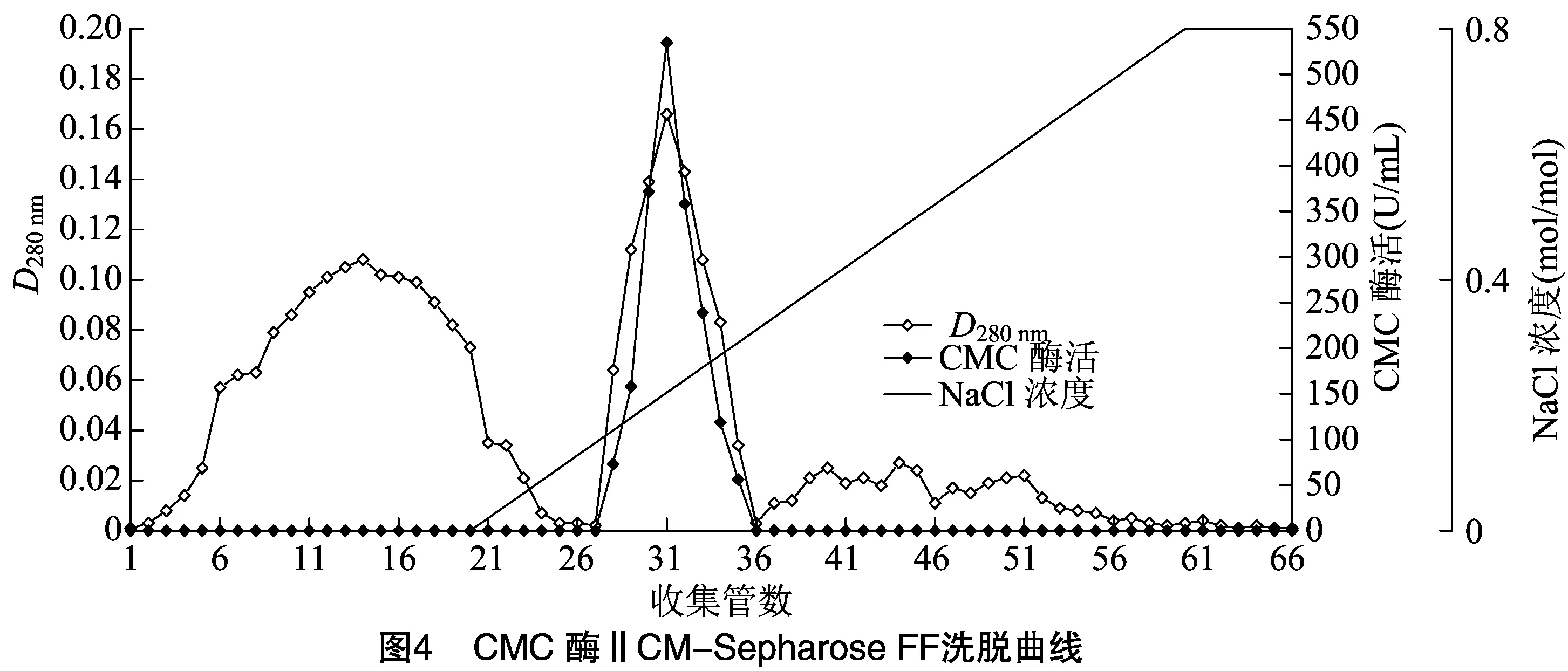
2.1.4 CM-Sepharose FF 弱陽離子交換色譜分離 利用CM-Sepharose FF將經疏水相互作用分純收集到的CMC酶Ⅰ和CMC酶Ⅱ活性組分再次分純。由表2、表3可知,CMC酶Ⅰ和CMC酶Ⅱ分別在pH值5.5和pH值6.0時吸附效果最好,因此,起始緩沖液pH值分別確定為pH值5.5和pH值6.0。經多次試驗比較后,對CMC酶Ⅰ選擇 0.8 mol/L NaCl溶液為洗脫液,對CMC酶Ⅱ選擇0.5 mol/L NaCl溶液為洗脫液。
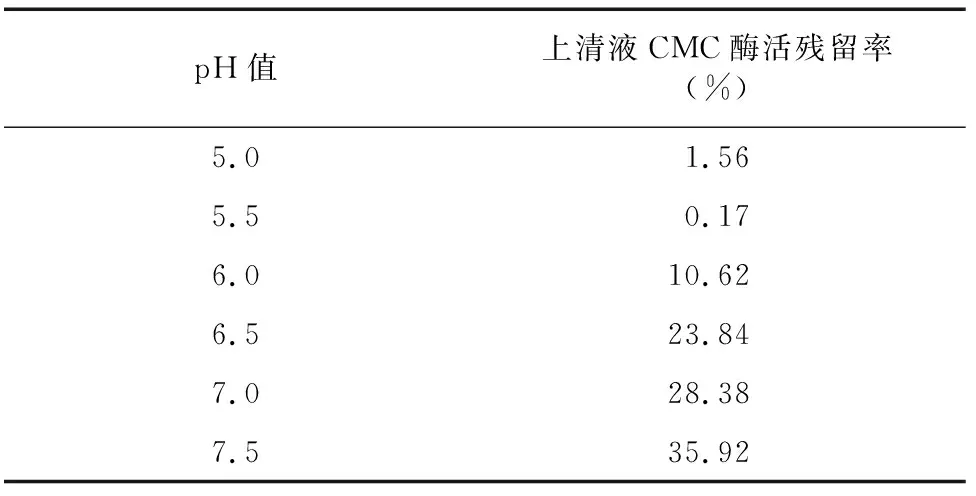
表2 不同pH值緩沖液樹脂對CMC酶Ⅰ吸附效果
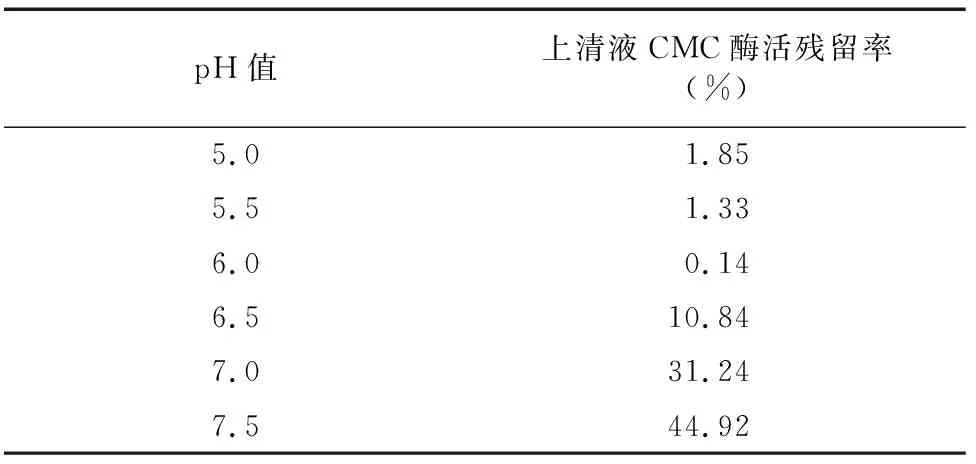
表3 不同pH緩沖液樹脂對CMC酶Ⅱ吸附效果
由圖3和圖4可知,在各自優化條件下,CMC酶Ⅰ和CMC酶Ⅱ均能很好地與填料結合,在恒洗階段,活性組分未被洗脫,而雜蛋白在恒洗階段被大量洗脫。梯度洗脫時酶活性組分被洗脫下來,并且酶活性峰與蛋白峰基本對應。

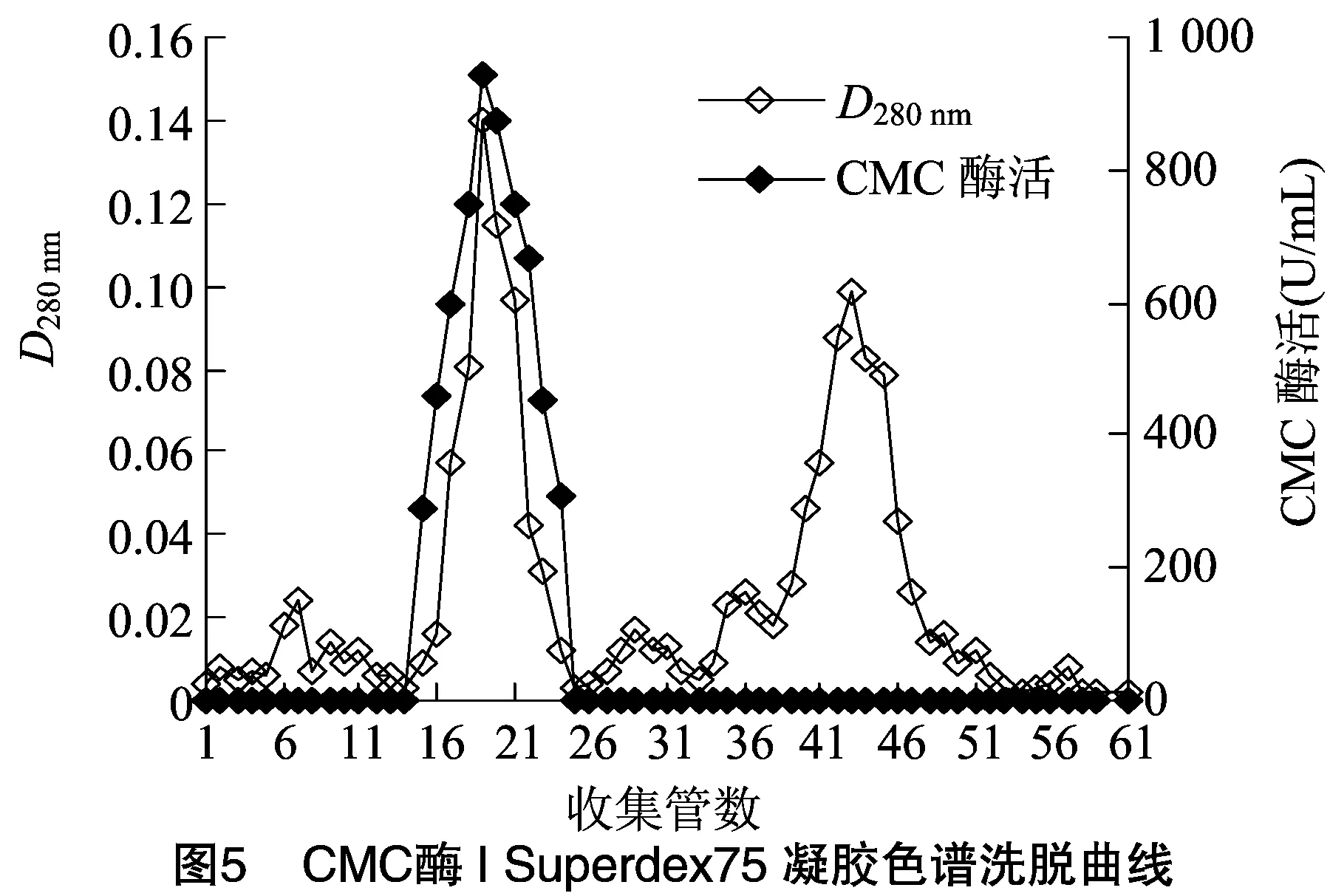
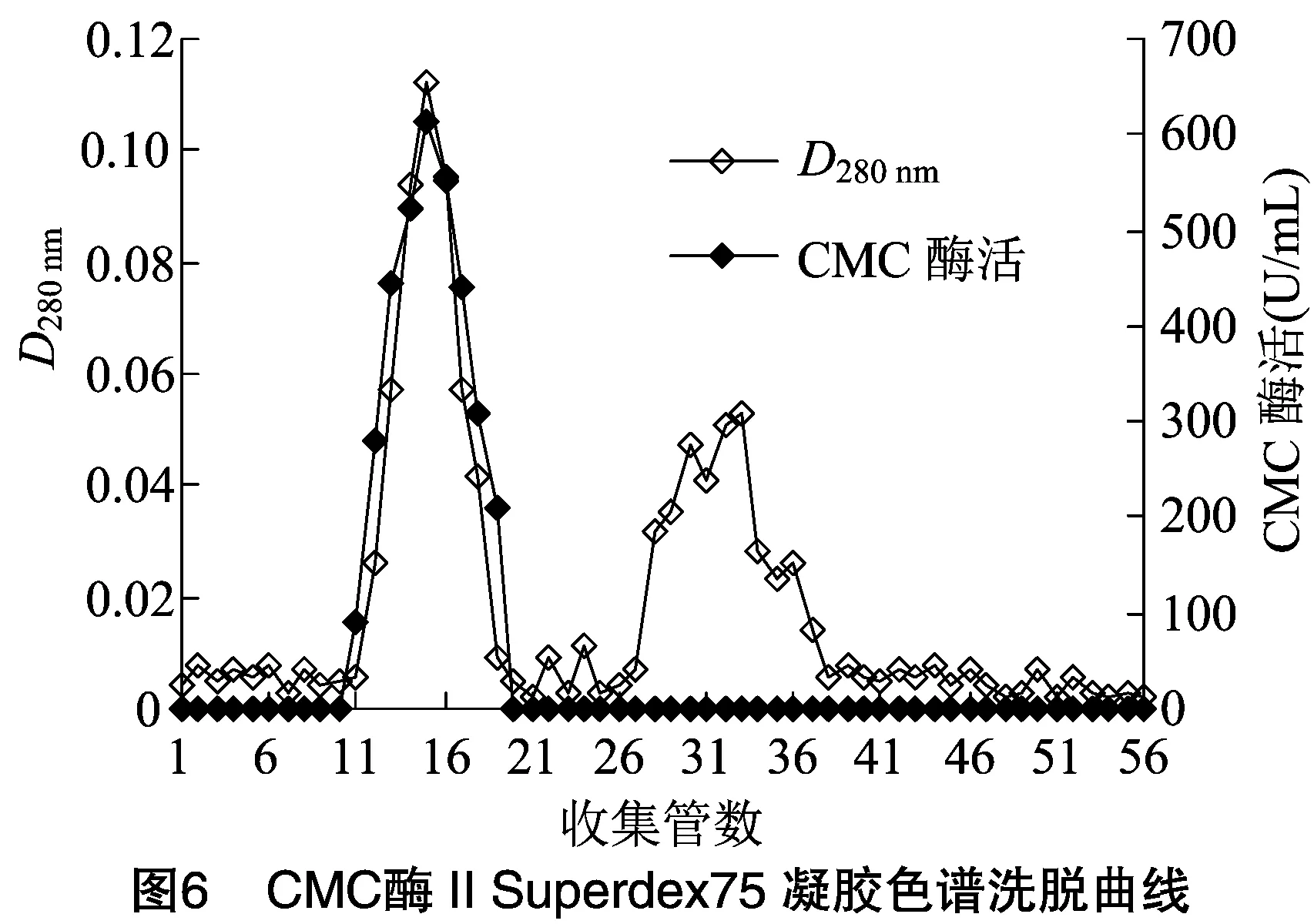
2.1.5 Superdex 75凝膠過濾色譜分離 將CMC酶Ⅰ和CMC酶Ⅱ活性組分脫鹽濃縮后,進行Superdex 75分離。由圖5、圖6可知,在洗脫過程CMC酶蛋白峰與其他蛋白峰分開,并且與活性峰完全對應, 說明CMC酶Ⅰ和CMC酶Ⅱ均已達比較理想的純化效果,分別將CMC酶Ⅰ和CMC酶Ⅱ的活性組分收集,-20 ℃保存備用。
2.1.6 CMC酶Ⅰ和CMC酶Ⅱ分離純化回收后的結果 由表4、 表5可知, 經Phenyl-Sepharose HP疏水相互作用色譜處理后,CMC酶Ⅰ和CMC酶Ⅱ比活力分別達960.82、717.19 U/mL,純化倍數為 19.33倍和14.43倍,提示 Phenyl-Sepharose HP疏水相互作用色譜分離是適合用于菌株DM-4所產內切纖維素酶的一種分離手段。經CM-Sepharose FF處理后,純化倍數進一步提高,最后經過Superdex 75處理后,純化倍數分別達45.94倍和32.27倍。
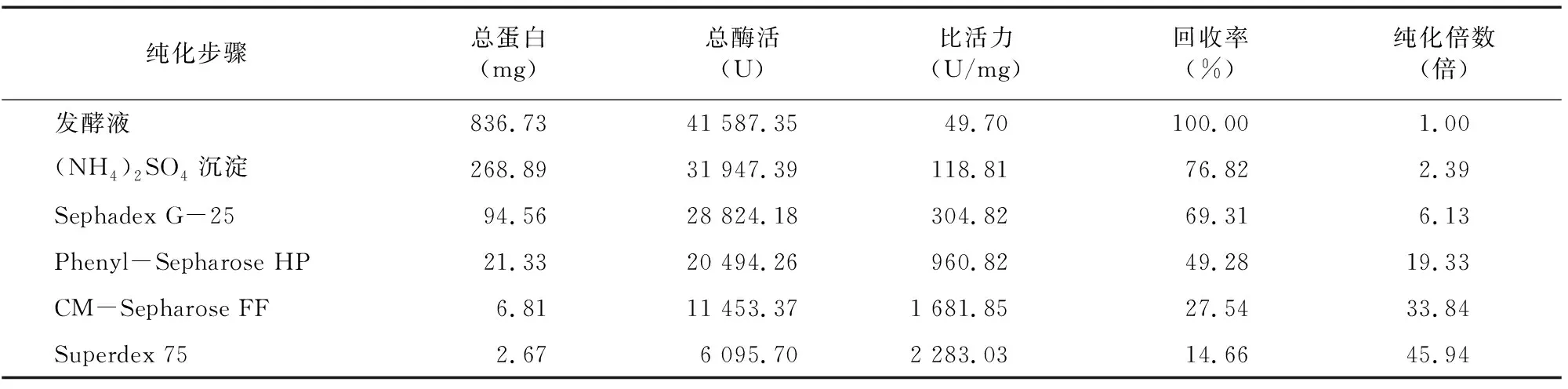
表4 CMC酶Ⅰ純化結果
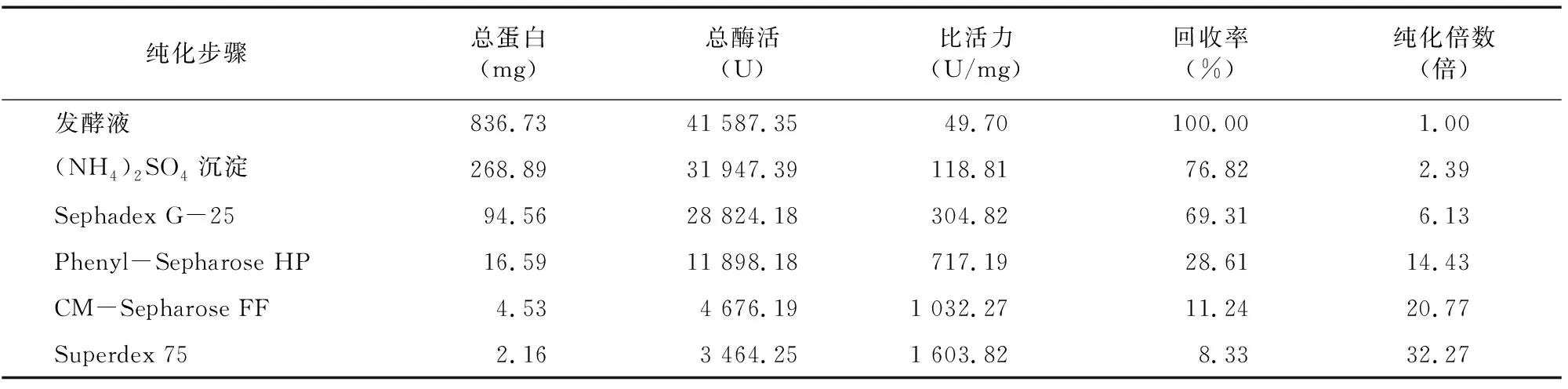
表5 CMC酶Ⅱ純化結果
2.1.7 CMC酶純度檢驗及分子量檢測 利用 SDS-PAGE 電泳檢測CMC酶純度及其相對分子質量,由圖7可知,經分離純化得到CMC酶Ⅰ及CMC酶Ⅱ均已達電泳級別純度。由圖8可知,利用Mark中蛋白分子量的對數和遷移率繪制蛋白分布曲線。根據CMC酶Ⅰ和CMC酶Ⅱ的相對遷移率大小及分布曲線,計算得到CMC酶Ⅰ分子量約38.99 ku,CMC酶Ⅱ分子量約45.53 ku。
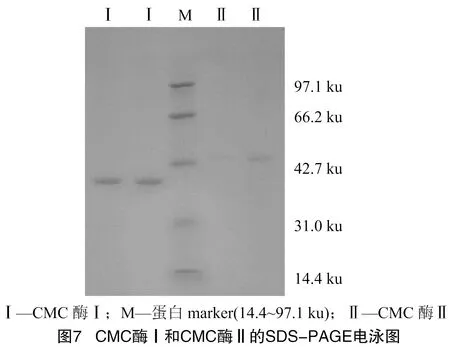
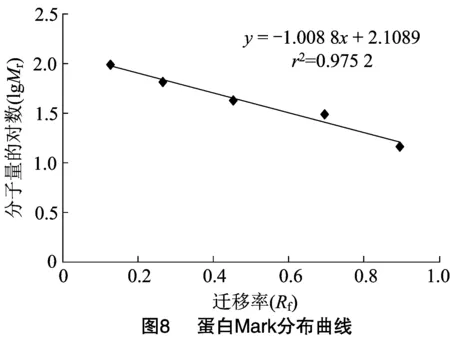
這與其他學者分離純化出的細菌內切纖維素酶具有一些差別,如Aa等從枯草芽胞桿菌中純化的CMC酶分子量為70 ku。Allardyce等從某細菌中獲得的2種CMC酶分子量分別為53 ku和 52 ku。Yan等從蠟樣芽孢桿菌中獲得的CMC酶分子量為51.3 ku。Lo等純化出得活性CMC酶分子量約35.8 ku。Zakaria等從枯草芽胞桿菌菌株KU-1獲得的CMC酶分子量為39~40 ku。
2.2 菌株所產內切-β-葡聚糖苷酶的酶學性質
2.2.1 酶最適作用溫度及熱穩定性檢測 將純化后的CMC酶Ⅰ和CMC酶Ⅱ適當稀釋后,于不同溫度條件分別檢測其活力大小。由圖9可知,CMC酶Ⅰ在60 ℃反應條件下表現出最高活力,CMC酶Ⅱ 在55 ℃反應條件下表現出最高活力。
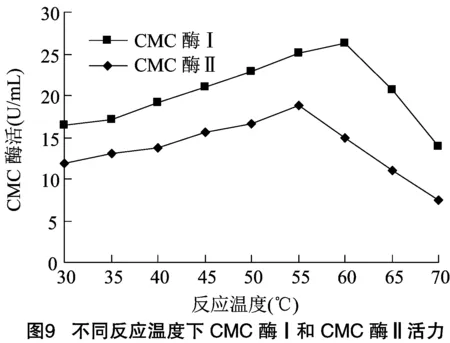
經差異顯著性檢測,55 ℃與60 ℃時,CMC酶Ⅰ的酶活不具有顯著差異(<0.05),55 ℃與其他溫度下酶活差異顯著(<0.01);CMC酶Ⅱ在55 ℃時酶活與其他溫度下均具有顯著差異(<0.01)。因此,確定CMC酶Ⅰ最適作用溫度范圍為55~60 ℃,CMC酶Ⅱ為55 ℃。
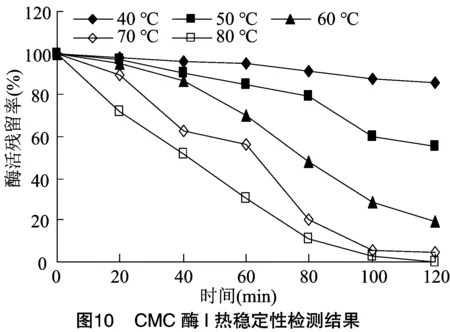
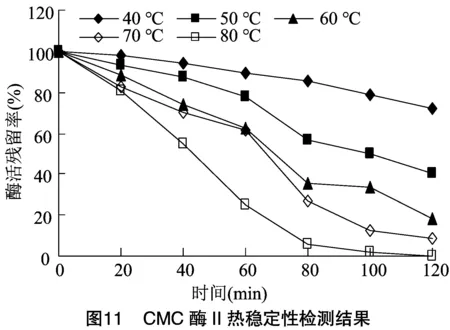
將純化稀釋后的CMC酶Ⅰ和CMC酶Ⅱ分別放置在不同溫度水浴中,每20 min取樣檢測酶活,計算殘留率。由圖10、圖11可知,當溫度低于70 ℃時,在60 min前,CMC酶Ⅰ和CMC酶Ⅱ殘留率均大于50%,穩定性良好。當溫度升高至80 ℃后,隨時間延長酶活殘留降低很快,直至完全喪失活力,但在80 ℃保溫60 min后,仍具有25%以上的殘留率,提示CMC酶Ⅰ和CMC酶Ⅱ耐溫性較強。本研究所分離的2種纖維素酶的最適溫度和耐熱性與吳石金等和Xu等獲得的CMC酶具有相似性。
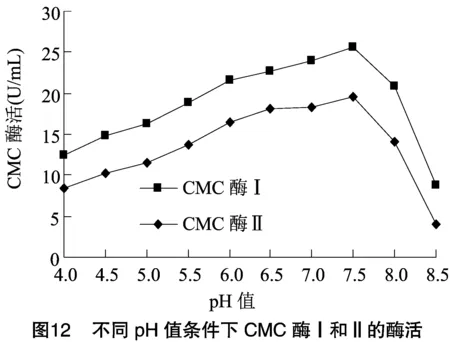
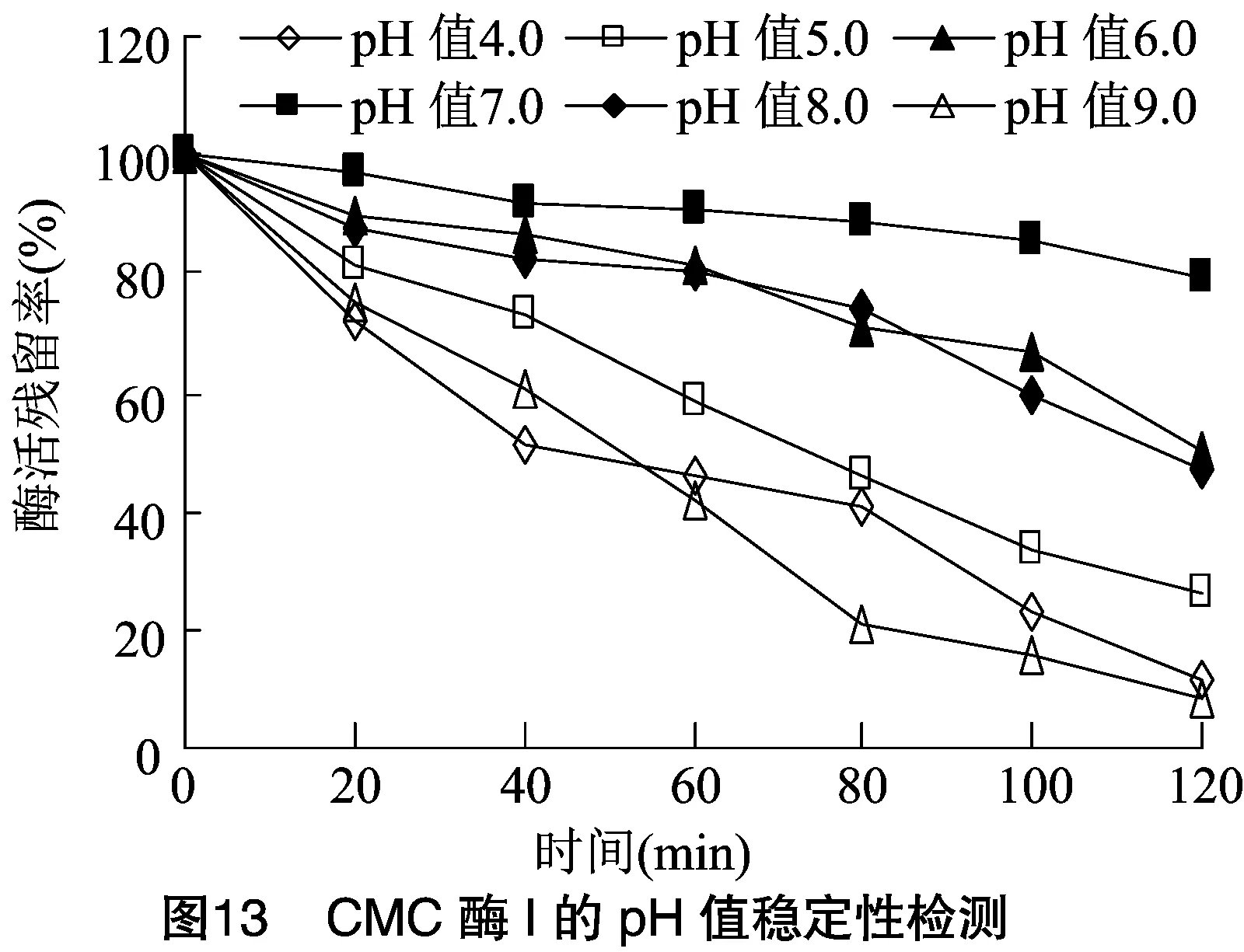
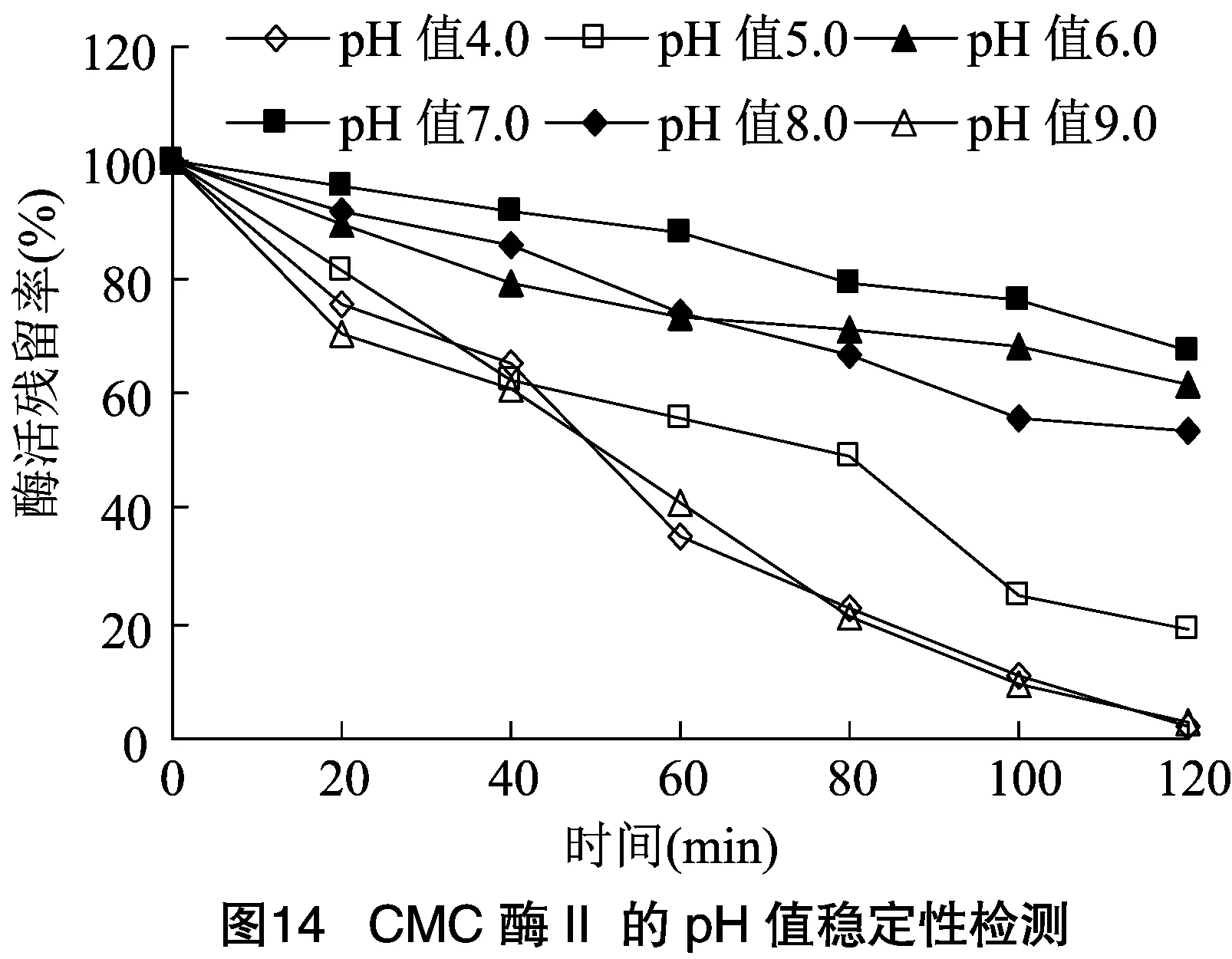
2.2.2 酶的最適作用pH值及酶的pH值穩定性 將分離純化的CMC酶Ⅰ和CMC酶Ⅱ適當稀釋,于不同pH值反應體系中檢測酶活力大小。由圖12可知,CMC酶Ⅰ和CMC酶Ⅱ在pH值為7.5時均具有最大酶活力,可確定pH值7.5是2種酶最適作用pH值。由圖13、圖14可知,2種酶在pH值為6.0~8.0范圍內均具有良好穩定性,而在其他pH值條件下,酶活下降速度很快,與其他研究者試驗結果相似。根據本試驗結果可初步確定此次分離的CMC酶為中性纖維素酶。
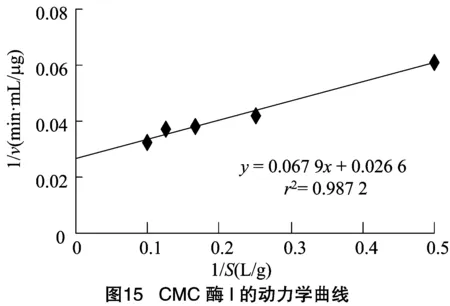
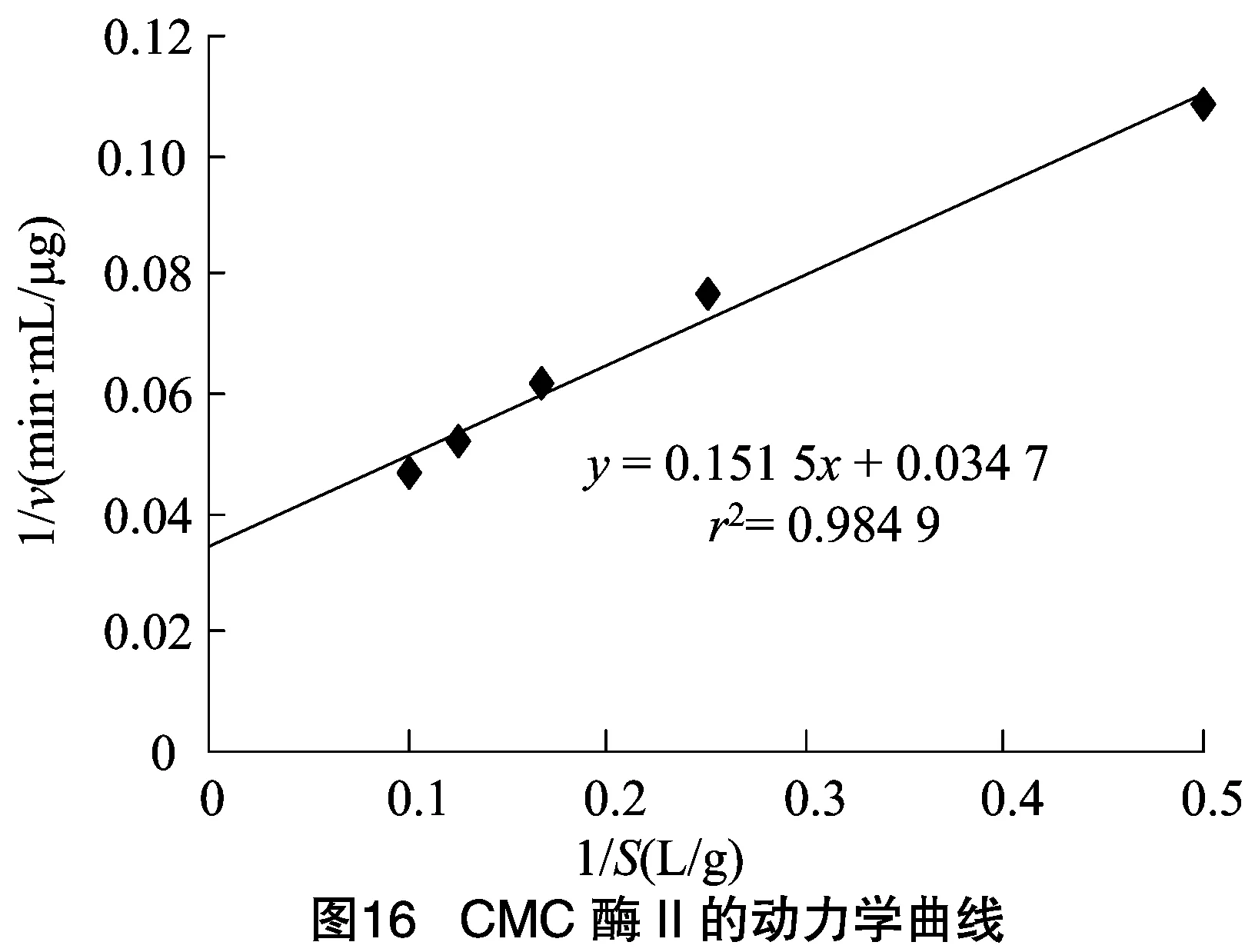
2.2.3 CMC酶的反應動力學常數和的測定 由圖15、圖16可知,求得CMC酶Ⅰ的米氏常數為2.55 g/L,為37.59 μg/(min·mL)。CMC酶Ⅱ的米氏常數為4.37 g/L,為 28.82 μg/(min·mL)。來源于不同細菌的內切--葡聚糖苷酶的動力學常數常會有些區別,如Au等從枯草芽胞桿菌中得到的CMC酶為4 g/L,為0.42 mg/(min·mL);Yan等從蠟樣芽孢桿菌中獲得的CMC酶的為2.12 g/L,為 5.37 μg/(min·mL)。
3 結論
經分離純化,獲得2個酶活組分CMC酶Ⅰ和CMC酶Ⅱ,其純化倍數分別為45.94倍和32.27倍,回收率分別為14.66%和8.33%。經電泳檢測,CMC酶Ⅰ和CMC酶Ⅱ分子量分別約為38.99 ku和45.53 ku。經凝膠電泳檢測,獲得2個酶活組分CMC酶Ⅰ和CMC酶Ⅱ均能達電泳級純度,提示利用鹽析沉淀、凝膠層析、疏水層析和弱陽離子交換色譜能夠對菌株DM-4所產內切--葡聚糖苷酶具有良好的分離純化效果。酶學性質顯示,CMC酶Ⅰ最適作用溫度為55~60 ℃,CMC酶Ⅱ為55 ℃。當溫度低于70 ℃時,2種酶均對熱穩定。2種酶作用最適pH值為7.5,在pH值為6.0~8.0范圍內兩者均具有良好穩定性。Ca和Mg對CMC酶Ⅰ和CMC酶Ⅱ有激活作用。CMC酶Ⅰ的米氏常數為2.55 g/L,為37.59 μg/(min·mL)。CMC酶Ⅱ的米氏常數為4.37 g/L,為 28.82 μg/(min·mL)。酶學性質表明,菌株DM-4所產的2種CMC酶組分均有中性偏堿性纖維素酶,這與大多數霉菌來源的纖維素酶有所不同。
本研究在實驗室水平上將細菌菌株DM-4所產CMC酶組分進行了分離純化,研究其酶學性質,獲得良好的分離純化結果,但將其應用于工業化生產,還需要進行分離純化技術的深入研究和開發。

