miR-214-3p通過調節SIRT7表達調控白血病細胞放療敏感性
馬莉莎 王嶸 柴麗霞
(青海省第五人民醫院放療科,青海 西寧 810007)
微小RNA(miRNA)是一種內源性非編碼單鏈RNA分子,廣泛存在于真核生物中,長度19~25 nt。盡管miRNA不編碼蛋白質,但它通過在轉錄后水平與特定靶標mRNA的3'非翻譯區(3'UTR)相互作用來降解或抑制翻譯,并調節靶mRNA的表達,進一步參與腫瘤的發展,包括增殖、侵襲、轉移和放療敏感性〔1~3〕。研究發現,不同腫瘤中miRNA的失衡與腫瘤細胞的放療敏感性密切相關,例如miR-451a〔4〕。miR-214-3p是miRNA家族成員之一,參與乳腺癌〔5〕、肺癌〔6〕、視網膜母細胞瘤〔7〕等的進展。Hsieh等〔8〕報道,miR-214-3p誘導小兒顱內非生殖性惡性生殖細胞腫瘤的順鉑耐藥性的表達。He等〔9〕發現,miR-214-3p在急性淋巴細胞白血病細胞中低表達,然而其在白血病中的生物學功能和意義仍有待揭示。沉默信息調節因子(SIRT)7是Sir2組蛋白脫乙酰酶家族的成員,在許多生理過程中起作用,包括細胞代謝、衰老和凋亡〔10〕。急性髓細胞白血病細胞暴露于氯法拉濱、氟達拉濱和白消安藥物組合或克拉屈濱、氟達拉濱和白消安藥物組合可導致60%~80%的細胞增殖抑制,SIRT7等蛋白水平的降低,細胞凋亡激活和應激反應信號通路、蛋白激酶B(AKT)通路的下調〔11〕。miR-125a-5p可以靶向調控SIRT7并進一步上調肺癌細胞的凋亡,從而增加其對輻射的敏感性,SIRT7過表達降低了輻射誘導的細胞凋亡〔12〕。但miR-214-3p的異常表達是否與白血病放療敏感性有關,以及miR-214-3p是否通過靶向SIRT7影響白血病細胞的放療敏感性,目前尚不清楚。因此,本研究考察miR-214-3p對SIRT7的靶向調控及對白血病細胞放療敏感性的影響,為更好地了解抗輻射機制提供了一個新的視角。
1 材料與方法
1.1細胞與主要試劑 人骨髓基質細胞系HS-5,白血病細胞系K562、HL-60、OCI-AML3(美國典型培養物保藏中心),RPMI1640培養基(美國Gibco),Lipofectamine 2000試劑(美國Invitrogen),SIRT7抗體、細胞周期蛋白(Cyclin)D1抗體、γ-H2AX抗體、磷酸化(p)-磷脂酰肌醇-3激酶(PI3K)抗體、p-AKT抗體、β-肌動蛋白(β-actin)抗體和辣根過氧化物酶(HRP)標記的二抗(英國Abcam),噻唑藍(MTT)、二甲基亞砜(DMSO,美國Sigma)。
1.2細胞培養與轉染 細胞HS-5、K562、HL-60、OCI-AML3在含有10%胎牛血清和100 U/ml青霉素-鏈霉素的RPMI1640培養基中,在37℃、5% CO2、飽和濕潤條件下培養。細胞轉染時,選取對數生長期的K562細胞,以1×105/孔接種在6孔板中,根據Lipofectamine 2000試劑制造商的說明,將miR-214-3p及其陰性對照miR-NC,si-SIRT7及其陰性對照si-NC,anti-miR-214-3p及其陰性對照anti-miR-NC,pcDNA-SIRT7及其陰性對照pcDNA-NC轉染到K562細胞中,轉染后48 h進行后續實驗。
1.3實時定量PCR(qPCR)檢測miR-214-3p和SIRT7 mRNA水平 收集細胞HS-5、K562、HL-60、OCI-AML3,使用TRIzol試劑提取總RNA。分別使用逆轉錄試劑盒和SYBR Green試劑盒進行逆轉錄和qPCR。U6或GAPDH用作內源性對照,通過2-ΔΔCt標準化和估計miR-214-3p和SIRT7 mRNA的相對表達。引物序列如下:miR-214-3p正義鏈5'-GCATCCTGCCTCCACATGCAT-3',反義鏈5'-GCGCTGAGGAATAATAGAGTATGTAT-3';U6正義鏈5'-TGACTTCCAAGTACCATCGCCA-3',反義鏈5'-TTGTAGAGGTAGGTGTGCAGCAT-3';SIRT7正義鏈5'-CAGGGAGTACGTGCGGGTGT-3',反義鏈5'-TCGGTCGCCGCTTCCCAGTT-3';GAPDH正義鏈5'-AAGTGAAGCAGGAGGGTGGAA-3',反義鏈5'-CAGCCTCACCCCATTTGATG-3'。
1.4Western印跡檢測SIRT7、CyclinD1、γ-H2AX、p-PI3K和p-AKT蛋白的表達 收集細胞HS-5、K562、HL-60、OCI-AML3,檢測SIRT7蛋白表達。收集不同處理的細胞K562,檢測SIRT7、CyclinD1、γ-H2AX、p-PI3K和p-AKT蛋白的表達。細胞在RIPA1640裂解緩沖液中提取總蛋白,通過雙辛可寧酸測定法估算蛋白濃度。將50 μg蛋白通過10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分離。將分離的蛋白質轉移到聚偏二氟乙烯膜上,將膜用5%脫脂牛奶封閉印跡。之后,將膜與SIRT7、CyclinD1、γ-H2AX、p-PI3K、p-AKT和參照β-actin一抗(1∶1 000稀釋)進行反應,后加入辣根過氧化物酶(HRP)標記的二抗(1∶5 000稀釋),然后進行化學發光反應。使用ImageJ程序進行條帶分析。
1.5MTT檢測白血病細胞K562增殖 收集細胞K562,以1×105/孔接種于96孔板中。經不同的處理后,加入MTT至終濃度為0.5 mg/ml,并將細胞在37℃下孵育4 h。加入150 μl二甲基亞砜(DMSO)搖床震蕩10 min,用酶標儀在490 nm下讀取光密度,計算細胞存活率。
1.6細胞克隆實驗和單機多靶模型檢測白血病細胞K562的放射敏感性 收集轉染后的細胞K562,使用5個照射劑量點(0、2、4、6、8 Gy)的X射線,以5 Gy/min的劑量率照射細胞,細胞與輻射源之間的距離為100 cm。當細胞培養板中出現明顯的細胞克隆時,甲醇和結晶紫分別固定、染色30 min。于顯微鏡下記錄大于50的細胞克隆數,其中,克隆形成率=克隆數/接種細胞數×100%,存活分數(SF)=照射細胞的克隆形成率/對照細胞的克隆形成率×100%。單機多靶模型通過GraphPad Prism 5軟件進行,擬合細胞K562的存活曲線,計算放射生物學參數平均致死量(D0)、準閉劑量(Dq)、外推值(N),得出增敏比(SER)。
1.7生物信息軟件預測和雙熒光素酶活性檢測miR-214-3p與SIRT7的靶向關系 用TargetScan預測miR-214-3p和SIRT7的靶向結合,雙熒光素酶活性檢測進一步證實,即構建含有miR-214-3p結合位點的SIRT7-3'UTR野生型(WT)及突變型(MUT)報告基因載體,在K562細胞中轉染miR-214-3p或miR-NC和SIRT7-WT或SIRT7-MUT報告基因載體,轉染后48 h,根據制造商的說明,使用雙熒光素酶報告基因檢測系統分析細胞的熒光素酶活性。
1.8統計學分析 采用SPSS22.0軟件進行t檢驗、單因素方差分析、SNK-q檢驗。
2 結 果
2.1白血病細胞系中miR-214-3p和SIRT7的表達水平 表1和圖1結果顯示,與人骨髓基質細胞HS-5比較,白血病細胞K562、HL-60、OCI-AML3中miR-214-3p表達量明顯減少,SIRT7 mRNA和SIRT7蛋白表達量顯著增加(P<0.05),其中,以K562細胞的差異最為顯著,因此,后續研究選取白血病細胞K562為對象。
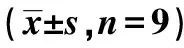
表1 白血病細胞系中miR-214-3p和 SIRT7表達水平
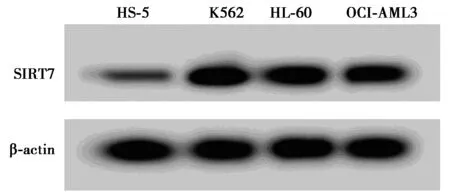
圖1 Western印跡檢測白血病細胞系中SIRT7蛋白的表達
2.2高表達miR-214-3p對白血病細胞K562增殖和放射敏感性的影響 表2、表3、表4和圖2結果顯示,與miR-NC組比較,miR-214-3p組明顯增加白血病細胞K562中miR-214-3p的表達量,顯著降低CyclinD1蛋白水平,并明顯提高γ-H2AX蛋白表達量,減少細胞存活率及顯著降低白血病細胞K562 2、4、6、8 Gy時的存活分數(P<0.05),細胞SER為1.348。
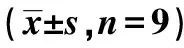
表2 高表達miR-214-3p對白血病細胞 K562增殖的影響
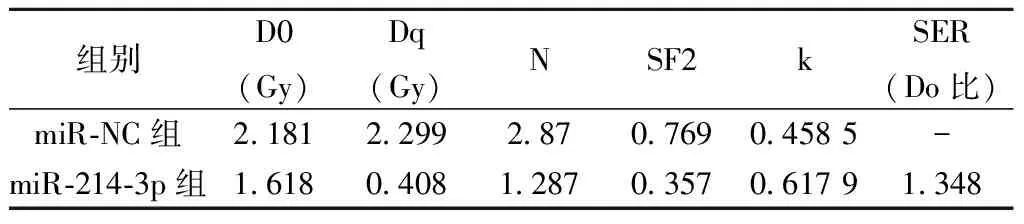
表3 高表達miR-214-3p對白血病細胞 K562放射敏感性的影響
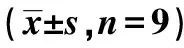
表4 高表達miR-214-3p對白血病細胞K562存活分數的影響
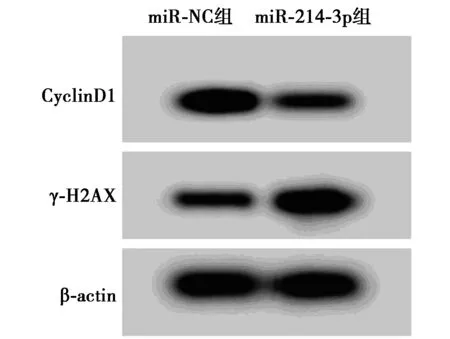
圖2 Western印跡檢測白血病細胞K562中 CyclinD1、γ-H2AX蛋白的表達
2.3SIRT7低表達對白血病細胞K562增殖和放射敏感性的影響 圖3、表5、表6和表7結果顯示,與si-NC組比較,si-SIRT7組明顯降低白血病細胞K562內SIRT7、CyclinD1的蛋白水平,顯著提高γ-H2AX蛋白表達量,明顯減少細胞存活率,并且顯著降低白血病細胞K562的存活分數(P<0.05),細胞SER為1.422。
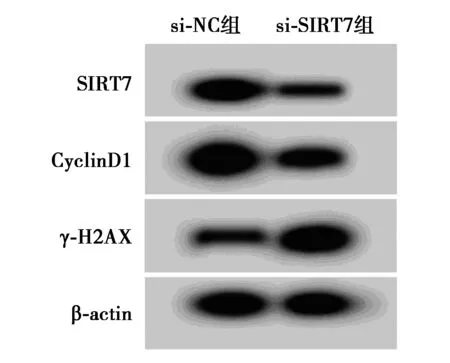
圖3 SIRT7低表達對白血病細胞K562增殖
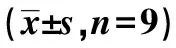
表5 SIRT7低表達對白血病細胞K562增殖的影響

表6 SIRT7低表達對白血病細胞K562放射敏感性的影響
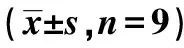
表7 SIRT7低表達對白血病細胞K562存活分數的影響
2.4miR-214-3p靶向調控SIRT7的表達 圖4A的TargetScan軟件預測結果發現,miR-214-3p和SIRT7的3'UTR具有靶向結合位點。圖4B和表8、表9結果顯示,與miR-NC和SIRT7-WT報告質粒共轉染比較,miR-214-3p和SIRT7-WT報告質粒共轉染明顯降低白血病K562細胞的熒光素酶活性(P<0.05),而miR-NC或miR-214-3p和SIRT7-MUT報告質粒共轉染對K562細胞的熒光素酶活性無顯著影響(P>0.05);K562細胞中轉染miR-214-3p較轉染miR-NC明顯減少SIRT7蛋白表達量(0.37±0.03 vs 0.92±0.09,P<0.05),轉染anti-miR-214-3p較轉染anti-miR-NC顯著提高SIRT7蛋白水平(1.28±0.12 vs 0.42±0.04,P<0.05)。
2.5高表達SIRT7可以逆轉miR-214-3p對白血病細胞K562增殖和放射敏感性的影響 表9、表10、表11和圖5結果表明,與miR-214-3p和pcDNA-NC共轉染比較,miR-214-3p和pcDNA-SIRT7共轉染明顯增加白血病細胞K562的SIRT7和CyclinD1蛋白表達量,顯著減少γ-H2AX蛋白表達量,明顯提高細胞存活率和細胞的存活分數(P<0.05),SER為0.683。
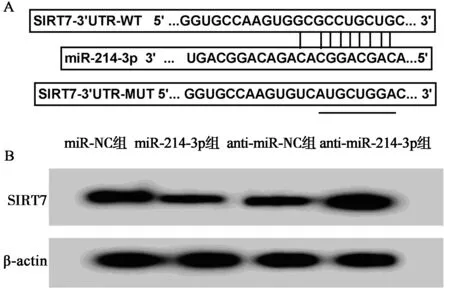
A:生物信息軟件預測miR-214-3p與SIRT7靶向關系B:Western Blot檢測白血病細胞K562中SIRT7蛋白表達量圖4 miR-214-3p靶向SIRT7,調控SIRT7表達
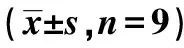
表8 miR-NC或miR-214-3p與報告質粒共轉染白血病細胞 K562后的雙熒光素酶活性檢測
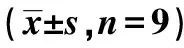
表9 高表達SIRT7可以逆轉miR-214-3p對白血病細胞K562增殖和放射敏感性的影響

表10 各組白血病細胞K562轉染處理聯合X射線照射對K562細胞作用的單擊多靶模型參數值
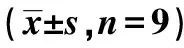
表11 高表達SIRT7可以逆轉miR-214-3p對白血病細胞K562存活分數的影響
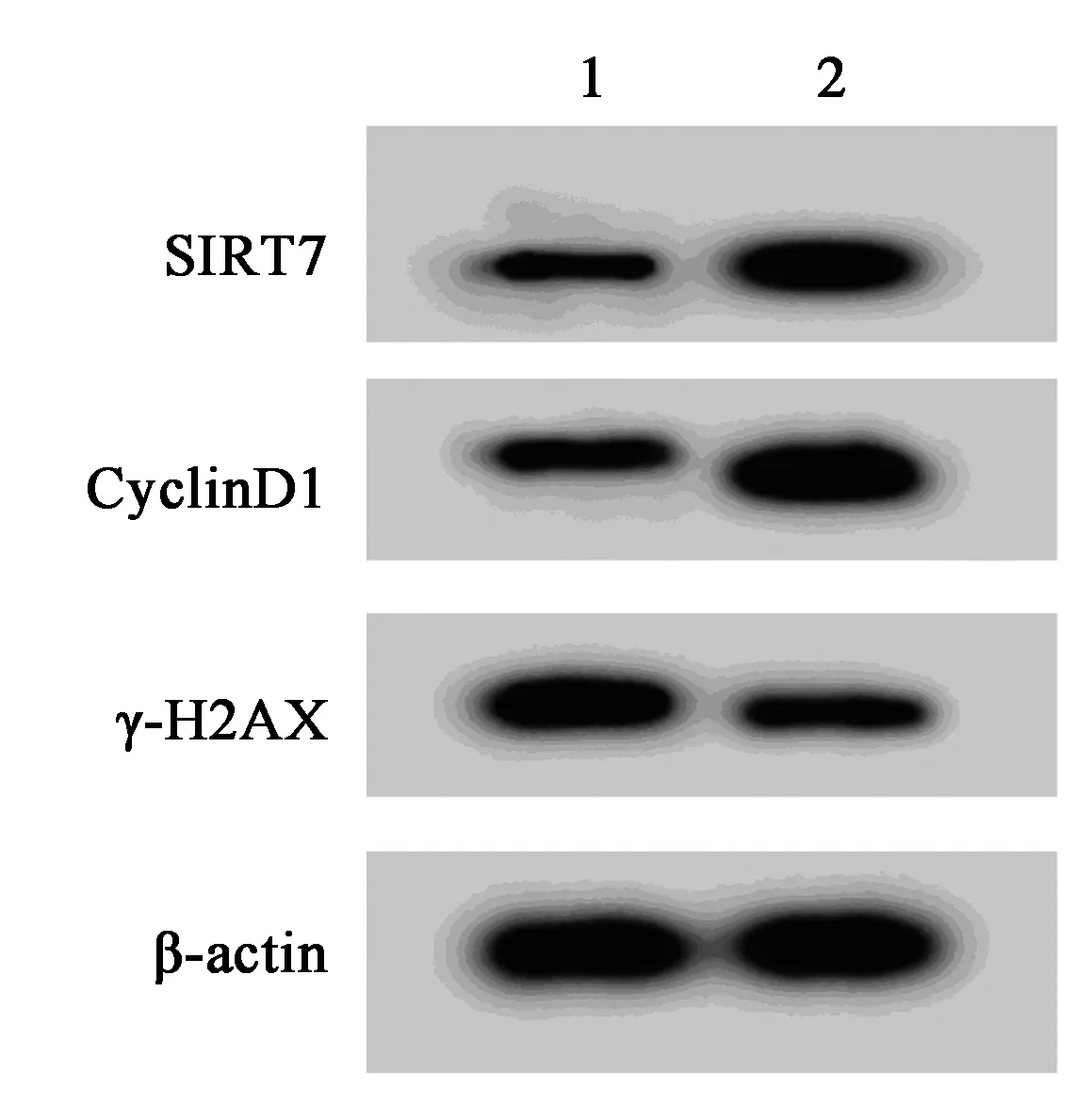
1,2:miR-214-3p+pcDNA-NC組,miR-214-3p+pcDNA-SIRT7組圖5 高表達SIRT7可逆轉 miR-214-3p對白血病細胞K562增殖
2.6白血病細胞K562中PI3K/AKT信號通路相關蛋白的表達 表12和圖6檢測結果顯示,與miR-NC組比較,高表達miR-214-3p明顯減少K562細胞的p-PI3K和p-AKT蛋白表達量(P<0.05);與miR-214-3p和pcDNA-NC共轉染比較,miR-214-3p和pcDNA-SIRT7共轉染顯著提高K562細胞的p-PI3K和p-AKT蛋白水平(P<0.05)。
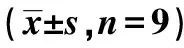
表12 NF-κB信號通路相關蛋白的表達

1~4:miR-NC組,miR-214-3p組,miR-214-3p+pcDNA-NC組,miR-214-3p+pcDNA-SIRT7組圖6 Western印跡檢測p-PI3K和p-AKT蛋白的表達
3 討 論
白血病是常見的惡性血液病之一,作為一種惡性腫瘤,聯合化療、靶向治療和造血干細胞移植是白血病常用的臨床治療方法,其中,聯合化療是主要的治療方法。隨著放射治療技術的發展,化學療法與放射療法相結合已成為在造血干細胞移植之前進行預處理的重要手段〔13〕。簡單的大劑量化療無法起到清髓作用,并且,由于化療藥物的局限性,很難通過化學療法清除腫瘤細胞,使腫瘤細胞復發〔14〕,而放射治療有助于解決這一難題〔15〕。因此,了解對放射療法的抗性機制和提高治療功效對于發掘針對白血病的新療法非常重要。一些研究人員已經證明,腫瘤細胞中miRNA的表達失調可通過調節靶mRNA的表達來影響其對放療的敏感性〔2〕。因此,miRNA可能成為克服腫瘤細胞放療抵抗的先進途徑之一。本研究揭示了白血病細胞系K562、HL-60、OCI-AML3中miR-214-3p表達水平的變化及miR-214-3p對K562細胞X射線照射的敏感性。miR-214-3p通過調節SIRT7并影響PI3K/AKT信號傳導途徑提高了白血病K562細胞的放療敏感性。本研究證實了miR-214-3p參與白血病細胞放療敏感性的機制,為克服白血病細胞的輻射抵抗提供了一條新途徑。
miRNA通過多種機制在癌癥中發揮著重要作用,引起了越來越多的關注。許多miRNA,作為抑癌基因或原癌基因參與腫瘤的發生發展過程〔16〕,包括白血病〔17,18〕。資料顯示,miR-214-3p在三陰乳腺癌中低表達,通過靶向ST6GAL1抑制癌細胞的存活、遷移、侵襲和上皮間充質轉化(EMT)〔19〕。miR-214-3p在子宮內膜癌組織和細胞中下調,miR-214-3p的過表達抑制了癌細胞的遷移和EMT,而其敲低則促進了子宮內膜癌的進展〔20〕。在結直腸癌中miR-214-3p低表達,高表達抑制細胞的增殖、遷移和侵襲,miR-214-3p可能是腫瘤抑制因子。He等〔9〕報告指出,急性淋巴細胞白血病細胞中的miR-214-3p表達下調,然而其在白血病放療敏感性中的作用仍不清楚。本實驗同樣檢測到miR-214-3p在白血病細胞K562、HL-60、OCI-AML3中的表達量明顯減少,提示在白血病中,miR-214-3p可能具有抑癌活性。本研究功能試驗結果說明miR-214-3p可以抑制白血病細胞的增殖,從而增強其放療敏感性。總體而言,這些結果表明miR-214-3p的高表達是改善白血病輻射抗性的重要因素之一,并且可能成為調節腫瘤細胞放療敏感性的潛在靶標。
本實驗結果還表明,SIRT7是該過程的重要組成部分,其表達對于miR-214-3p誘導的白血病細胞放療敏感性至關重要。根據報道,SIRT7在人腦膠質瘤組織中表達上調,其高表達與膠質瘤惡性程度呈正相關〔10〕。SIRT7的敲除通過抑制前列腺癌中的雄激素受體信號傳導,來抑制細胞的增殖,還可增加前列腺癌細胞對輻射的敏感性〔21〕。本實驗中,白血病細胞K562、HL-60、OCI-AML3中SIRT7 mRNA和SIRT7蛋白表達顯著上調,SIRT7低表達明顯抑制白血病K562細胞的增殖和CyclinD1蛋白表達,促進磷酸化組蛋白H2AX(γ-H2AX)表達,并明顯降低不同劑量X射線照射后K562細胞的存活分數,提示SIRT7低表達通過抑制白血病細胞的增殖,來提高放療敏感性,與前人研究〔22〕相符。基于這些發現,SIRT7抑制似乎是白血病放射治療的潛在增強劑。本研究結果證實,通過靶向調節SIRT7的表達水平,miR-214-3p可以改變白血病細胞對放療的敏感性。
PI3K/AKT信號通路參與細胞生長,增殖和分化,并在腫瘤的發生、發展、治療和結果中起重要作用,其異常激活是腫瘤抗輻射性的重要機制〔23〕。PI3K是一種在細胞內具有催化活性的信號蛋白,可由細胞外細胞因子、藥物、應激和其他因素激活。激活后的PI3K可以促進AKT的激活,調節多種細胞增殖相關的基因和其他基因的表達〔24〕。高表達miR-214-3p明顯降低K562細胞的p-PI3K和p-AKT蛋白表達,而這種抑制作用被高表達SIRT7所逆轉。表明miR-214-3p通過靶向SIRT7,并影響PI3K/AKT信號通路的活性,來介導白血病細胞的放療敏感性。
總之,miR-214-3p通過抑制白血病細胞的增殖能力,增強其放療敏感性,機制與靶向SIRT7調節PI3K/AKT信號通路有關。這些結果可能有助于對白血病或其他顯示miR-214-3p或SIRT7表達異常的癌癥患者實施個性化治療,從而提高放射治療的效率。并且,這些結果可能會提供基于miR-214-3p/SIRT7/PI3K/AKT信號傳導途徑的潛在治療靶點,以克服腫瘤的輻射抗性。

