床旁超聲胃內容物監測在結直腸癌患者術后早期腸內營養支持的臨床應用*
文/李龍
早期腸內營養支持過程中,胃殘余量過多是導致胃腸道癥狀發生的原因之一,也是結直腸癌術后早期腸內營養支持中斷的原因之一。目前,臨床上尚無胃腔殘留量(GRV)評估及檢測的統一標準。乙酰氨基酚吸收率、電阻抗斷層掃描、放射性食物標記、聚乙二醇稀釋、胃液的抽吸等方法均為有創性檢查。基于快速康復外科理念,結直腸癌術后未常規留置胃管也增加了GRV 的評估及檢測難度,且影像學檢查過程也是腸內營養中斷的原因之一。因此,上述方式并不適用于床邊及圍術期檢查。床邊超聲因其無創、方便、操作簡單、患者易接受等優勢,逐步用于臨床。本研究主要探討床旁超聲胃內容物監測技術在結直腸癌患者術后早期腸內營養支持中的應用及效果,現報告如下。
1 資料與方法
1.1 一般資料
選取90 例2020 年5 月至2021 年10 月期間在本院診治的結直腸癌患者作為對象。通過隨機數字表法將入選對象進行分組,共分為兩組,其中對照組45 例,為男30例、女15 例;年齡為48 ~74 歲,平均(61.34±2.53)歲;急性生理和慢性健康狀況Ⅱ評分(APACHE Ⅱ)為18.02 ~25.53 分,平均(22.43±3.26)分;觀察組45 例,患者性別:男28 例、女17 例;年齡為47 ~74 歲,平均(62.43±3.65)歲;APACHE Ⅱ為18.00 ~25.68 分,平均(22.38±4.38)分。組間患者年齡、APACHE Ⅱ評分等基礎資料相對比,差異無統計學意義(P >0.05)。
1.2 納入及排除標準
納入標準:經病理證實為腺癌;年齡≤75 歲;術前分期為結腸癌cT1-4N1-2M0、直腸癌cT1-3N0M0,無須急診處理的癥狀;入院檢查未見明顯手術禁忌證;患者及家屬選擇手術治療,并成功行腹腔鏡下結直腸癌根治性手術治療。排除標準:不符合手術指征;新輔助放化療結直腸癌;近期有使用免疫治療;合并嚴重內科疾病(自身免疫系統疾病、嚴重心肺、肝腎功能不全等);伴有精神性疾病。
1.3 方法
對照組:給予該組患者常規早期腸內營養支持干預。術后4 ~12h 開始口嚼口香糖,飲少量溫開水,術后12h后給予百普力腸內營養混懸液[紐迪希亞制藥(無錫)有限公司,國藥準字H20010285,規格為500mL]:125ml/次,隔6h 給予1 次,溫度為37~38℃,逐漸加量[術后第一天目標量為500ml。術后第二天目標量為750ml,術后第三天為1000ml。最后根據患者體重及耐受力合理用量,熱量約為25kcal/(kg·d),蛋白質1.0~1.5g/(kg·d),熱氮比(125~150kcal):1g],持續至術后第5 天。
觀察組:給予該組患者床旁超聲胃內容物監測指導下早期腸內營養支持干預。術后4~12 小時開始口嚼口香糖,飲少量溫開水,術后12h 后開始進行床旁超聲胃內容物監測,檢測胃腔殘留量(GRV)。根據GRV 的量給予適當百普力的量,4 小時監測一次[術后第一天目標量500ml、術后第二天目標量750ml(術后第三天1000ml),最后根據患者體重及耐受力合理用量,熱量約為25kcal/(kg·d),蛋白質1.0~1.5g/(kg·d),熱氮比(125~150kcal):1g)],直到術后第5 天。
三組腸內營養提供能量等不足部分,均腸外靜脈輸液補充。
1.4 觀察指標
(1)觀察患者術后首次排氣、排便及住院平均時間。(2)發癥評估:觀察患者腸內喂養相關并發癥(腹脹、腹瀉、嘔吐等)的發生情況。(3)營養狀況評估:術后第1d、第5d 均通過全自動生化分析儀檢測相關營養指標水平,測定指標具體為血清總蛋白(TP)、白蛋白(ALB)、轉鐵蛋白(TF)、前白蛋白(PA)。(4)免疫功能評估:術后第1d、第5d 抽取患者2mL 外周靜脈血行離心,取上清液,通過美國EPICS-Elite 流式細胞儀進行細胞免疫指標水平檢測,具體測定CD3+、CD4+、CD8+。
1.5 統計學方法
2 結果
2.1 兩組術后康復情況比較
與對照組比較,觀察組患者術后平均首次排氣、排便時間均更短,平均住院天數更少,差異有統計學意義(P <0.05),見表1。
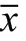
表1 兩組患者訴后康復指標對比 (±s)
2.2 兩組并發癥比較
與對照組比較,觀察組患者腸內營養相關并發癥發生率總發生率明顯更低,差異有統計學意義(P <0.05),見表2。

表2 兩組患者并發癥情況對比 [例(%)]
2.3 兩組營養狀況比較
兩組患者術后1d 營養指標測定結果比較,差異無統計學意義(P >0.05)。干預后,觀察組患者術后第5d 的TP、ALB、TF、PA 均顯著高于對照組,差異有統計學意義(P <0.05),見表3。
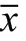
表3 兩組患者相關營養指標測定結果對比 (±s)
2.4 兩組免疫功能情況比較
術后1d,前兩組患者細胞免疫功能相關指標測定結果比較無明顯差異(P >0.05)。術后第5d,觀察組患者CD3+、CD4+水平相比對照組均更高,CD8+水平更低,差異有統計學意義(P <0.05),見表4。
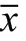
表4 兩組CD3+、CD4+、CD8+水平對比 (±s)
3 討論
結直腸癌是嚴重威脅人類健康的多發惡性腫瘤之一,世界范圍內其發生率居常見惡性腫瘤第三位。現階段,根治性切除腫瘤病灶是臨床上用于結直腸癌患者治療的唯一治愈手段,但多數結直腸癌患者就診時已出現嚴重便血、大便次數增多等消化道癥狀,并伴有不同程度營養不良。同時受術前準備、術中創傷、術后傳統治療等各種因素的影響,患者營養不良狀況加重,機體免疫功能降低,術后機體康復速度和康復效果均受到嚴重影響。術后早期采取積極措施及時糾正機體營養不良狀況,增強機體免疫力是結直腸癌患者術后康復效果提高的重要環節。
術后早期腸內營養支持是促進病人加速康復的重點措施。俞夢英等的研究表明,早期腸內營養在提供營養支持的同時,不僅不會增加腹內壓,并可能會通過增進腸蠕動阻止腹內高壓的發展,有利于改善疾病的嚴重程度和臨床療效。百普力是臨床常用的短肽型腸內營養混懸液,主要成分為水、麥芽糖糊精、乳清蛋白水解物、維生素、礦物質和微量元素等人體必需的營養要素。患者術后腸內營養支持中使用百普力,不會引發腸脹氣、小腸蠕動增強引起腹痛等現象,且可使腸黏膜細胞結構與功能的完整性獲得有效維持,促進消化道固有菌群能夠正常生長,有利于機體免疫功能恢復。
給予患者早期腸內營養支持干預時,胃殘余量過多可導致患者出現一系列胃腸道癥狀,甚至可導致營養支持中斷。因此,在給予手術治療直腸癌患者早期腸內營養支持過程中必須形成有效的GRV 監測。放射性食物標記、電阻抗斷層掃描、胃液抽吸等均是具有創傷性的檢查手段,且結直腸癌患者術后未行胃管留置,因此營養支持期間GRV 評估及監測的難度相對較大。超聲檢測法在20 世紀70 年代被用于胃功能監測,20 世紀80 年代被用于胃排空評估,并表現出良好效果。經多次改良后,超聲檢測法逐漸被應用于胃內容物量評估。超聲胃內容物監測主要是利用超聲在胃及內容物傳播時產生的放射或透射現象來構成不同的超聲影響來分辨胃的解剖及內容物的性質,同時獲取不同截面的數據,然后經過相應的換算公式,進一步計算胃內容物的量。床旁超聲胃內容物監測具有無創傷性、重復性好的特點。左一丁等研究中以超聲監測GRV 作為指導給予患者腸內營養支持后,腸內營養中斷率明顯降低,患者目標營養量達到速度明顯加快。本研究中,觀察組患者以床旁超聲胃內容物監測為指導,術后行早期腸內營養支持后,患者康復速度明顯快于對照組,患者腸內營養常見并發癥明顯更少,術后機體營養狀況改善效果及免疫功能提高效果均更理想。該結果表明,床旁超聲監測GRV 指導下術后給予結直腸癌患者早期腸內營養支持干預,能夠促進患者更快康復,降低腸內營養發生風險,可更好改善患者術后機體應用狀況,促進其機體免疫功能明顯增強。床旁超聲檢查能夠實現對患者GRV 狀況進行及時、準確評估,便于醫護人員能夠根據實際情況及時對患者喂養速度進行合理調整。當患者胃動力較好,且GRV 未超過200 mL 時,喂養速度可適當調高,進而提高喂養整體效率,保證目標營養量更快達到。床旁超聲GRV 監測不會對患者生理狀態造成明顯影響,能夠保證患者胃排空狀況維持真實性,醫護人員以監測結果為根據及時調整治療方案,可提高方案的合理性和針對性,減少喂養不耐受,減少并發癥,進而保證患者術后康復加快。但目前通過超聲檢查進行GRV 監測也存在一定局限,如患者有腹腔脹氣、積氣時,超聲圖像顯示清晰度會受到影響,進而影響測量結果。同時,醫護人員圖像識別能力、操作技術也會對GRV 監測結果產生一定影響。目前,臨床上尚未明確超聲檢查用于胃內容物定性檢測的特異性、敏感性。因此,該種GRV 監測技術實際應用效果及價值仍有待進一步深入研究。
綜上所述,在床旁超聲GRV 監測指導下給予結直腸癌患者手術后早期腸內營養支持干預,能夠明顯加快患者康復速度,減少腸內營養并發癥,在機體營養狀況改善及免疫功能增強方面均能發揮明顯作用。

