不同濃度亞硝酸鹽亞急性脅迫對凡納濱對蝦生長與免疫功能的影響*
方 成 黎蘭詩 梁震宇 成良峰 戴習林
不同濃度亞硝酸鹽亞急性脅迫對凡納濱對蝦生長與免疫功能的影響*
方 成 黎蘭詩 梁震宇 成良峰 戴習林①
(上海海洋大學 水產科學國家級試驗教學示范中心 農業農村部淡水水產種質資源重點實驗室 水產動物遺傳育種中心上海市協同創新中心 上海 201306)
為闡明鹽度為5條件下不同濃度亞硝酸鹽亞急性脅迫對凡納濱對蝦()生長與免疫功能的影響,本研究設置5個亞硝酸鹽濃度組(0.50、0.90、1.70、3.20和6.00 mg/L)和對照組(0.05 mg/L),檢測分析了亞硝酸鹽脅迫40 d后凡納濱對蝦免疫相關酶活性、丙二醛(MDA)含量以及免疫和生長相關基因表達的變化。結果顯示,凡納濱對蝦死亡率隨亞硝酸鹽濃度的增加而升高,6.00 mg/L濃度組體質量增長率(WGR)和體長增長率(LGR)均顯著低于對照組(<0.05)。部分濃度組亞硝酸鹽對凡納濱對蝦肝胰腺和血清中的免疫相關酶活性具有一定的誘導作用。其中,當亞硝酸鹽濃度高于0.50 mg/L時,肝胰腺超氧化物歧化酶(SOD)活性顯著高于對照組(<0.05);0.50、0.90和1.70 mg/L濃度組的過氧化氫酶(CAT)活性顯著高于對照組(<0.05);血清中CAT和SOD活性隨亞硝酸鹽濃度的增加均呈先降低后升高再降低的趨勢;0.90 mg/L濃度組的肝胰腺和血清中酸性磷酸酶(ACP)和堿性磷酸酶(AKP)活性均顯著高于對照組(<0.05)。MDA含量變化無明顯規律。此外,血清中谷丙轉氨酶(GPT)活性顯著升高(<0.05)。實時熒光定量PCR結果顯示,除0.50 mg/L濃度組外,其他濃度組的和基因表達量顯著升高(<0.05);各濃度組的和基因表達量顯著低于對照組(<0.05)。經亞硝酸鹽脅迫40 d后,各濃度組凡納濱對蝦的生長和免疫功能均受到明顯的阻遏作用。在鹽度為5條件下,為確保凡納濱對蝦的健康養殖,亞硝酸鹽濃度應控制在0.50 mg/L以內。
凡納濱對蝦;亞硝酸鹽;酶活性;環境脅迫
凡納濱對蝦()是我國非常重要的水產經濟動物,自引入我國以來,養殖規模不斷擴大,創造了巨大的經濟價值。但養殖過程中出現的亞硝酸鹽成為了制約凡納濱對蝦產業發展的重要因素。亞硝酸鹽是養殖水體中常見的化學物質。氨氮在亞硝化作用下變為亞硝酸鹽,之后通過硝化作用轉變為硝酸鹽。但硝化作用與亞硝化作用一般無法達到平衡,因此,亞硝酸鹽容易在水體中積蓄。亞硝酸鹽可導致蝦類生長和發育異常,病菌易感性增加(Tseng, 2004;臧維玲等, 1996; Mallasen,2006),并會造成一定程度的組織損傷。一定濃度的亞硝酸鹽可使血淋巴與氧結合能力降低(Chen,1995),最終導致蝦窒息死亡。彭自然等(2004)研究發現,凡納濱對蝦在含有亞硝酸鹽的水體中養殖14 d后,其生長和發育受到了明顯抑制。胡義波等(2005)研究發現,凡納濱對蝦經亞硝酸鹽脅迫后體內血細胞減少,細胞超微結構受到明顯影響。吳中華等(1999)研究發現,亞硝酸鹽慢性脅迫條件下,中國對蝦()各個組織均受到不同程度的影響,其中肝胰腺組織病變較為嚴重。Cheng等(2000)研究發現,斑節對蝦()經亞硝酸鹽脅迫后,肝胰腺和中腸中亞硝酸鹽積累較多。Zhang等(2015)研究發現,在經氨氮和亞硝酸鹽聯合脅迫24 h后,羅氏沼蝦()血淋巴中活性氧升高,抗氧化酶活性受到影響。葛紅星等(2014)研究發現,凡納濱對蝦在不同濃度亞硝酸鹽水體中暴露20 d后,對副溶血弧菌()的易感性提高。總體而言,一定濃度的亞硝酸鹽可對凡納濱對蝦的免疫功能和生長造成較明顯的阻遏作用。近年來,關于亞硝酸鹽的研究主要集中于亞硝酸鹽對蝦類的急性毒性影響,主要研究短期亞硝酸鹽脅迫后蝦體內抗氧化酶活性、氧化損傷以及對病菌易感性的變化,而較少有針對亞硝酸鹽對凡納濱對蝦亞急性毒性的研究。本實驗研究凡納濱對蝦在5個不同亞硝酸鹽濃度的水體中養殖40 d后體內部分免疫相關酶活性、免疫和生長相關基因表達變化情況,以期為亞硝酸鹽亞急性脅迫對凡納濱對蝦的影響提供參考依據。
1 材料與方法
1.1 實驗材料
實驗用蝦取自上海申漕特種水產有限公司,挑選健康、體長為(7.45±0.21) cm、體質量為(4.75±0.51) g的凡納濱對蝦暫養于水泥池中。
1.2 亞硝酸鹽亞急性脅迫實驗
凡納濱對蝦暫養1周后開始實驗。通過預實驗得知,凡納濱對蝦96 h半致死濃度(96h-LC50)約為30 mg/L,取該濃度的20%為最高濃度并按等對數間距設置5個亞硝酸鹽濃度,分別為0.50、0.90、1.70、3.20和6.00 mg/L。每個處理設3組平行,每個平行放30尾蝦。對照組亞硝酸鹽濃度約為0.05 mg/L。實驗在鹵蟲池中進行,水體體積為100 L,每日換水1/2。每日利用分光光度計測得水體中亞硝酸鹽濃度,并使用10 g/L NaNO2溶液控制水體中的亞硝酸鹽濃度。
實驗期間,溫度控制在26℃~27℃,鹽度為5,總氨氮≤0.5 mg/L,非離子氨≤0.02 mg/L,pH控制在7.8±0.2,24 h曝氣。每日投喂3次人工飼料(魚粉23%、酵母粉4%、大豆磷脂4%、豆粕20%、花生粕7.4%等),每日投喂量為蝦體質量的11%~16%。每日記錄蝦的死亡狀況。養殖實驗進行40 d后(取樣前停飼24 h),每個平行取3尾蝦的肝胰腺放入離心管中,存放于–80℃冰箱,用于酶活測定和RNA提取。另外,使用1 mL注射器在第2腹肢基部抽取凡納濱對蝦的血淋巴,并放入離心管中。血淋巴存于4℃冰箱,放置24 h后離心取上清液,放置于–80℃冰箱,用于酶活測定。
1.3 生長指標的測定
通過以下公式計算得到不同濃度感染組的死亡率(MR)、體質量增長率(WGR)和體長增長率(LGR)。
死亡率(MR, %)=T/0×100% (1)
體質量增長率(WGR, %)=(T–0)/0×100% (2)
體長增長率(LGR, %)=(T–0)/0×100% (3)
式中,0為初始數量;T為實驗結束時死亡數量;0和T分別為初始平均體質量和實驗結束時平均體質量;0和T分別為初始平均體長和實驗結束時平均體長。
1.4 抗氧化酶、代謝酶活性和MDA含量的測定
采用超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、堿性磷酸酶(AKP)、酸性磷酸酶(ACP)、丙二醛(MDA)、谷丙轉氨酶(GPT)和谷草轉氨酶(GOT)試劑盒(南京建成生物工程有限公司)測定凡納濱對蝦肝胰腺和血清的生理生化指標。
1.5 總RNA的提取
使用RNA Easy Fast動物組織/細胞總RNA提取試劑盒(DP451)(北京天根生化科技有限公司)提取肝胰腺組織RNA。采用核酸蛋白測定儀測定的RNA樣品的OD260 nm和OD280 nm值,確定其濃度,并計算二者比值以確定RNA的純度。0.8%瓊脂糖凝膠電泳檢測RNA質量。
1.6 反轉錄及引物設計
按照PrimeScript?1st Strand cDNA Synthesis Kit說明書(TaKaRa)將之前所提取的總RNA進行反轉錄,得到的cDNA存放于–20℃冰箱中。根據NCBI數據庫中凡納濱對蝦(DQ005531)、(AY518322)、(AY645906)等基因的保守區域和基因的序列設計特異性引物(表1)。
表1 實驗中所用引物序列

Tab.1 Sequences of the primers in this study
1.7 熒光定量PCR
使用ABI PRISM?7900 Sequence Detection System儀器,根據SYBR?Green Real-time PCR Master Mix試劑盒說明書,對各組實驗樣品的目的基因和基因cDNA進行定量測定。ABI PRISM?7900 Sequence Detection System的具體反應程序設置為:94℃預變性30 s,94℃變性5 s,60℃退火25 s,72℃延伸30 s,共40個循環。最后根據熔解曲線分析PCR產物質量。采用2–??Ct計算法對各組樣品測得的基因數據進行定量分析。
1.8 數據統計與分析
所有數據使用平均值±標準差(Mean±SD)表示。采用SPSS 17.0和Excel 2010分析數據,使用Duncan′s multiple range test檢驗統計差異,<0.05為差異顯著。
2 結果
2.1 不同濃度亞硝酸鹽對凡納濱對蝦死亡率和生長的影響
由表2可知,凡納濱對蝦死亡率隨亞硝酸鹽濃度的增加而升高。各濃度組死亡率均顯著高于對照組(<0.05),6.00 mg/L濃度組死亡率為最高(<0.05)。
凡納濱對蝦體質量增長率和體長增長率總體上隨亞硝酸鹽濃度的增加呈降低的趨勢。6.00 mg/L濃度組體質量增長率和體長增長率為最低,并顯著低于對照組(<0.05),其他濃度組體長增長率和體質量增長率組間無顯著差異(>0.05)。
表2 不同濃度亞硝酸鹽對凡納濱對蝦死亡率和生長的影響
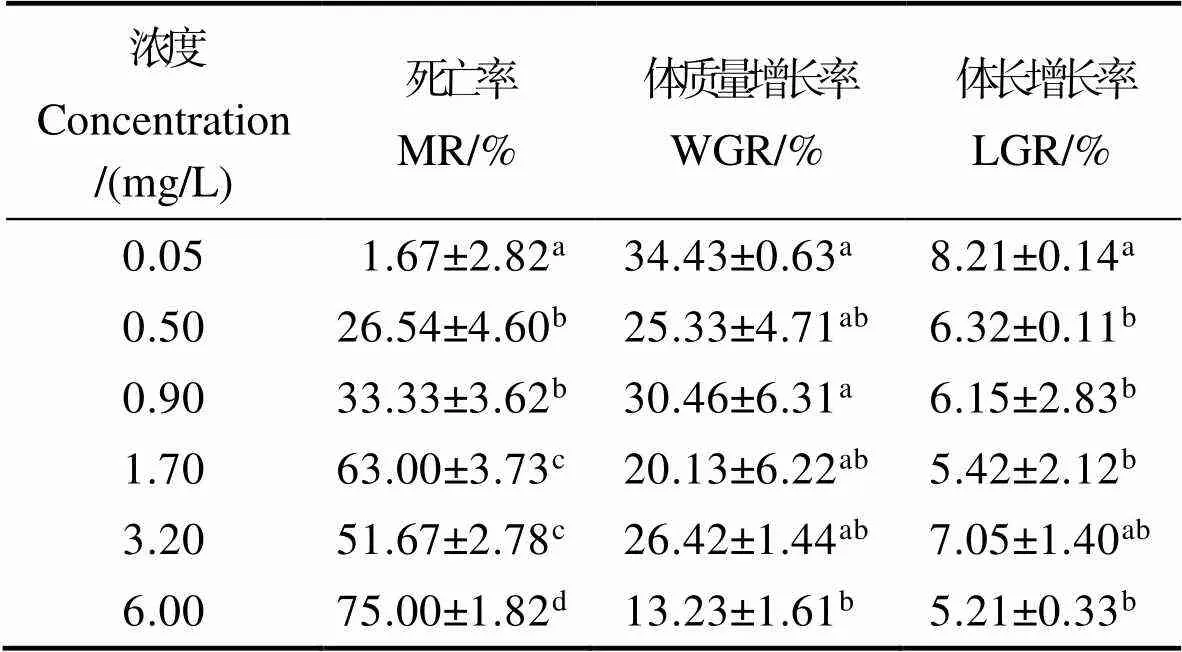
Tab.2 Effect of different concentrations of nitrite on growth performance and mortality rate of L. vannamei
2.2 不同濃度亞硝酸鹽對凡納濱對蝦抗氧化酶活性和MDA含量的影響
除0.50 mg/L濃度組外,其他濃度組血清中SOD和CAT活性均高于對照組,其中,SOD和CAT活性分別在3.20和0.90 mg/L濃度組達到最高并顯著高于對照組(<0.05)(圖1a、圖1b)。除0.50 mg/L濃度組外,其他濃度組肝胰腺SOD活性均高于對照組,0.90 mg/L濃度組SOD活性為最高(<0.05)(圖1c)。如圖1d所示,0.50、0.90和1.70 mg/L濃度組肝胰腺CAT活性顯著高于對照組(<0.05)。3.20和6.00 mg/L濃度組CAT活性顯著低于對照組,且各組間存在顯著差異(<0.05)(圖1d)。
血清中AKP和ACP活性隨亞硝酸鹽濃度的增加總體呈升高的趨勢,而在肝胰腺中則呈波動變化。3.20 mg/L濃度組血清AKP和ACP活性達到最高(<0.05)(圖1e、圖1f)。而肝胰腺中ACP和AKP活性在0.90 mg/L濃度組為最高(<0.05)(圖1g、圖1h)。
MDA含量總體呈波動變化,其中,3.20 mg/L濃度組血清MDA含量顯著高于對照組(<0.05),其他濃度組與對照組無顯著差異(>0.05)(圖1i)。除0.50 mg/L濃度組,其他濃度組肝胰腺MDA含量均高于對照組,其中,0.90、1.70和6.00 mg/L濃度組顯著高于對照組(<0.05) (圖1j)。
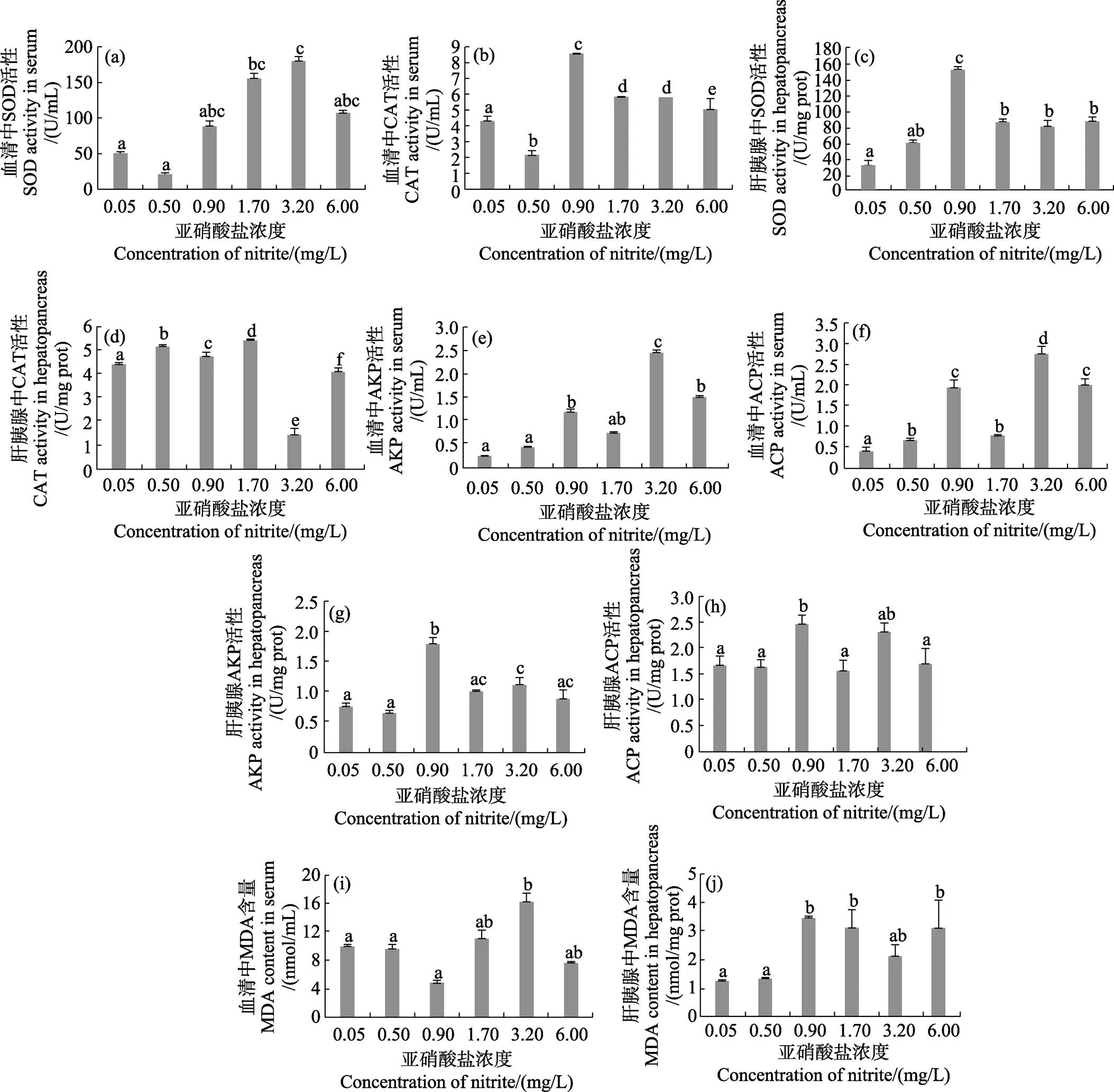
圖1 不同濃度亞硝酸鹽對凡納濱對蝦抗氧化酶活性和MDA含量的影響
不同字母代表存在顯著差異(<0.05),下同。
Different letters indicate significant difference (<0.05). The same as below.
2.3 不同濃度亞硝酸鹽對凡納濱對蝦代謝酶活性的影響
除0.50 mg/L濃度組外,其他濃度組GPT活性均顯著高于對照組(<0.05)。各濃度組GPT活性無顯著差異(0.05)(圖2a)。3.20和6.00 mg/L濃度組GOT活性顯著高于其他濃度組(0.05),其他濃度組間無顯著差異(0.05)(圖2b)。
2.4 不同濃度亞硝酸鹽對凡納濱對蝦肝胰腺中免疫相關基因表達的影響
除0.50 mg/L濃度組外,其他濃度組和基因表達量顯著高于對照組(<0.05)。和基因表達量分別在6.00和3.20 mg/L濃度組達到最高(<0.05)(圖3a、圖3b)。、和基因均隨亞硝酸鹽濃度的增加呈降低的趨勢,各濃度組基因表達量均顯著低于對照組(<0.05)(圖3c~圖3e)。
2.5 不同濃度亞硝酸鹽對凡納濱對蝦肝胰腺中生長相關基因表達的影響
和基因表達量隨亞硝酸鹽濃度的增加總體呈先降低后升高的趨勢。各濃度組的基因表達量均顯著低于對照組(<0.05),且各濃度組無顯著差異(>0.05)。6.00 mg/L濃度組的基因表達量升高,并顯著高于其他濃度組(<0.05)(圖4a、圖4b)。
基因表達量隨亞硝酸鹽濃度的增加呈波動變化,0.50 mg/L濃度組達到最低并顯著低于對照組(<0.05)。0.90和6.00 mg/L濃度組顯著高于對照組(<0.05)。1.70和3.20 mg/L濃度組與對照組無顯著差異(>0.05)(圖4c)。
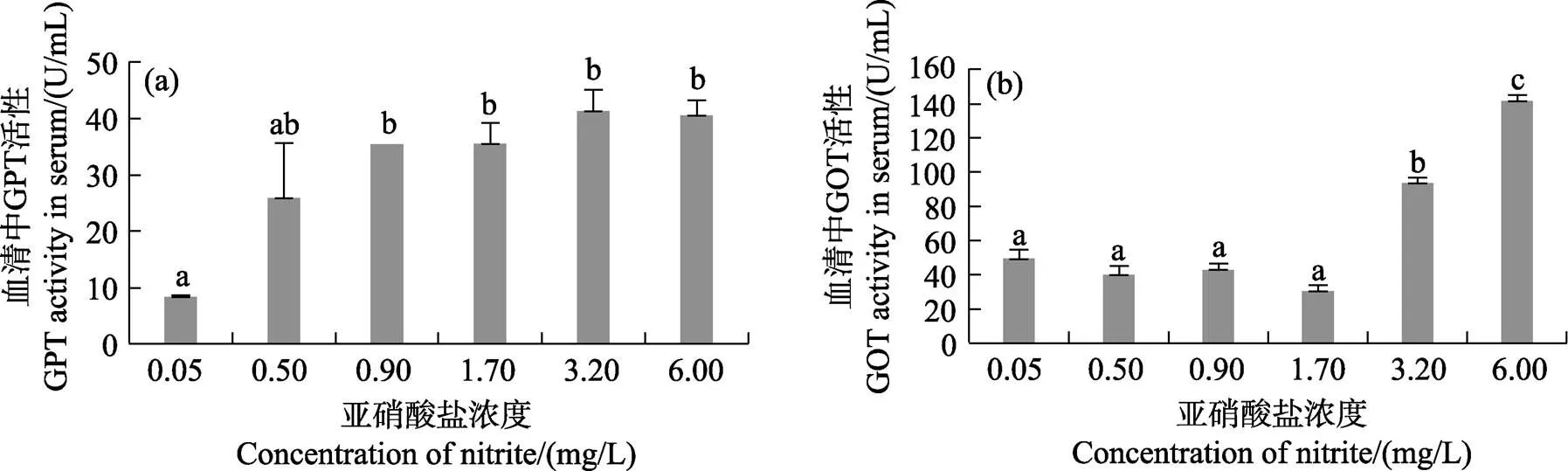
圖2 不同濃度亞硝酸鹽對凡納濱對蝦GOT和GPT酶活性的影響
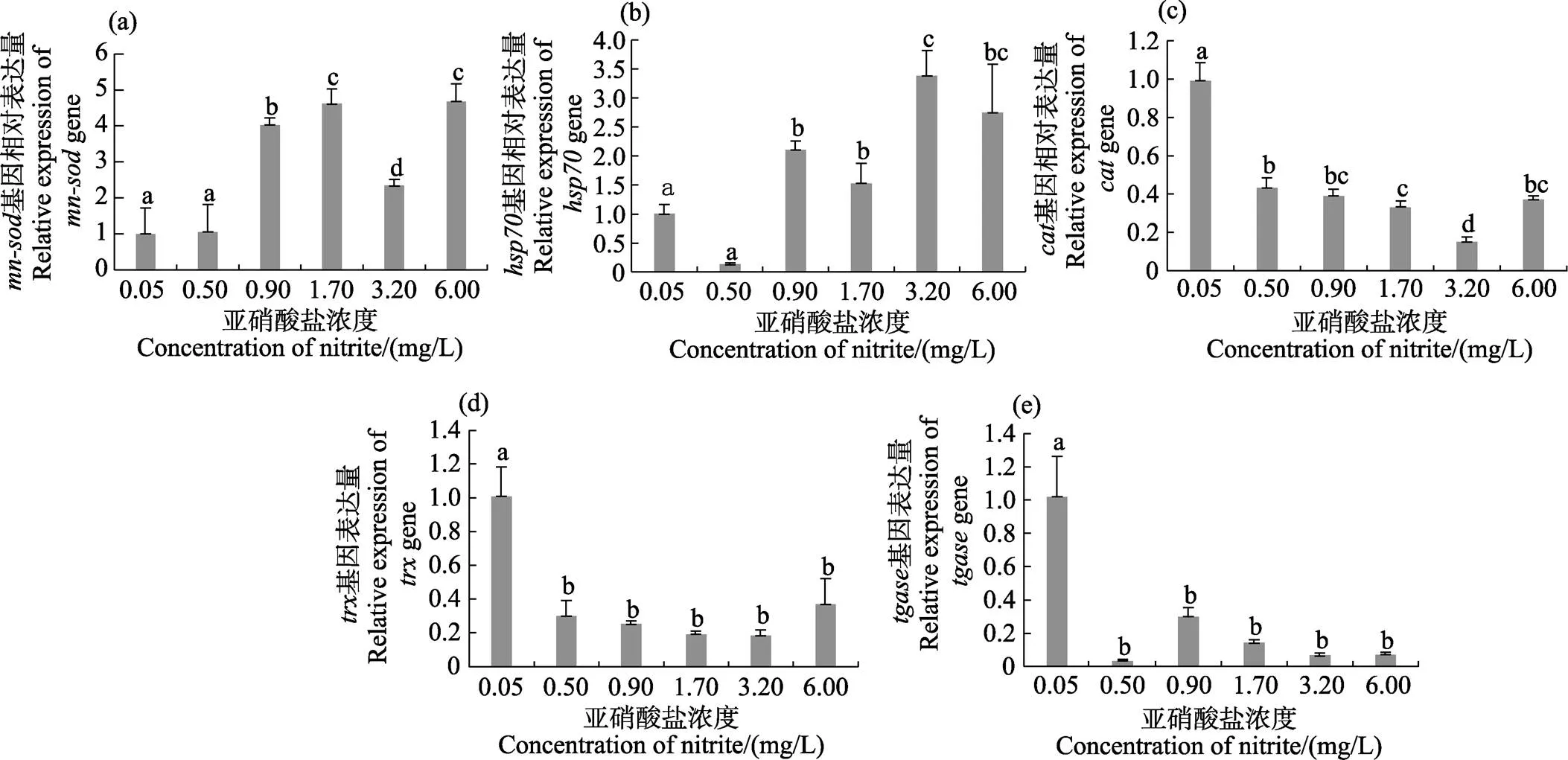
圖3 不同濃度亞硝酸鹽對凡納濱對蝦肝胰腺中免疫相關基因表達的影響
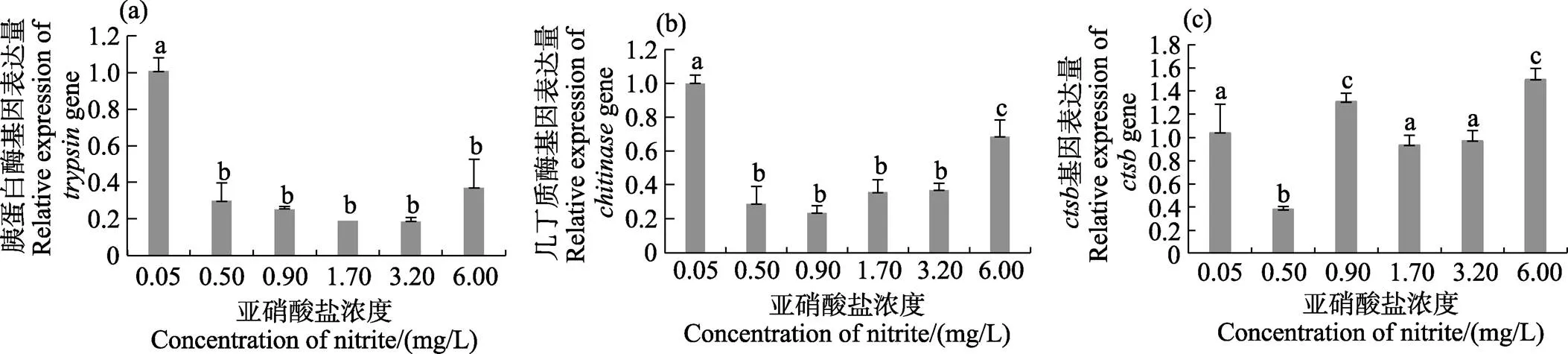
圖4 不同濃度亞硝酸鹽對凡納濱對蝦肝胰腺中生長相關基因表達的影響
3 討論
甲殼動物在受到pH、重金屬等環境因子脅迫時,會發生生理功能紊亂和免疫功能下降(汪蕾等, 2016; Lyu,2014; 周萌等, 2015),異物入侵會造成蝦的氧化損傷(Kultz, 2005)并最終導致細胞功能出現障礙,而抗氧化酶可幫助機體消除多余的自由基,從而使機體免受氧化損傷。SOD和CAT是凡納濱對蝦體內2種重要的抗氧化酶,可協同清除自由基(洪美玲等, 2007)。Zhang等(2015)對羅氏沼蝦進行了氨氮和亞硝酸鹽的聯合急性脅迫實驗,當氨氮濃度為0 mg/L時,隨亞硝酸鹽濃度的升高,羅氏沼蝦血清中SOD活性先降低后升高。葛紅星等(2014)研究了不同濃度亞硝酸鹽(2、4、6和10 mg/L)急性脅迫對凡納濱對蝦免疫相關酶活性的影響,其中6和10 mg/L濃度組對各時間段的抗氧化酶活性有明顯的抑制作用,而其他濃度組不明顯。本研究中,除0.50 mg/L濃度組外,其他濃度組SOD活性均顯著升高,其中0.90和1.70 mg/L濃度組CAT活性顯著升高,較高濃度組(3.20和6.00 mg/L) CAT活性有一定程度的下降。這與上述研究結果不一致,原因可能是當亞硝酸鹽濃度較低時出現“毒性興奮效應”,而較高濃度的亞硝酸鹽則超出抗氧化酶的正常調節范圍。MDA是脂質氧化過程中的產物(Liu, 2011),其含量可反映機體所受的氧化損傷程度。本研究肝胰腺中各濃度組MDA含量升高時,SOD活性也相應升高,說明機體中的抗氧化酶活性會隨MDA含量的變化發生改變,以便及時幫助機體清除自由基。ACP和AKP是2種水解酶,在去磷酸化過程中起重要作用,且可參與機體解毒過程(何海琪等, 1992)。沈敏等(2019)研究發現,高鹽脅迫可使凡納濱對蝦體內的ACP活性顯著升高,而當鹽度高于45后,ACP活性降低。彭軍輝等(2018)研究發現,ACP和AKP活性隨氨氮脅迫時間的增加先升高后降低。本研究中,AKP與ACP活性總體呈升高的趨勢,未受到明顯抑制,原因可能是AKP和ACP仍在進行解毒作用且亞硝酸鹽濃度沒有超出ACP和AKP的正常調節范圍。此外,GOT和GPT活性可反映機體肝組織健康狀態和功能,肝胰腺功能與免疫、代謝等能力息息相關,當對蝦處于健康狀態時,血清中只有少量的轉氨酶;當蝦肝組織受損時,肝細胞會向血淋巴中釋放大量轉氨酶(許宏慶等, 2006)。本研究中,除0.50 mg/L濃度組外,其他濃度組中的轉氨酶活性均顯著高于對照組,說明肝胰腺功能可能受到明顯影響。
肝胰腺是凡納濱對蝦重要的消化器官,具有代謝、消化和免疫等重要功能(蔣昊, 2009),因此,肝胰腺是對蝦受到環境脅迫后的重要研究對象。Wang等(2009)研究發現,pH脅迫對凡納濱對蝦肝胰腺基因的表達有誘導作用。本研究中,除0.50 mg/L濃度組外,其他濃度組肝胰腺基因表達量均顯著升高,與Wang等(2009)的結果相似,表明在亞硝酸鹽脅迫40 d后,肝胰腺中的SOD可能仍在發揮作用,且隨亞硝酸鹽濃度的增加,基因表達量升高以增強抗氧化能力。Zheng等(2016)研究發現,日本對蝦()肝胰腺中基因表達量在高濃度亞硝酸鹽(20 mg/L)的影響下,短時間會明顯升高,但隨時間的增加,基因表達量逐漸降低。本研究中,基因表達量隨亞硝酸鹽濃度的增加顯著降低,原因可能是長時間的亞硝酸鹽脅迫會對基因表達產生抑制作用,從而減少CAT的產生。值得注意的是,CAT酶量減少,但部分濃度組活性仍較高,造成該結果的原因有待研究。本研究中,基因表達量明顯升高,而基因則相反,表明凡納濱對蝦在SOD活性方面對亞硝酸鹽脅迫有較強適應性。
硫氧還蛋白(TRX)是具有氧化還原活性的蛋白質,屬于過氧化酶(PRX)家族。PRX廣泛存在于各種哺乳動物、植物和無脊椎動物中,具有多種生理功能,具有抗氧化、抗高溫等功能(Radyuk, 2003)。在無脊椎動物中,PRX通過消除機體內H2O2來參與體內抗氧化反應。郭慧等(2017)研究發現,亞硝酸鹽脅迫能顯著抑制凡納濱對蝦肝胰腺中基因的表達。本研究各濃度組的基因表達量均顯著降低。說明在長時間的亞硝酸鹽脅迫下,肝胰腺中的TRX在抗亞硝酸鹽脅迫過程中被不斷消耗,且基因表達受到抑制。
谷氨酰胺轉移酶(TGASE)在對蝦免疫功能中具有重要作用。Fagutao等(2012)研究發現,將日本對蝦基因沉默后,蝦體內的血細胞數量顯著降低,同時抗菌肽和溶菌酶的基因表達顯著降低,細菌總數升高;Yao等(2019)研究發現,凡納濱對蝦血藍蛋白可與TGASE直接相互作用并調節其表達。以上研究表明,TGASE參與對蝦凝血過程。蝦類受到異物入侵時,血細胞會釋放TGASE并形成血漿蛋白(Maningas,2008)。盧芷程(2018)則發現,溶藻弧菌()可在短期內誘導基因的表達,而隨時間延長,基因表達量持續降低。說明長時間的環境脅迫會導致基因表達受到抑制。這與本研究結果基本一致,推測凡納濱對蝦的凝血功能可能受到一定程度的影響。
熱休克蛋白(HSPs)作為一種分子伴侶,可對各種外界刺激造成的細胞損傷進行自我修復,并在蝦類的應激反應和先天免疫系統中發揮重要作用(雷愛瑩等, 2008)。當蝦類機體內自由基達到一定數量并超出機體消除自由基的能力后,熱休克蛋白基因會被誘導表達。董學興(2019)研究發現,短期氨氮脅迫可誘導羅氏沼蝦基因大量表達。本研究中,除0.50 mg/L濃度組外,其他濃度組基因表達量均顯著高于對照組,表明凡納濱對蝦體內自由基與抗氧化酶系統可能失衡,熱休克蛋白基因被誘導表達并參與機體修復。綜上所述,凡納濱對蝦總體上生理和免疫功能均受到抑制,但在SOD活性方面表現出較強的適應性。
此外,本研究發現,亞硝酸鹽會顯著抑制凡納濱對蝦的生長。隨著亞硝酸鹽濃度的增加,體質量增長率和體長增長率均呈降低的趨勢,與肖威等(2020)的結果一致。本研究檢測的4種生長相關基因均與凡納濱對蝦的生長發育有非常密切的關系,其中,組織蛋白酶B (CTSB)在脊椎動物中研究較多,它參與多種生理功能,如食物消化、免疫和蛻皮等過程(Wang, 2008; Stephen, 2012)。幾丁質酶又被稱為殼多糖,是甲殼動物在蛻皮過程中最重要的酶之一。呂黎等(2011)報道,幾丁質酶在免疫方面起到一定作用。胰蛋白酶則具有消化食物和水解蛋白質的功能。本研究中,各亞硝酸鹽濃度組胰蛋白酶基因和幾丁質酶基因均顯著降低,表明凡納濱對蝦的消化功能受到了抑制。蝦類在遭受外界病原體或異物侵襲時,體內的能量代謝會發生變化。由于外界環境的惡化,體內穩態失衡,細胞產生應激反應,包括DNA和蛋白質損傷修復、細胞周期停滯或凋亡,并從細胞的生長狀態轉型至細胞的修復狀態(Kultz, 2005)。這些過程會消耗大量能量,從而影響蝦的生長。本研究中,各濃度組胰蛋白酶基因和幾丁質酶基因表達量顯著降低,可能與凡納濱對蝦體內大量能量參與免疫調控及維持滲透壓平衡有關。李忠帥等(2021)研究發現,亞硝酸鹽可在凡納濱對蝦體內迅速積累并加快其能量代謝,進一步說明亞硝酸鹽抑制凡納濱對蝦生長的機制。郭慧等(2017)研究發現,亞硝酸鹽可顯著誘導基因的表達,之前郭慧等(2013)研究發現,CTSB可能參與細胞凋亡。本研究中,基因表達無明顯規律,可能因為該基因功能較復雜,未來需要作進一步的研究。
4 結論
在亞硝酸鹽濃度分別為0.50、0.90、1.70、3.20和6.00 mg/L,鹽度為5的水體中養殖40 d后,凡納濱對蝦各濃度組死亡率顯著升高,生長性能和免疫功能受到阻遏,但在SOD活性方面表現出較強的適應性。各濃度組生長相關酶基因表達量顯著降低,凡納濱對蝦消化功能受到抑制。此外,當亞硝酸鹽濃度大于0.9 mg/L時,凡納濱對蝦肝胰腺功能可能受到明顯影響。在鹽度為5條件下,為保證凡納濱對蝦的健康養殖,亞硝酸鹽濃度應控制在0.50 mg/L以下。
CHEN J C, CHENG S Y. Hemolymph oxygen content, oxyhemocyanin, protein levels and ammonia excretion in the shrimpexposed to ambient nitrite. Journal of Comparative Physiology B Biochemical Systems and Environmental Physiology, 1995, 164(7): 530–535
CHENG S Y, CHEN J C. Accumulation of nitrite in the tissues ofexposed to elevated ambient nitrite after different time periods. Archives of Environmental Contamination and Toxicology, 2000, 39(2): 183–192
DONG X X. Stress response ofto ammonia-N and its environmental effects in different culture patterns. Doctoral Dissertation of Shanghai Ocean University, 2019 [董學興. 羅氏沼蝦對氨氮的脅迫響應及其不同養殖模式的環境效應. 上海海洋大學博士研究生學位論文, 2019]
FAGUTAO F F, MANINGAS M B, KONDO H,. Transglutaminase regulates immune-related genes in shrimp. Fish and Shellfish Immunology, 2012, 32(5): 711–715
GE H X, LI J, CHEN P,. Susceptibility ofto: The influence of environmental nitrite nitrogen. Journal of Fishery Sciences of China, 2014, 21(3): 629–636 [葛紅星, 李健, 陳萍, 等. 亞硝酸鹽氮脅迫下凡納濱對蝦對副溶血弧菌的易感性. 中國水產科學, 2014, 21(3): 629–636]
GUO H, TAN C T, YOU L Y,. Effects of nitrite stress on gene expression of antioxidant enzymes, heat shock protein and cathepsin B in hepatopancreas of. Journal of Guangdong Ocean University, 2017, 37(3): 117–122 [郭慧, 譚翠婷, 游林玉, 等. 亞硝酸鹽脅迫對凡納濱對蝦肝胰腺抗氧化酶、熱休克蛋白和組織蛋白酶B基因表達量的影響. 廣東海洋大學學報, 2017, 37(3): 117–122]
GUO H, XIAN J A, LI B,. Gene expression of apoptosis-related genes, stress protein and antioxidant enzymes in hemocytes of white shrimpunder nitrite stress. Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2013, 157: 366–371
HE H Q, SUN F. Studies on the characteristics of acid and alkaline phosphatases in Chinese shrimp. Oceanologia et Limnologia Sinica, 1992, 23(5): 555–560 [何海琪, 孫鳳. 中國對蝦酸性和堿性磷酸酶的特性研究. 海洋與湖沼, 1992, 23(5): 555–560]
HONG M L, CHEN L Q, GU S Z,. Effects of ammonia exposure on immunity indicators of haemolymph and histological structure of hepatopancreas in Chinese mitten crab (). Journal of Fishery Sciences of China, 2007, 14(3): 412–418 [洪美玲, 陳立僑, 顧順樟, 等. 氨氮脅迫對中華絨螯蟹免疫指標及肝胰腺組織結構的影響. 中國水產科學, 2007, 14(3): 412–418]
HU Y B, WANG Y, JIANG N C. Effects of ammonia-N and nitrite-N on the hemocyte count and ultrastructure of.Journal of Zhejiang University (Science Edition), 2005, 32(6): 691–697 [胡義波, 王玥, 姜乃澄. 氨態氮、亞硝態氮對羅氏沼蝦血細胞及超微結構的影響. 浙江大學學報(理學版), 2005, 32(6): 691–697]
JIANG H. Comparative proteomic profiles of the hepatopancreas inresponse to stresses. Doctoral Dissertation of Chinese Academy of Sciences (Institute of Oceanology), 2009 [蔣昊. 中國明對蝦在脅迫條件下肝胰臟的差異蛋白質組學研究. 中國科學院研究生院(海洋研究所)博士研究生學位論文, 2009]
KULTZ D. Molecular and evolutionary basis of the cellular stress response. Annual Review of Physiology, 2005, 67: 225–257
LEI A Y, ZENG D G. Effects of compound Chinese herbal on the expression of heat stress protein 70 gene in white shrimp (). Journal of Southern Agriculture, 2008, 39(6): 830–833 [雷愛瑩, 曾地剛. 復方中草藥對凡納濱對蝦熱應激蛋白70基因表達的影響. 廣西農業科學, 2008, 39(6): 830–833]
LI Z S, MA S, SHAN H W,. Accumulation of nitrite and responses of energy metabolism exposed to nitrite stress in. Journal of Fisheries of China, 2021, 45(11): 1825–1834 [李忠帥, 馬甡, 單洪偉, 等. 亞硝態氮脅迫下凡納濱對蝦體內亞硝態氮的積累與能量代謝響應. 水產學報, 2021, 45(11): 1825–1834]
LIU L X, XI Q Y, YANG L,. The effect of dietarypolysaccharide extract on the immune responses in white shrimp,. Fish and Shellfish Immunology, 2011, 30(2): 495–500
LU Z C, XU L J, LU W Y,. Effects ofon hemocytes toxicity, apoptosis and immune-related genes in. Journal of Southern Agriculture, 2018, 49(12): 2559–2565 [盧芷程, 許鑾佳, 盧文宇, 等. 溶藻弧菌對凡納濱對蝦血細胞毒性及細胞凋亡和免疫相關基因的影響. 南方農業學報, 2018, 49(12): 2559–2565]
Lü L, NING Q J. Research progress on the structure and function of chitinase gene in crustacean. Progress in Physiological Sciences, 2011, 42(6): 457–459 [呂黎, 寧黔冀. 甲殼動物幾丁質酶基因結構與功能的研究進展. 生理科學進展, 2011, 42(6): 457–459]
LYU K, ZHU X X, Chen R,. Molecular cloning of manganese superoxide dismutase gene in the cladoceran: Effects of microcystin, nitrite, and cadmium on gene expression profiles. Aquatic Toxicology, 2014, 148(1): 55–64
MALLASEN M, WAGNER C V. Effect of nitrite on larval development of giant river prawn. Aquaculture, 2006, 261(4): 1292–1298
MANINGAS M, KONDO H, HIRONO I,. Essential function of transglutaminase and clotting protein in shrimp immunity. Molecular Immunology, 2008, 45(5): 1269–1275
PENG J H, CHEN L Y, CHENG C H,Acute toxicity of ammonia nitrogen toand its influence on immune factors in serum. Progress in Fishery Sciences, 2018, 39(5): 114–121 [彭軍輝, 陳麗英, 程長洪, 等. 氨氮對擬穴青蟹的急性毒性及對其血清免疫相關酶活力的影響. 漁業科學進展, 2018, 39(5): 114–121]
PENG Z R, ZANG W L, GAO Y,. Toxic effects of ammonia and nitrite onjuvenile. Journal of Shanghai Fisheries University, 2004, 13(3): 274–278 [彭自然, 臧維玲, 高楊, 等. 氨和亞硝酸鹽對凡納濱對蝦幼蝦的毒性影響. 上海水產大學學報, 2004, 13(3): 274–278]
RADYUK S N, SOHAL R S, ORR W C. Thioredoxin peroxidases can foster cytoprotection or cell death in response to different stressors: Over- and under- expression of thioredoxin peroxidase incells. Biochemical Journal, 2003, 371(3): 743–752
SHEN M, ZHAO Y C, LING T,Effects of high-salt abrupt on growth and related enzyme activities in. Oceanologia et Limnologia Sinica, 2019, 50(1): 204–209 [沈敏, 趙玉超, 凌濤, 等. 高鹽突變對凡納濱對蝦()生長性能及相關酶活力的影響. 海洋與湖沼, 2019, 50(1): 204–209]
STEPHEN A, ROJO L, ARAUJO-BERNAL S,. Cathepsin B from the white shrimp: cDNA sequence analysis, tissues-specific expression and biological activity. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2012, 161(1): 32–40
TSENG I T, CHEN J C. The immune response of white shrimpand its susceptibility tounder nitrite stress. Fish and Shellfish Immunology, 2004, 17(4): 325–333
WANG L, ZHANG X X, ZHENG P H,.Effects of sulfide stress on expressions of antioxidant enzymes inhaemocytes. Sichuan Journal of Zoology, 2016, 35(6): 884–888 [汪蕾, 張秀霞, 鄭佩華, 等. 硫化物脅迫對凡納濱對蝦血細胞抗氧化酶基因表達的影響. 四川動物, 2016, 35(6): 884–888]
WANG W N, ZHOU J, WANG P,. Oxidative stress, DNA damage and antioxidant enzyme gene expression in the pacific white shrimp,when exposed to acute pH stress. Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2009, 150(4): 428–435
WANG X M, LIU B Z, WANG G D,. Molecular cloning and functional analysis of cathepsin B in nutrient metabolism during larval development in. Aquaculture, 2008, 282(1/2/3/4): 41–46
WU Z H, LIU C B, LIU C R,.Histopathological research on chronic poisoning ofby nitrite and ammonia. Journal of Central China Normal University (Natural Sciences), 1999, 33(1): 119–122 [吳中華, 劉昌彬,劉存仁, 等. 中國對蝦慢性亞硝酸鹽和氨中毒的組織病理學研究. 華中師范大學學報(自然科學版), 1999, 33(1): 119–122]
XIAO W, SHAN H W, MA S,. Effects of chronic nitrite stress on body composition and glucose metabolism of.Progress in Fishery Sciences, 2020, 41(6): 74–81 [肖威, 單洪偉, 馬甡, 等. 亞硝態氮慢性脅迫對凡納濱對蝦體成分和糖代謝的影響. 漁業科學進展, 2020, 41(6): 74–81]
XV H Q, CUI Y H, LI J,. Effects of cadmium on some biochemical indexes in the serum of. Reservoir Fisheries, 2006, 26(5): 6–7, 20 [許宏慶, 崔勇華, 李晶, 等. 鎘對克氏原螯蝦血清中部分生化指標的影響. 水利漁業, 2006, 26(5): 6–7, 20]
YAO D, WANG Z, WEI M,. Analysis ofhemocyanin interacting proteins reveals its role in hemolymph clotting. Journal of Proteomics, 2019, 201: 57– 64
ZANG W L, JIANG M, ZHANG J D,. The toxic effects of NO2–-N and NH3-N onlarva. Journal of Shanghai Fisheries University, 1996, 5(1): 15–22 [臧維玲, 江敏, 張建達, 等. 亞硝酸鹽和氨對羅氏沼蝦幼體的毒性. 上海水產大學學報, 1996, 5(1): 15–22]
ZHANG Y F, YE C X, WANG A L,. Isolated and combined exposure to ammonia and nitrite in giant freshwater pawn (): Effects on the oxidative stress, antioxidant enzymatic activities and apoptosis in haemocytes. Ecotoxicology, 2015, 24: 1601–1610
ZHENG J B, MAO Y, SU Y Q,. Effects of nitrite stress on mRNA expression of antioxidant enzymes, immune-related genes and apoptosis-related proteins in. Fish and Shellfish Immunology, 2016, 58: 239– 252
ZHOU M, WU Z H, LIANG R S,. Biochemical and cellular immunological responses of Pacific white shrimp,to cold shock. Guangdong Agricultural Sciences, 2015, 24: 134–139 [周萌, 吳灶和, 梁日深, 等. 急性降溫對凡納濱對蝦血液生化指標及細胞免疫指標的影響. 廣東農業科學, 2015, 24: 134–139]
Changes in Immune System and Growth Performance ofafter 40-Day Challenge with Different Concentrations of Nitrite
FANG Cheng, LI Lanshi, LIANG Zhenyu, CHENG Liangfeng, DAI Xilin①
(Shanghai Ocean University, National Experimental Teaching Demonstration Center of Fisheries Science, Ministry of Agriculture and Rural Affairs, Key Laboratory of Freshwater Aquatic Germplasm Resources, Aquatic Animal Genetic Breeding Center Shanghai Collaborative Innovation Center, Shanghai 201306, China)
After 40 days of exposure to different concentrations of nitrate at a salinity of 5, the effect of nitrite on the immune system and growth performance ofwasexplored to provide a theoretical basis for constraining the effect of nitrite subacute stress on the speciesFive nitrite concentration groups (0.50, 0.90, 1.70, 3.20, and 6.00 mg/L) and a control group (0.05 mg/L) were used in this experiment. Furthermore, we detected the activity of immune-related enzymes, malondialdehyde (MDA) content, and relative expression of immune- and growth-related genes. Results showed that the mortality rate ofincreased with an increasing nitrite concentration, and the weight gain rate (WGR) and length gain rate (LGR) in the 6.00 mg/L group were significantly lower than those in the control group (<0.05). The activity of superoxide dismutase (SOD), catalase (CAT), acid phosphatase (ACP), and alkaline phosphatase (AKP) in the serum and hepatopancreas increased under the influence of nitrite in 0.90 and 3.20 mg/L groups. The activity of SOD in the hepatopancreas was significantly higher than those in the control group when the concentration was higher than 0.50 mg/L (<0.05). CAT activities in the 0.50, 0.90, and 1.70 mg/L groups were significantly higher than those in the control group. The activity of SOD and CAT in the serum first decreased, then increased, and then decreased again with an increasing concentration of nitrite. The activities of AKP and ACP in the serum and hepatopancreas in the 0.90 mg/L group were significantly higher than those in the control group (<0.05). There was no obvious change in MDA content across groups. In addition, serum glutamic-pyruvic transaminase (GPT) activity was significantly higher in the serum than in the control group (<0.05). The results of quantitative real-time PCR showed that the relative expression ofandgenes in the hepatopancreas was significantly higher than that in the control group, except in the 0.50 mg/L concentration group (<0.05). The relative expression of,,,, andgenes in the hepatopancreas was significantly lower than that in the control group (<0.05). After 40 days of challenge with different concentrations of nitrite, the growth and immune function ofclearly diminished. The concentration of nitrite should be controlled below 0.50 mg/L in the production process at a salinity of 5 to ensure the healthy farming of.
; Nitrite; Enzyme activity; Environmental stress
DAI Xilin, E-mail:xldai@shou.edu.cn
10.19663/j.issn2095-9869.20210421001
S917.4
A
2095-9869(2022)04-0180-10
*上海市蝦類產業體系建設項目(滬農科[2014]第5號)資助[This work was supported by Shanghai Shrimp Industry System Construction Project (Shanghai Agricultural Science [2014] No.5)]. 方 成,E-mail: 2414100497@qq.com
戴習林,教授,E-mail: xldai@shou.edu.cn
2021-04-21,
2021-06-18
http://www.yykxjz.cn/
方成, 黎蘭詩, 梁震宇, 成良峰, 戴習林. 不同濃度亞硝酸鹽亞急性脅迫對凡納濱對蝦生長與免疫功能的影響. 漁業科學進展, 2022, 43(4): 180–189
FANG C, LI L S, LIANG Z Y, CHENG L F, DAI X L. Changes in immune system and growth performance ofafter 40-day challenge with different concentrations of nitrite. Progress in Fishery Sciences, 2022, 43(4): 180–189
(編輯 馬璀艷)

