垂體后葉注射液中升壓素效價測定的不確定度評定
謝 鵬 寧 玲 田 婧 張 贊 吳超權 黃 憲 林 昊
垂體后葉注射液中升壓素效價測定的不確定度評定
謝 鵬 寧 玲 田 婧 張 贊 吳超權 黃 憲 林 昊
(廣西壯族自治區食品藥品檢驗所,廣西 南寧 530012)
目的:建立垂體后葉注射液中升壓素效價測定的不確定度評定的方法。方法:建立評定垂體后葉注射液中升壓素效價測定的模型,分析其測定不確定度的影響因素,并對各分量進行量化分析,計算擴展不確定度。結果:垂體后葉注射液中升壓素效價的影響值排序為:微量注射器藥液注射過程>供試品溶液的配制>標準品溶液的配制>血壓反應的測定過程>環境溫度>標準品的純度。垂體后葉注射液中升壓素效價的擴展不確定度為0.2414 IU/mL,其效價可表示為(5.7822±0.2414)IU/mL,為標示量的(96.37±4.02)%。結論:該方法適用于垂體后葉注射液中升壓素效價測定的不確定度評定,為優化實驗過程,提高實驗結果的可靠性提供參考。
垂體后葉注射液;升壓素;效價;不確定度
引言
垂體后葉注射液主要成分是升壓素和縮宮素,可收縮動脈和靜脈血管而發揮止血作用,其主要用于肺、支氣管出血(如咯血)、消化道出血(嘔血、便血),并適用于產科催產及產后收縮子宮、止血等,對于腹腔手術后腸道麻痹亦有功效,尚對尿崩癥有減少排尿量之作用[1,2]。垂體后葉注射液收載于《中華人民共和國藥典》2020年版第二部,其效價的評估采用生物效價測定法對升壓素和縮宮素的效價進行測定,標準規定以升壓素計,其效價應為標示量的87%~115%,且每1 mg蛋白中升壓素效價不得少于4.0單位;且縮宮素與升壓素的效價比值應為0.9~1.7[3]。其中升壓素的效價測定采用大鼠進行試驗,該方法屬于經典的生物測定方法,由于生物測定的干擾因素校多、影響較大,所測結果的真實性存在一定的爭議,特別是當檢驗結果處于標準規定邊緣時就很難準確判定其是否符合標準的要求。不確定度含義是指由于測量誤差的存在,對被測量值的不能肯定的程度,即表明該結果的可信賴程度,不確定度愈小,所述結果與被測量的真值愈接近,質量越高,水平越高,其使用價值越高;不確定度越大,測量結果的質量越低,水平越低,其使用價值也越低。不確定度評定是通過對實驗過程各個環節引入的不確定度進行評估,以分析各因素對測定結果的影響。用對觀測列進行統計分析的方法來評定標準不確定度,稱為不確定度A類評定;用不同于對觀測列進行統計分析的方法來評定標準不確定度,稱為不確定度B類評定;B類評定方法應用相當廣泛。測量不確定度對于提高檢測數據的可靠性、準確判斷測量結果臨界值、確認適合的方法以及實驗室質量和風險控制等方面均具有重要意義。特別是當檢驗檢測的結果處于標準規定的邊緣值時,引入不確定度參數對評定分析方法的可靠性和測量結果的準確性就更加重要[4,5]。本研究參考GB/T 27418-2017和JJF 1059-1999《測量不確定度評定和表示》、CNAS-CL07:2011《測量不確定度的要求》和相關的文獻[6,7],對垂體后葉注射液中升壓素效價測定的不確定度進行量化評價,建立了垂體后葉注射液中升壓素效價測定的不確定度的評定方法,以優化實驗過程,提高實驗結果的可信程度。
1 儀器與試藥
1.1 儀器
Biopac16通道生理記錄儀(普升科技有限公司);CPA223S電子天平(德國賽多利斯sartorius公司);VORTEX周圍振蕩器(德國艾卡IKA公司)。
1.2 試藥
賴氨酸升壓素標準品(中國食品藥品檢定研究院,批號150525-201301,4 IU/支);垂體后葉注射液(安徽宏業藥業有限公司,批號200977,規格:1 mL∶6IU),甲磺酸酚妥拉明注射液(上海旭東海普藥業有限公司,批號D190308);氯化鈉注射液(回音必集團江西東亞制藥有限公司,批號2019102115);肝素鈉注射液(江蘇萬邦生化醫藥集團有限責任公司,批號51901108)。
2 方法與結果
2.1 升壓素效價測定
2.1.1 標準品儲備液的制備
取賴氨酸升壓素標準品2支,精密加入氯化鈉注射液8.00 mL使其溶解混勻,即得濃度為1.0 IU/mL的溶液,作為標準品儲備液。
2.1.2 標準品供試液的制備
分別取標準品儲備液0.8 mL、0.5 mL至5 mL容量瓶中,用氯化鈉注射液稀釋定容至刻度,即得濃度為0.16 IU/mL、0.10 IU/mL的溶液,作為標準品的高(s2)濃度稀釋液和低(s1)濃度稀釋液。
2.1.3 供試品儲備液的制備
精密量取垂體后葉注射液(標示量為6 IU/mL)0.833 mL至5 mL容量瓶中,用氯化鈉注射液稀釋定容至刻度,即得1.0 IU/mL的溶液,作為供試品儲備液。
2.1.4 供試品供試液的制備
分別取標準品儲備液0.8 mL、0.5 mL至5 mL容量瓶中,用氯化鈉注射液稀釋定容至刻度,即得濃度為0.16 IU/mL、0.10 IU/mL的溶液,作為標準品的高(t2)濃度稀釋液、低(t1)濃度稀釋液。
2.1.5 樣品效價測定
按照2020版《中華人民共和國藥典》中的升壓素生物測定法來測定垂體后葉注射液中升壓素的效價。取健康、無傷、合格、體重在300 g以上的成年雄性SD大鼠,腹腔注射烏拉坦1 g/kg進行麻醉后,固定于保溫手術臺上,分離氣管,必要時氣管插管,以保證呼吸的通暢性。在一側股靜脈插入靜脈插管,供注射藥液用,按體重每100 g注入肝素溶液50 IU。然后剝離一側頸動脈,插入與血壓換能器相連的動脈插管,在血壓換能器與插管通路中充滿氯化鈉注射液,并于動脈插管中注入適量的肝素抗凝,全部手術完成后,將血壓換能器與調節到適當的高度,打開動脈夾,開啟多道生理信號采集處理系統,記錄血壓。從股靜脈插管中緩緩注入交感神經阻斷藥甲磺酸酚妥拉明溶液0.1 mg/100 g體重,每次注射甲磺酸酚妥拉明后立即注入適量氯化鈉注射液將藥液沖入,隔5 min~10 min后待血壓恢復至極限,用同樣的劑量再注射一次,共注射2次。待血壓穩定后即可進行藥液注射,每次藥液的注射速度基本相同,每次藥液的注射體積為0.1 mL,并于每次注射后立即注入適量氯化鈉注射液。在前一次注射的反應基本穩定以后進行下一次注射,相鄰兩次注射的間隔時間為15 min。標準品稀釋液和供試品稀釋液各取高低兩個劑量(S1,S2,T1,T2)為一組,按隨機區組設計的次序輪流注入每組四個劑量,重復4組。第一組注射順序為:S1,S2,T1,T2, 第二組注射順序為:S2,T1,T2,S1, 第三組注射順序為:T1,T2,S1,S2,第四組注射順序為:T2,S1,S2,T1, 測量給藥后的收縮壓與給藥前的收縮壓差值作為反應值,照生物檢定統計法(《中國藥典》2020年版四部通則1431)中的量反應平行線測定法計算效價及實驗誤差。實驗中,高低劑量的比值不得大于1∶0.6,且劑量要求為低劑量能引起血壓升高,高劑量不致使血壓升高達到極限值。標準規定本品效價應為標示量的87%~115%,本法的可信限率(FL%)不得大于20%,且直線回歸、劑間有非常顯著性差異,偏離平行不顯著,可靠性檢查即通過,測得的效價結果才可成立。
2.1.6 可靠性檢驗與效價計算
本實驗采用《中國藥典》生物檢定統計程序BS2000量反應平行線2.2法按隨機區組設計計算效價和實驗誤差。大鼠血壓反應值結果見表1,可靠性檢測結果見表2。

表1 大鼠血壓反應值測定結果(mmHg)
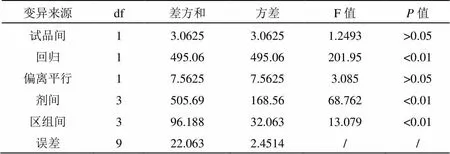
表2 可靠性檢測結果
由表2可知,該實驗劑間及回歸顯著(<0.01),偏離平行不顯著(>0.05),可靠性檢驗通過,效價結果成立。垂體后葉注射液中升壓素的標示效價為6 IU/mL,本試驗中采用的劑間比為0.625,根據量反應平行線2.2法計算得效價PT=5.7822 IU/mL,測得效價的可信限率為FL=7.6023%。則垂體后葉注射液中升壓素效價與標示量的比值=5.7822/6×100%=96.37%,屬于標準規定的87%~115%的范圍,該樣品符合標準規定。
2.2 測量不確定度評定
2.2.1 不確定度的來源及其分析
根據量反應平行線測定隨機區組設計2.2法的計算公式得測量數學模型如下:
PT=AT×s2/T2×antilg(IV/W)
V=1/2×(T1+T2-S1-S2)
W=1/2×(T2-T1+S1-S1)
式中,AT為估計效價,s2為標準品稀釋液高濃度,為供試品稀釋液高濃度,I為劑間比的對數值,T1為四組低濃度供試品稀釋液引起的血壓反應值總和,T2為四組高濃度供試品稀釋液引起的血壓反應值總和,S1為四組低濃度標準品稀釋液引起的血壓反應值總和,S1為四組高濃度標準品稀釋液引起的血壓反應值總和。
由計算公式及具體試驗過程可得出,升壓素效價測定過程中引入的不確定度與多方面的因素有關,包括標準品的純度,配制標準品溶液及供試品溶液所用的移液器、定容器具,藥液注射過程,血壓反應值的測定過程等。
2.2.2 升壓素效價測定過程中各分量不確定度評定
(1)標準品純度引入的相對標準不確定度U(S)。
賴氨酸升壓素標準品由中國食品藥品檢定研究院提供,其純度為99.50%,按矩形分布計算,即k=√3,則U(S)=5×10-4/√3=0.0002887。
(2)標準品溶液配制引入的相對標準不確定度U(s)。
10 mL和1 mL移液器的容量允許誤差分別為±0.060 mL和±0.010 mL[8],5 mL容量瓶的容量允許誤差為±0.020 mL[9],按三角分布計算,即k=√6。
標準品儲備液制備過程:使用10 mL移液器精密加入氯化鈉注射液8.00 mL,其引入的相對標準不確定度為0.060/(8.0×√6)=0.003062;
ds2制備過程:使用1 mL移液器量取標準品儲備液0.8 mL,其引入的相對標準不確定度為0.010/(0.8×√6)=0.005103;加入5 mL容量瓶定容,其引入的相對標準不確定度為0.020/(5.0×√6)=0.001633;s2制備過程中的合成不確定度=√(使用1 mL移液器量引入的不確定度2+使用5 mL容量瓶引入的不確定度)=√(0.0051032+0.0016332)=0.005358。
s1制備過程:使用1 mL移液器量取標準品儲備液0.5 mL,其引入的相對標準不確定度為0.010/(0.5×√6)=0.008165;加入5 mL容量瓶定容,其引入的相對標準不確定度為0.020/(5.0×√6)=0.001633;s1制備過程中的合成不確定度=(使用1 ml移液器量引入的不確定度2+使用5 mL容量瓶引入的不確定度)=√(0.0081652+0.0016332)=0.008327。
則標準品溶液配制引入的合成不確定度U(s)=√(標準品儲備液制備過程的相對標準不確定度2+s2制備過程中的合成不確定度2+s1制備過程中的合成不確定度2)=√(0.0030622+0.0053582+0.0083272)=0.01036。
(3)供試品溶液配制引入的相對標準不確定度U(t)。
1 mL移液器的容量允許誤差為±0.010 mL,5 mL容量瓶的容量允許誤差為±0.020 mL,按三角分布計算,即k=√6。
供試品儲備液制備過程:使用1 mL移液器精密量取垂體后葉注射液(標示量為6 IU/mL)0.833 mL,其引入的相對標準不確定度為0.010/(0.833×√6)=0.004901;加入5 mL容量瓶定容,其引入的相對標準不確定度為0.020/(5.0×√6)=0.001633;供試品儲備液制備過程合成不確定度=√(使用1 mL移液器量引入的不確定度2+使用5 mL容量瓶引入的不確定度2)=√(0.0049012+0.0016332)=0.005166。
t2制備過程:使用1 mL移液器量取標準品儲備液0.8 mL,其引入的相對標準不確定度為0.010/(0.8×√6)=0.005103;加入5 mL容量瓶定容,其引入的相對標準不確定度為0.020/(5.0×√6)=0.001633;t2制備過程中合成不確定度=√(使用1 mL移液器量引入的不確定度2+使用5 mL容量瓶引入的不確定度2)=(0.0051032+0.0016332)=0.005358。
t1制備過程:使用1 mL移液器量取標準品儲備液0.5 mL,其引入的相對標準不確定度為0.010/(0.5×√6)=0.008165;加入5 mL容量瓶定容,其引入的相對標準不確定度為0.020/(5.0×√6)=0.001633;t1制備過程合成不確定度為√(0.0081652+0.0016332)=0.008327。
供試品溶液配制引入的合成不確定度U(t)=√(供試品儲備液制備過程合成不確定度2+t2制備過程中合成不確定度2+t1制備過程合成不確定度2)=√(0.0051662+0.0053582+ 0.0083272)=0.01116。
(4)微量注射器藥液注射過程引入的相對標準不確定度U(Z)。
100 uL微量注射器的容量允許誤差為±0.003 mL,按三角分布計算,即k=√6。使用100 uL微量注射器進行注射,注射體積為0.1 mL,則其引入的相對標準不確定度為U(Z)=0.003/(0.1×√6)=0.01225。
(5)血壓反應的測定過程引入的相對標準不確定度U(B)。
f總=mk-1=4×4-1=13;f劑間=k-1=4-1=3;f區組間=m-1=4-1=3;f誤差=f總-f劑間-f區組間=7;
t=2.37;s2=2.4514
V=1/2(T1+T2-S1-S2);W=1/2(T2-T1+S2-S1);
U(B)=Sm/√m=0.01459/√4=0.007295
式中,k為總劑量數,m為測量次數,f總為總自由度,f劑間為劑間自由度,f區組間為區組間自由度,f誤差為誤差自由度,t為t值表查詢所得,s2為誤差的方差值,T1為供試品低劑量血壓反應值總和,T2為供試品高劑量血壓反應值總和,S1為標準品低劑量血壓反應值總和,S2為標準品高劑量血壓反應值總和。
(6)環境溫度引入的相對標準不確定度U(T)。
實驗環境溫度為(20±3)℃,溶劑水的體積膨脹系數為2.1×10-4℃-1,按矩形分布計算,即k=√3,則環境溫度引入的相對標準不確定度U(T)=3×2.1×10-4/√3=0.0003637。
2.2.3 合成相對標準不確定度計算U合成
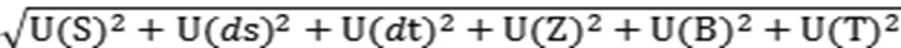
2.2.4 擴展不確定度U擴展
根據升壓素生物測定結果可知,樣品的效價為5.7822 IU/mL,測量結果的合成相對標準不確定度U合成為0.02087,則樣品效價的合成標準不確定度為5.7822×0.02087=0.1207 IU/mL。在沒有特殊要求的情況下,按照國際慣例,取擴展因子k=2,測量結果的擴展不確定度U擴展=2×0.1207 IU/mL=0.2414 IU/mL。因此,垂體后葉注射液中升壓素效價可表示為(5.7822±0.2414)IU/mL,為其標示量的(96.37±4.02)%。
3 討論
根據2020年版《中華人民共和國藥典》(二部)要求,垂體后葉注射液中升壓素效價應為標示量的87%~115%,可信限率(FL%)不得大于20%,本實驗中測得的效價為標示量的96.37%,效價的可信限率為FL=7.6023%。生物測定方法的誤差較大,本研究通過對標準品的純度、所用的移液器和定容器具、藥液注射過程、血壓反應值的測定過程等不確定度進行評價,得出垂體后葉注射液中升壓素效價的擴展不確定度為0.2414 IU/mL,則該批垂體后葉注射液中升壓素效價為5.5408 IU/mL~6.0236 IU/mL,為標識量的92.34%~100.40%,符合藥典規定值,為合格檢品。通過對升壓素效價測定的不確定度分析可知,影響生物效價的因素很多,盡管每個分量對效價的影響程度不同,但多個分量的影響值均較大,與化學分析中不確定度的評定值相比,生物分析的不確定度值要更大。本研究對垂體后葉注射液中升壓素效價測定的不確定度進行評定,其影響程度由大到小的排序為:微量注射器藥液注射過程>供試品溶液的配制>標準品溶液的配制>血壓反應的測定過程>環境溫度>標準品的純度。
4 結論
由上述影響程度結果可知,供試品溶液及標準品溶液配制過程中引入的誤差較大,為減少配制過程中引入的不確定度,可通過減小溶液配制體積,并根據所取液體的體積選擇量程范圍適宜的移液工具和容量工具。不確定度的評價分析有助于加深對實驗影響因素的認識,從而優化實驗操作細節,降低不確定度數值,提高實驗的準確性和可靠性。
[1] 張營,杜益,潘余睿智,等. 垂體后葉注射液含量HPLC法和生物效價測定法等效性研究[J]. 藥物分析雜志,2018,38(10): 1830-1836.
[2] 薛洪寶,胡銳,常華蘭,等. 垂體后葉素質量控制標準及不良反應分析[J]. 甘肅醫藥,2019,38(10): 929-933,940.
[3] 國家藥典委員會. 中華人民共和國藥典2020年版: 二部[M]. 北京: 中國醫藥科技出版社,2020.
[4] 戴青,韓寧寧,王軒,等. 管碟法測定硫酸安普霉素效價的不確定度評定[J]. 中國獸藥雜志,2021,55(3): 25-29.
[5] 劉婷婷,張捷,王尊文. 整體法評估藥品中需氧菌計數檢驗結果的不確定度[J]. 中國藥事,2021,35(1): 74-78.
[6] JJF 1059-1999. 測量不確定度的評定與表示[S]. 北京: 中國標準出版社,1999.
[7] GB/T 27418-2017. 測量不確定度評定和表示[S]. 北京: 中國標準出版社,2017.
[8] JJG 646-2018. 移液器檢定規程[S]. 北京: 中國標準出版社,2018.
[9] GB/T 12810-1991. 實驗室玻璃儀器玻璃量器的容量校準和使用方法[S]. 北京: 中國標準出版社,1991.
Evaluation of Uncertainty in the Titer Determination of Vasopressin in Posthypophysis Injection
Objective: To establish a method of the uncertainty evaluation of the potency of vasopressin in posthypophysis injection. Method: Model for potency of vasopressin in posthypophysis injection was established to analyze the influential factors of uncertainty. The uncertainty components were quantitatively analyzed and the expanded uncertainty was calculated. Results: The order of the influence value of vasopressin titer in posthypophysis injection was as follows: process of microsyringe injection> preparation of test solution> preparation of standard solution> determination of blood pressure> ambient temperature> the purity of standard. The expanded uncertainty of the potency of vasopressin in posthypophysis injection was 0.2414 IU/ml and the potency of was (5.7822±0.2414) IU/mL, equivalent to (96.37±4.02)% of the labeled amount. Conclusion: This method can be used to evaluate the uncertainty evaluation of the potency of vasopressin in posthypophysis injection, which provides reference for optimizing the experiment and improving the reliability of the results.
posthypophysis injection; vasopressin; titer; uncertainty
R97
A
1008-1151(2022)08-0094-04
2022-06-17
謝鵬(1990-),女(瑤族),廣西壯族自治區食品藥品檢驗所主管藥師,碩士,研究方向為藥品檢驗檢測。
林昊(1981-),男,廣西壯族自治區食品藥品檢驗所主管藥師,研究方向為藥品檢驗檢測。

