響應面法優化刺葡萄果實花旗松素提取工藝
牛生洋,王鳳軒,張曉利,余林玉,宋姣姣,姜建福
(1.河南科技學院食品學院,河南新鄉 453003;2.中國農業科學院鄭州果樹研究所,河南鄭州 450009)
花旗松素,又稱二氫槲皮素,分子式為CHO,其主要來源于紫衫、黃衫、落葉松等針葉植物根部。花旗松素是一種天然抗氧化劑,能夠保護人體免受黑色素、輻射等有毒害物質的侵害,是多種名貴中草藥的主要藥效成分,可作為生產醫藥保健品和食品的珍貴原料。2017 年,歐盟食品安全局(EFSA)已正式公布落葉松提取物(花旗松素)為新資源食品,評估認為其不會引發安全風險,也無遺傳毒性風險。然而提取花旗松素的材料主要在紫杉、黃杉、等珍稀樹種及落葉松,目前還沒有其他材料可替代,全球尚生產總量不足20 t。
刺葡萄(Foex)又名千斤藤、山葡萄,屬于東亞特有的變種葡萄,因其具有果實大、抗性強、富含花色苷等酚類物質的特點,廣泛應用于釀酒產業中。刺葡萄主要分布于湘西地區,生長于高溫高濕的陰濕地帶,具有育種、入藥、釀酒、生食等多種用途,極具開發利用價值。近年來,研究發現葡萄中含有豐富的花旗松素,而刺葡萄是原產我國的野生葡萄資源,目前還未見有從刺葡萄提取花旗松素的報道,從刺葡萄中提取花旗松素將為刺葡萄開發利用增加新的途徑。
有關花旗松素的提取已有較多的方法,如沸水熱提取法、利用微波輔助提取、利用復合酶法提取分離等。但這些方法存在或多或少的問題,如微波輔助提取和沸水熱提取法提取率低且容易造成花旗松素損失,復合酶法操作復雜且成本較高。超聲輔助提取因其操作簡單,成本低廉,綠色環保等優點,被廣泛應用于酚類物質的提取。本研究通過HPLCMS/MS 分析技術對刺葡萄果實不同部位花旗松素的含量進行測定,并對其超聲輔助的提取工藝進行優化,以期為刺葡萄的開發及其深加工提供理論依據。
1 材料與方法
1.1 材料與儀器
刺葡萄 采于中國農業科學院鄭州果樹研究所國家種質葡萄資源圃。根據往年調查采收期,在葡萄果實采收期內監測果實可溶性固形物的變化,直至其穩定,種子顏色完全變褐時開始進行果實采樣。每個品種選取長勢相似,產量相當的3 株樹,從3 棵樹上各選擇位置一致的一個果穗,隨機取30 粒果粒,為一個重復,共3 組重復。花旗松素標準品(純度≥98%,色譜純)、甲醇、無水乙醇、甲基腈、甲酸等均為色譜純 美國Sigma 公司。
LC-MS1000 高效液相色譜—串聯質譜儀 惠州藍超科技有限公司;AR1140 分析天平 深圳市時代之峰科技有限公司;H2100R 高速冷凍離心機 長沙湘儀離心機有限公司;E-52AA 旋轉蒸發儀 上海亞榮生化儀器廠;BZM-160 中草藥粉碎機 河北本辰科技有限公司;超聲波振蕩儀 深圳市科工達超聲設備有限公司;UV-1800G 紫外可見分光光度計 上海美譜達公司。
1.2 實驗方法
1.2.1 刺葡萄果實不同組織中花旗松素的含量測定
1.2.1.1 刺葡萄果實花旗松素提取 提取方法參考文獻[26]進行實驗。采集成熟期刺葡萄,用蒸餾水清洗后分離果皮、果肉、種子三個部分,加液氮粉碎后,分別稱取各部分樣品5.00 g,加10 倍體積的50%乙醇溶液于30 ℃浸泡1 h,之后在100 W 的超聲波作用下處理0.5 h,然后在50 ℃下回流提取2 h,用乙醇溶液多次洗滌過濾后稀釋至20 倍定容在容量瓶中,過0.22 μm 濾膜后進行質譜檢測。
1.2.1.2 刺葡萄果實花旗松素色譜檢測分析 刺葡萄果實不同部位花旗松素含量檢測采用HPLC-MS/MS 技術。檢測電位設為正0.7 V,充裝氣體為高純氮氣。流動相A、B、C 分別設定為甲基腈、甲醇、1%甲酸溶液。色譜柱為ZORBAX SB-C小柱(2.1 mm×100 mm×1.8 μm)。霧化氣體壓力40 psi,氣體環境溫度350 ℃,使用之前必須用孔徑為0.4 μm的纖維混合微孔膜過濾流動相,梯度洗脫條件為0 min,10% A,90% B;30 min,15% A,85% B;100 min,30% A,70% B。在280 nm 的紫外檢測波長條件下檢測流動相B、C(即甲醇、1%甲酸溶液),實驗樣品以最后一次抽濾所得液體為主。色譜柱的電位溫度30 ℃、樣品進樣量10 μL、樣品流速0.7 mL/min,改變甲醇、1%甲酸溶液的體積分數并進行梯度洗脫。檢測方式采用電噴霧電離(electrospray ionization,ESI)正離子模式。定量檢測為多反應檢測(multi reaction montior,MRM),數據收集為MassHunter 工作平臺(Agilent,USA)。
1.2.2 花旗松素提取工藝優化
1.2.2.1 單因素實驗設計 根據質譜檢測結果,取刺葡萄果實中花旗松素含量最高的部位進行花旗松素提取。提取條件為固定浸泡時間1 h、超聲功率100 W、液料比20:1、超聲時間0.5 h、回流提取時間2 h,分別考察液料比(5:1、10:1、15:1、20:1、25:1、30:1 mL/g),乙醇濃度(30%、40%、50%、60%、70%),提取時間(1、2、3、4、5 h),提取溫度(30、40、50、60、70 ℃)4 個單因素對花旗松素提取量的影響。
1.2.2.2 響應面試驗設計 根據單因素實驗,主要考察乙醇溶液濃度、提取時間、提取溫度(表1)在花旗松素含量提取過程中三者之間的相互關系。設定響應面為花旗松素提取量,選取乙醇濃度、提取溫度、提取時間為自變量。用乙醇濃度、溫度和提取時間三因素做花旗松素的函數。最后,回歸分析試驗結果的二次響應面。三個影響因素與花旗松素提取量之間以及不同影響因素之間的關系用多元線性回歸方程表示,結果用圖表直觀顯示。

表1 響應面試驗設計Table 1 Response surface experimental design
1.2.2.3 花旗松素提取量的測定 確定用于優化提取工藝的刺葡萄果實部位后,利用前述方法將花旗松素提取物用甲醇稀釋10 倍,用紫外可見分光光度計在288 nm 處測定其吸光值,并用花旗松素標樣做標準曲線,然后依據公式(1)進行花旗松素提取量計算:

式中:W 表示花旗松素提取量,mg/g;c 表示根據吸光度值計算出的溶液質量濃度,μg/mL;D 表示溶液稀釋倍數;V 表示供試品溶液體積,mL;m 表示取樣量,g。
1.3 數據處理
所有試驗均進行三次重復試驗。數據采用Designexpert8.06 統計軟件進行分析。不同處理間的數據采用SPSS17.0 軟件中多重比較方法。
2 結果與分析
2.1 刺葡萄果實不同組織中花旗松素含量測定
根據花旗松素標樣質譜條件,將刺葡萄果皮、種子及果肉中花旗松素提取物經過HPLC-MS/MS 檢測(圖1),結果表明刺葡萄果皮中的花旗松素含量為3.63±0.18 mg/kg,顯著高于果肉(0.35±0.02 mg/kg)、種子(1.74±0.13 mg/kg)中的花旗松素含量(圖2)(<0.05),說明刺葡萄果實中的花旗松素主要存在于果皮中,這是因為果肉中營養物質多以水分及糖酸組分為主,這從圖2 色譜圖中果肉(C)出峰明顯果皮(B)和種子(D)少也能看出,而酚類物質多存在于果皮及種子中,與其他酚類物質在葡萄果實中的分布規律一致。由于刺葡萄果皮中花旗松素含量最高,后續取刺葡萄果皮進行花旗松素提取工藝優化。由于考慮到質譜檢測不僅成本高,而且耗時長,同時對比發現用分光光度計測量的刺葡萄果實提取物花旗松素含量與HPLC-MS/MS 檢測結果并無明顯差異,因此選用分光光度法進行優化提取工藝時花旗松素含量的測定。
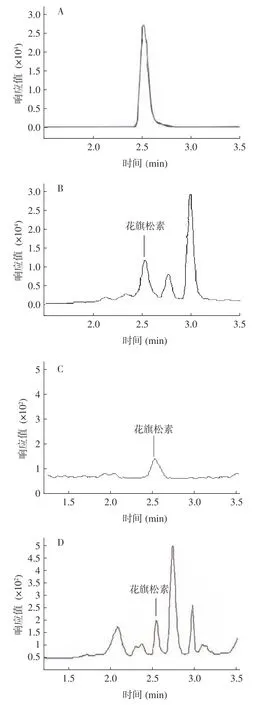
圖1 花旗松素標樣及果實不同部位樣品HPLC-MS/MS 色譜圖Fig.1 HPLC-MS/MS analysis of taxifolin standard and different parts of fruit

圖2 刺葡萄果實不同組織中花旗松素的含量Fig.2 Content of taxifolin in different tissues of Vitis davidii
2.2 花旗松素提取工藝優化
2.2.1 單因素結果
2.2.1.1 花旗松素提取過程中液料比的影響 當其他的試驗條件不變的情況下,增加刺葡萄果皮提取物用量能保證花旗松素的濃度處于高值,增加其提取量。如圖3 所示,花旗松素提取量隨著液料比增大而顯著增加(<0.05)。提取量在液料比為20:1 mL/g時,花旗松素提取量的相對濃度達到峰值時,之后繼續提升液料比的提取量也幾乎不會再有增加。由此可以得到提取刺葡萄中花旗松素的最佳液料比是20:1 mL/g。另外,根據文獻結果,在提取工藝優化時,液料比基本都是20:1 mL/g,因此對液料比不再進行響應面優化。

圖3 花旗松素提取過程中液料比的影響Fig.3 Influence of extraction temperature during the extraction oftaxifolin
2.2.1.2 花旗松素提取過程中時間的影響 隨著提取時間增加花旗松素提取量也隨之增大,尤其是在1~2 h 之間,隨提取時間的延長,刺葡萄中花旗松素提取量增幅明顯增大(圖4);而超過4 h 之后,花旗松素的提取量基本不變,說明此時乙醇溶解花旗松素的量到達飽和,因此選取花旗松素的提取時間為4 h。

圖4 花旗松素提取過程中提取時間的影響Fig.4 Influence of extraction time in the extraction process of taxifolin
2.2.1.3 花旗松素提取過程中溫度的影響 從圖5可知,在其他的試驗條件不變的情況下,花旗松素的提取量隨溫度升高而增大,而在50 ℃之后,溫度的升高花旗松素的提取量并無顯著影響,說明此時乙醇溶解花旗松素的能力達到最大,而且過高的溫度也會使得花旗松素穩定性降低,由此確定最佳提取溫度是50 ℃。

圖5 花旗松素提取過程中提取溫度的影響Fig.5 Influence of extraction temperature during the extraction of taxifolin
2.2.1.4 花旗松素提取過程中乙醇濃度的影響 由圖6 可知,花旗松素的提取量隨乙醇濃度的增加而增大,當乙醇濃度達到50%時,對刺葡萄果皮中花旗松素的提取效率最好,此時花旗松素的提取量為3.47 mg/kg;當乙醇濃度超過50%后,花旗松素提取量隨著乙醇濃度增加而呈現緩慢增加的趨勢。這是因為花旗松素是多羥基化合物,其極性比無水乙醇強比水,由于相似相溶原理,隨著乙醇濃度的增加,對花旗松素的溶解能力也增加,而花旗松素的極性與50%的乙醇溶液的極性相似,因此使用50%的乙醇溶液能最大限度提取葡萄皮渣中的花旗松素,因此花旗松素提取時的乙醇濃度為50%。

圖6 花旗松素提取過程中乙醇濃度的影響Fig.6 Influence of ethanol concentration during the extraction of taxifolin
2.2.2 響應面試驗結果
2.2.2.1 模型建立 采用BBD 設計方法,以乙醇濃度(A)、提取時間(B)、提取溫度(C)三個因素為自變量,花旗松素提取量為響應值R,進行響應面分析,試驗結果見表2。結果經Design Expert 8.0.6 軟件進行多元回歸擬合分析,得到花旗松素提取量為響應值的函數二次回歸方程:

表2 響應面試驗設計結果Table 2 Response surface test design results

2.2.2.2 方差分析 方差分析表明(表3)所得模型極顯著(=151.86,<0.0001),且方程的失擬誤差不顯著(=2.45,>0.5),表明該模型回歸極為顯著,說明響應面所得的結果是可靠的。比較各個因素值可以看出,其對于花旗松素提取量的影響順序為A>B>C。提取時間(B)與乙醇濃度(A)對花旗松素提取量影響顯著(<0.05),提取溫度(C)對花旗松素提取量影響不顯著;提取時間、乙醇濃度與提取溫度之間相互作用對花旗松素提取量影響均不顯著,但平方項均達到極顯著水平(<0.01)。
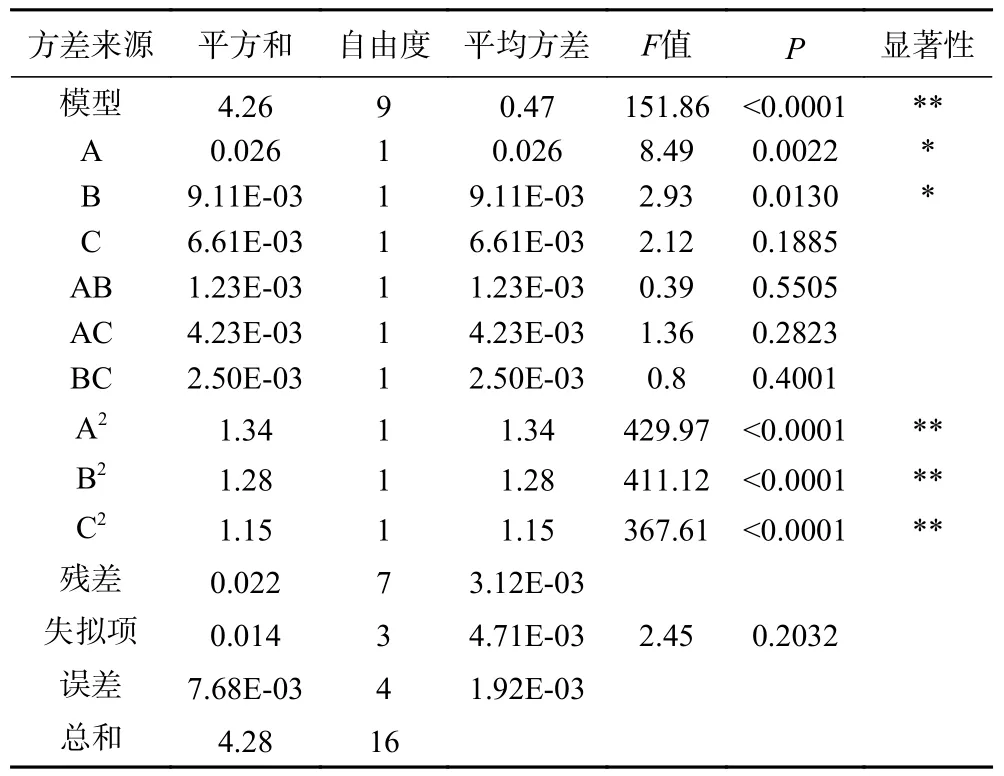
表3 回歸模型方差分析Table 3 Regression model analysis of variance
2.2.2.3 響應面分析 響應面的坡度越陡峭則響應值對因素的改變越敏感。等高線是表示兩個因素的交互規律,等高線密集的地方表示二者主要共同作用的方向。應用Design-Expert.8.0.6 軟件對試驗結果進行分析,得到花旗松素提取量與提取溫度、提取時間、乙醇濃度等之間交互作用的三維效應曲面圖。由圖7 所示,乙醇濃度和提取時間、乙醇濃度和提取溫度、提取時間和提取溫度表現為響應面曲線陡峭,說明二者相互作用對花旗松素的提取量均有一定影響。
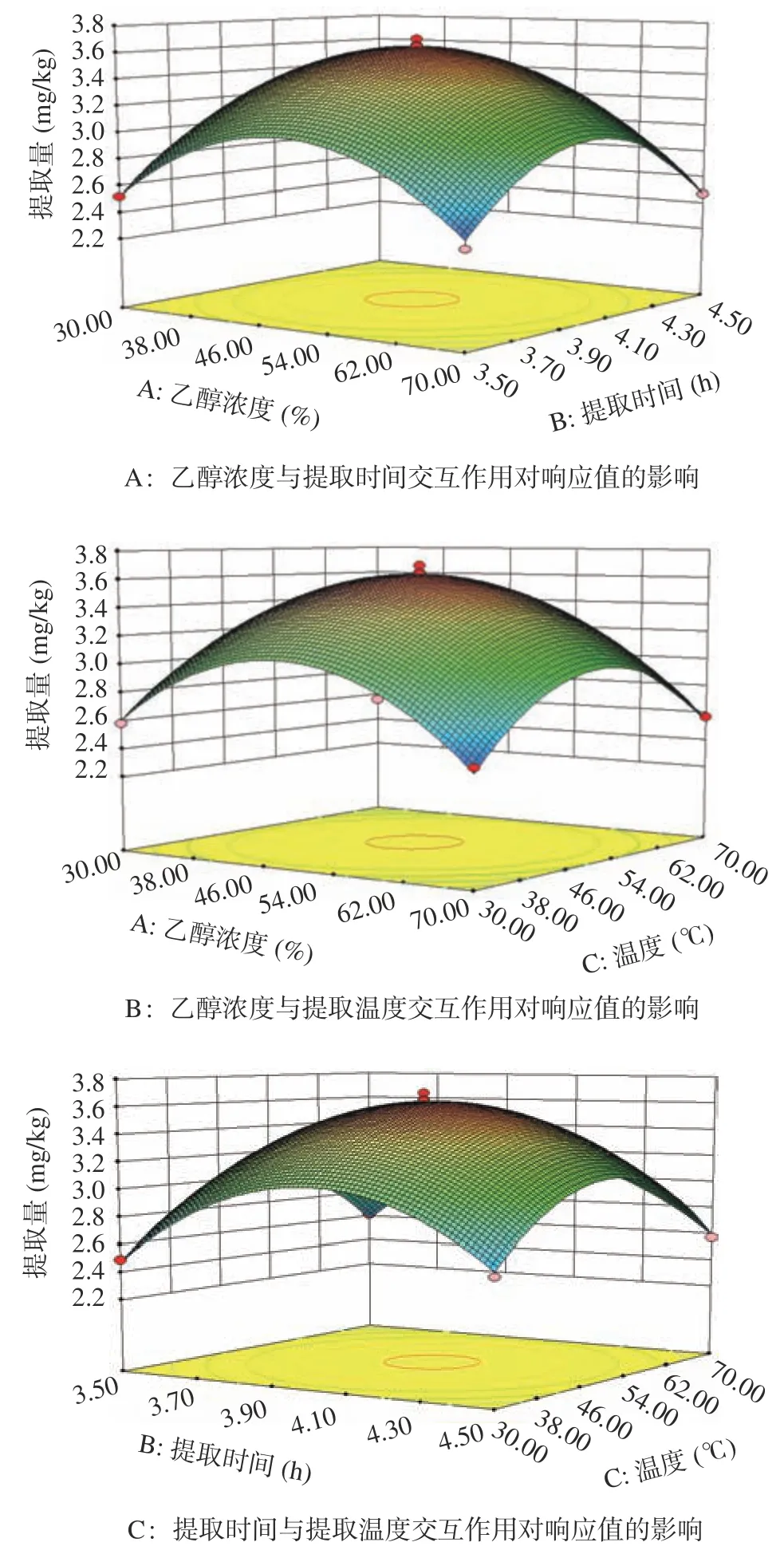
圖7 響應面分析三維效應曲面圖Fig.7 Response surface analysis 3D effect surface diagram
2.2.3 優化提取參數與試驗驗證 通過建立的數學模型分析,可預測得到葡萄果皮花旗松素提取量的最佳提取條件為:乙醇含量48.97%、浸泡溫度30 ℃、浸泡時間1 h、超聲功率100 W、超聲時間0.5 h、提取時間4.02 h、提取溫度50.51℃,在此條件下花旗松素理論提取量為3.630 mg/kg。考慮實際操作因素,因此對花旗松素提取工藝的最佳條件進行簡化;即簡化工藝條件為:乙醇含量49%、浸泡溫度30 ℃、浸泡時間1 h、超聲功率100 W、超聲時間0.5 h、提取時間4 h、提取溫度51 ℃,重復三次實驗,此時花旗松素的提取量為(3.587±0.021)mg/kg,與理論值誤差為1.18%,這與已有研究結果類似,說明該模型真實可靠,可以較準確的優化花旗松素提取工藝。
3 結論
本研究在前期研究的基礎上,以刺葡萄果實為原料,通過HPLC-MS/MS 檢測其不同組織中花旗松素含量,結果表明刺葡萄果皮中的花旗松素含量為3.63 mg/kg,顯著高于種子(1.74 mg/kg)及果肉(0.35 mg/kg)(<0.05),因此選用刺葡萄果皮作為優化花旗松素提取工藝的原料。利用超聲波輔助提取刺葡萄果皮花旗松素,并通過單因素實驗和響應面試驗進行的提取工藝優化,結果表明在固定浸泡溫度30 ℃、浸泡時間1 h、液料比20:1 mg/L 的條件下,通過優化乙醇含量49%、提取時間4 h、提取溫度51 ℃時花旗松素的提取量達到3.587 mg/kg,說明花旗松素提取可以在常規條件下進行,為花旗松素的工業化制備提供了依據。

