南瓜皮多糖鋅的制備及生物利用率研究
董淑君,張禧慶,劉旭龍,馬越 ,鄭振佳,姜高飛
(1.北京市農林科學院農產品加工與食品營養研究所,果蔬農產品保鮮與加工北京市重點實驗室,農業農村部蔬菜采后處理重點實驗室,北京 100097;2.山東農業大學食品科學與工程學院,山東省高校食品加工技術與質量控制重點實驗室,山東泰安 271018;3.山東杰諾檢測服務有限公司,山東煙臺 265200;4.萊陽孟宇食品有限公司,山東煙臺 265200)
多糖是南瓜中的重要活性物質,含量約為5.7%,具有抗氧化、降血糖、降血脂、抑菌、抗腫瘤等多種生物活性。南瓜皮是南瓜加工過程中的副產品,加工過程中產生量約占南瓜總質量的10%~40%,通常當作廢棄物處理。從南瓜皮中提取南瓜皮多糖可以提高南瓜資源的綜合利用,增加南瓜的附加值。南瓜皮多糖屬于酸性多糖,糖鏈中含有羧基、羥基等配位基團,具有表面螯合能力,能與金屬離子以配位鍵結合生成螯合物。目前對南瓜多糖的研究主要集中在提取、結構解析、改性修飾以及活性評價,其中改性修飾主要包括南瓜多糖的硫酸酯化、磷酸酯化和硒化修飾。
鋅是人體必需的微量元素之一,能夠提高機體免疫力,具有促進生長發育、殺菌抗炎、抗氧化、提高大腦功能、參與酶調節和基因表達等多種生理功能。人體對鋅的儲存能力不高,需要從外界獲取以穩定體內環境。無機鋅在人體中的吸收利用率低且對腸胃具有刺激作用,因此開發高利用率、低刺激性的新型鋅補充劑尤為重要。將多糖與鋅進行螯合得到多糖鋅,可解決無機鋅與食物中的植酸、草酸等化合物結合生成沉淀的問題,且利用率高、穩定性好,具有腸道益生作用,在攝入益生元的同時實現補鋅目的。現報道的多糖鋅研究主要集中在工藝優化及其活性評價,涉及的多糖來源主要包括大米胚芽、金針菇、孔石莼、灰樹花、光帽鱗傘菌絲體、肉蓯蓉、豬苓和蛹蟲草基質,對南瓜皮多糖與鋅的螯合工藝及生物利用率研究尚未見報道。
本研究以南瓜皮為原料提取多糖,利用金屬螯合法制備南瓜皮多糖鋅,采用響應面法優化制備工藝,并研究產物的生物利用率,開發具有腸道益生作用的新型補鋅劑,減少南瓜資源的浪費,提高南瓜皮的附加值。
1 材料與方法
1.1 材料與儀器
南瓜皮 品種為愛碧斯,山東省萊陽市孟宇食品有限公司;七水合硫酸鋅 分析純,天津市凱通化學試劑有限公司;鋅標準儲備液(1000 μg/mL)國家檢驗認證有限公司;鹽酸(優級純)、氫氧化鈉(分析純)天津市科密歐化學試劑有限公司;硝酸 優級純,蘇州晶瑞化學股份有限公司;人工胃液、人工腸液 福州飛凈生物科技有限公司;透析袋 怡康科貿生物試劑耗材實驗有限公司。
7800 電感耦合等離子體質譜儀(ICP-MS)美國安捷倫科技公司;SECURA224-ICN 電子天平北京賽多利斯儀器有限公司;S210 pH 計 梅特勒-托利多儀器有限公司;Multiwave PRO 微波消解儀奧利地安東帕公司;DKZ-2B 水浴恒溫振蕩器 上海一恒科技儀器有限公司;FD-304 冷凍干燥機 濟南駿德儀器有限公司。
1.2 實驗方法
1.2.1 南瓜皮多糖的提取 采用熱水浸提法從南瓜皮中提取多糖。取1 kg 鮮南瓜皮切碎,以1:12 的料液比加入去離子水,85 ℃的熱水浸提兩次,過濾,濾液濃縮后用4 倍體積的無水乙醇醇沉,靜置,5000 r/min 離心10 min 得南瓜皮粗多糖。Sevag 溶液(氯仿:正丁醇=4:1)脫蛋白,重復操作3~4 次至中間無變形蛋白層,濃縮后醇沉,5000 r/min 離心10 min,凍干得到南瓜皮多糖。苯酚-硫酸法測定多糖含量為74.78%。
1.2.2 南瓜皮多糖鋅的制備工藝 采用硫酸鋅法制備多糖鋅。稱取一定質量的南瓜皮多糖溶于去離子水中,與一定濃度的鋅溶液等體積混合,設計不同的反應質量比、反應時間、反應溫度和反應pH 后于恒溫水浴振蕩反應,反應結束用4 倍體積的無水乙醇進行醇沉,5000 r/min 離心10 min,上清液保存備用,將沉淀復溶后用500 Da 的透析袋透析48 h,冷凍干燥得到南瓜皮多糖鋅。
1.2.3 單因素實驗
1.2.3.1 南瓜皮多糖與鋅質量比對螯合率的影響固定鋅的濃度為0.4 g/L,南瓜皮多糖與鋅質量比分別為1:1、5:1、10:1、20:1、30:1、40:1,反應時間為100 min,反應溫度為50 ℃,反應pH7,按“1.2.2”進行操作,考察多糖與鋅的質量比對螯合率的影響。
1.2.3.2 反應時間對螯合率的影響 固定鋅的濃度為0.4 g/L,南瓜皮多糖與鋅質量比為5:1,反應pH7,反應溫度為50 ℃,反應時間分別為50、100、150、200、250 min,按“1.2.2”進行操作,考察反應時間對螯合率的影響。
1.2.3.3 反應溫度對螯合率的影響 固定鋅的濃度為0.4 g/L,南瓜皮多糖與鋅質量比為5:1,反應時間為100 min,反應pH7,反應溫度分別為30、40、50、60、70 ℃,按“1.2.2”進行操作,考察反應溫度對螯合率的影響。
1.2.3.4 反應pH 對螯合率的影響 固定鋅的濃度為0.4 g/L,南瓜皮多糖與鋅質量比為5:1,反應溫度為50 ℃,反應時間為100 min,反應pH 分別為5、6、7、8、9、10、11,按“1.2.2”進行操作,考察反應pH 對螯合率的影響。
1.2.4 響應面試驗 在單因素實驗的基礎上,以南瓜皮多糖螯合鋅的螯合率為響應值,以南瓜皮多糖與鋅質量比、反應時間、反應pH 為自變量,進行三因素三水平響應面試驗。采用Design-Expert 8.0.6 統計分析軟件建立Box-Behnken 模型,對螯合反應進行響應面優化設計。響應面試驗設計因素與水平見表1。
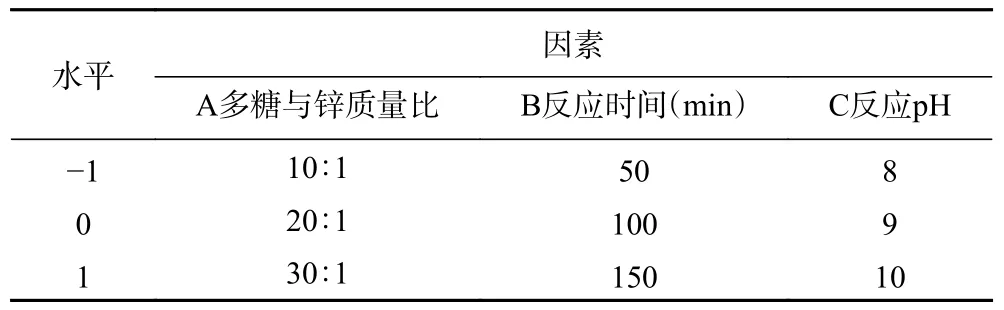
表1 響應面試驗因素與水平Table 1 Factors and levels of response surface experiment
1.2.5 南瓜皮多糖鋅中鋅元素的測定
1.2.5.1 鋅標曲的繪制 利用鋅標準溶液配制成濃度分別為0、0.1、0.2、0.4、0.6、0.8、1.0 μg/mL 的鋅溶液。電感耦合等離子體質譜儀(ICP-MS)測定,以鋅元素的濃度(X,μg/mL)為橫坐標,響應信號值(Y)為縱坐標,繪制標準曲線。測得標準曲線方程為Y=0.989X+0.0072,R=0.9998。
ICP-MS 相關參數如下:射頻功率1550 W,等離子體氣體流速15 L/min,輔助氣體流速0.9 L/min,蠕動泵轉速0.1 rps,霧化室溫度2 ℃,采樣深度8 mm。
1.2.5.2 螯合率的計算 采用2%的硝酸稀釋上清液,ICP-MS 測定鋅離子的含量,按照下式計算南瓜皮多糖鋅的螯合率:
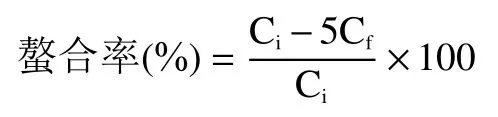
式中:C表示混合液中鋅離子的初始濃度,μg/mL;C表示反應后上清液中鋅離子的濃度,μg/mL。
1.2.5.3 鋅含量的測定 稱取南瓜皮多糖鋅0.02 g,按照表2 設定的升溫程序消解樣品,消解后冷卻至室溫將樣品轉移至50 mL 容量瓶,去離子水定容,保存備用,ICP-MS 測定鋅含量。

表2 微波消解升溫程序Table 2 Temperature rise procedure of microwave digestion
1.2.6 南瓜皮多糖鋅的生物利用率 參照文獻[32?34]方法并稍作修改,通過體外模擬胃腸道消化法對螯合物南瓜皮多糖鋅的生物利用率進行評價。
1.2.6.1 模擬胃液消化 分別配制5 mg/mL 的南瓜皮多糖鋅和8.9 mg/mL 七水合硫酸鋅溶液,添加1 mol/L 的HCl 使pH 達到2.0 左右,加入等體積的模擬人工胃液,混合均勻,37 ℃振蕩,分別反應0、30、60、90、120、150、180、210、240 min 后,在95 ℃水浴中滅酶處理10 min,于4 ℃條件下保存,備用。
1.2.6.2 模擬腸液消化 分別將“1.2.6.1”中模擬胃消化120 min 的樣品混合物和無機鋅混合物取出,用1 mol/L 的NaOH 調節pH 至7.0,加入等體積的模擬人工腸液,混合均勻,將混合物轉移到透析袋中,37 ℃振蕩,分別反應1、2、4、6、8 h 后,在95 ℃水浴中滅酶處理10 min,于4 ℃條件下保存,備用。
1.2.6.3 溶解率的測定 分別取胃液、腸液的消化液來測定南瓜皮多糖鋅的溶解率。在“1.2.6.1”和“1.2.6.2”的消化液中加入4 倍體積的無水乙醇進行醇沉,5000 r/min 離心10 min 后取上清液,ICPMS 測定鋅含量,按照下式計算溶解率:

式中:C表示反應后上清液中鋅離子的濃度,μg/mL;F 表示樣品中鋅的含量,μg/mL。
1.2.6.4 透析率的測定 在腸液消化的過程中,按照1、2、4、6、8 h 時間段依次取樣,ICP-MS 測定,按照下式計算鋅離子的透析率:

式中:E 表示透析液中鋅的濃度,μg/mL;V 表示透析液的體積,mL;F 表示樣品中鋅的含量,μg/g;M 表示樣品的質量,g。
1.3 數據處理
每組試驗均重復3 次,利用Design Expert 8.0.6進行數據統計分析;采用Origin 2017 軟件繪圖。
2 結果與分析
2.1 單因素實驗結果
2.1.1 南瓜皮多糖與鋅質量比對螯合能力的影響由圖1 可知,隨著多糖與鋅質量比的增加,螯合能力不斷上升。當質量比超過20:1 后,螯合率的增勢趨于平緩,可達到98%左右,原因可能是隨多糖比例的增加,為Zn提供了足夠的結合位點,螯合率逐漸上升。隨著多糖濃度的提高,體系粘度增加,不利于結合位點的暴露,螯合率下降。

圖1 質量比對螯合率的影響(n=3)Fig.1 Effect of the mass ratio on the chelation rate (n=3)
2.1.2 反應時間對螯合能力的影響 由圖2 可知,隨著反應時間的增加,螯合率逐漸增加,當反應時間為100 min 時達到最大值79.28%,之后螯合率迅速下降。這可能是因為隨著反應時間的延長,體系穩定性下降,導致部分螯合物出現了解離的現象。
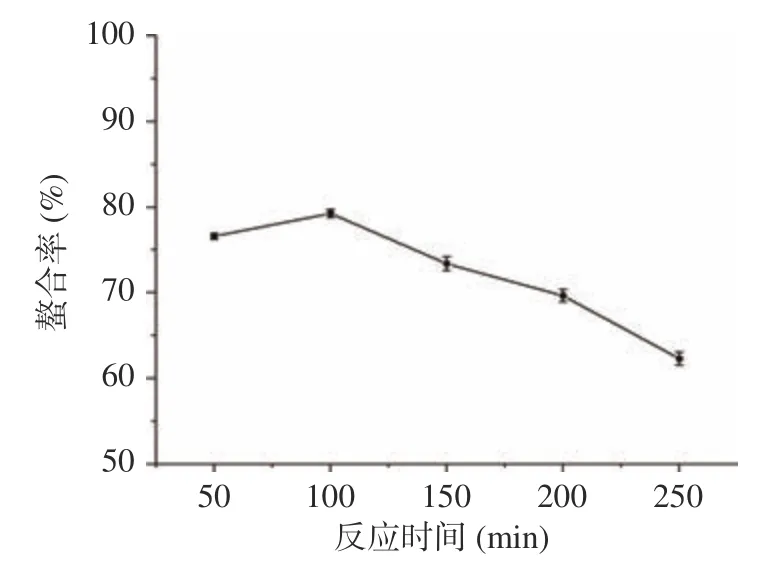
圖2 反應時間對螯合率的影響(n=3)Fig.2 Effect of the reaction time on the chelation rate (n=3)
2.1.3 反應溫度對螯合能力的影響 由圖3 可知,反應溫度對螯合率的影響較小。隨著溫度的升高,螯合率逐漸上升,當反應溫度為60 ℃時,螯合率達到最大值79%。當反應溫度超過60 ℃以后螯合率開始下降。推測因為溫度的升高會促進分子的運動,雖然有利于結合位點的暴露,但是溫度過高時,解離速度高于螯合速度,不利于多糖與Zn的螯合。結果顯示,溫度對螯合率的影響較小,因此可作為次要考慮因素,不作為響應面優化參數。

圖3 反應溫度對螯合率的影響(n=3)Fig.3 Effect of the reaction temperature on the chelation rate (n=3)
2.1.4 反應pH 對螯合能力的影響 由圖4 可知,隨著pH 的增加,螯合率不斷上升。當pH 為9 時達到最大值99.4%,之后螯合率開始下降。推測因在偏酸性條件下,Zn與多糖解析速度高于螯合速度;隨著pH 的增加,螯合率提高;pH 超過11 后反應體系有略渾濁現象,可能因為部分Zn會和OH生成沉淀,導致Zn損失。
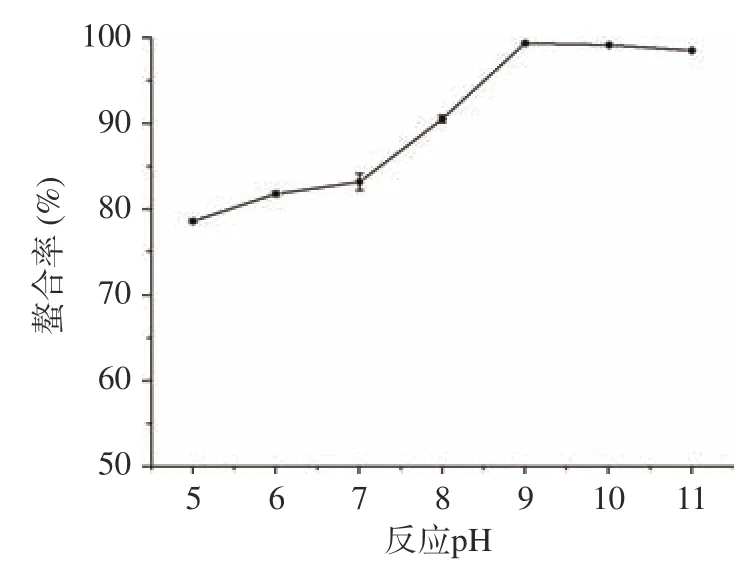
圖4 反應pH 對螯合率的影響(n=3)Fig.4 Effect of the reaction pH on the chelation rate (n=3)
2.2 響應面試驗結果
2.2.1 響應模型的建立與分析 采用Design Expert 8.0.6 軟件對數據進行回歸分析,得到螯合率(Y)對南瓜皮多糖與鋅質量比(A)、反應時間(B)和反應pH(C)的三元二次回歸方程為Y=99.49?0.46A+0.13B+0.18C+0.078AB?0.2AC+0.19BC?1.31A?0.77B?1.39C。響應面試驗結果見表3,方差分析結果見表4。
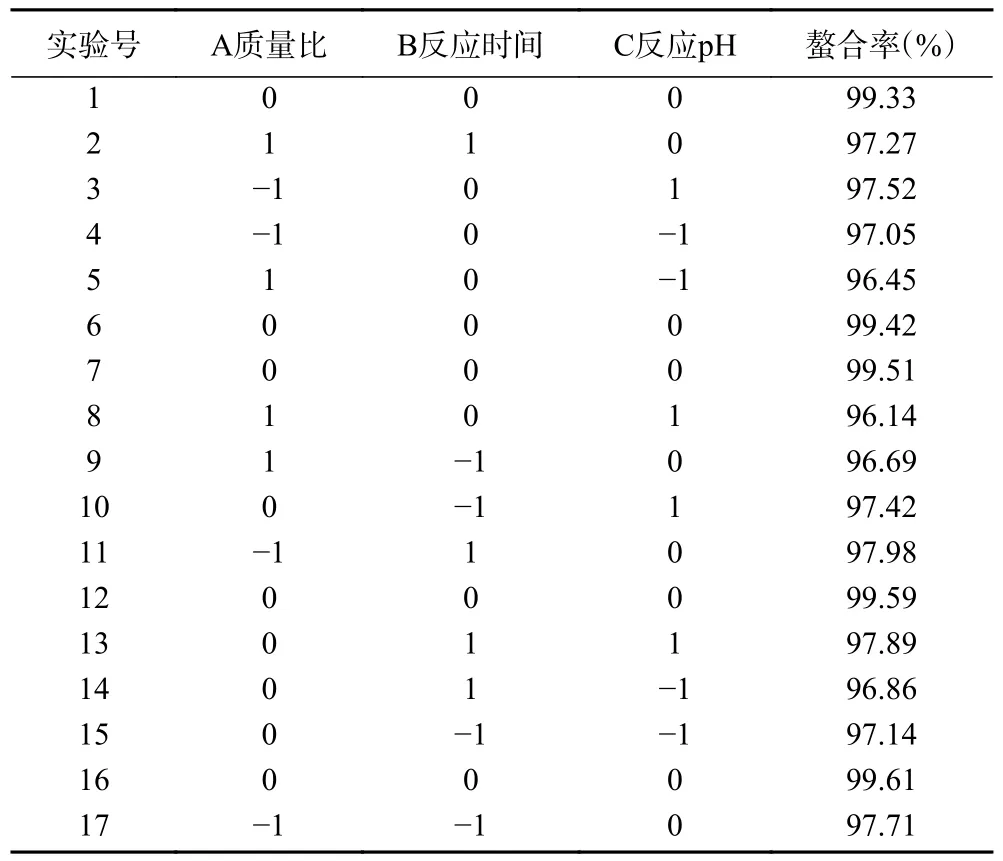
表3 響應面試驗結果Table 3 Response surface test results
由表4 可知,該模型差異性顯著(<0.0001),失擬項不顯著(>0.05),說明此模型的擬合度較好;決定系數為0.9875,說明螯合率的試驗值和模擬回歸值具有很好的一致性;校正后決定系數為0.9713,說明該回歸方程可信度較高,能夠反應97.13%的響應值變化。因此該模型的可信度和擬合度均較高,可以利用該模型對南瓜皮多糖鋅的螯合能力進行預測和分析。

表4 回歸模型方差分析Table 4 Analysis of variance of regression model
回歸模擬一次項A,二次項A、B、C對螯合作用影響顯著(<0.0001),一次項C 對螯合作用影響顯著(<0.05),一次項B,交互項AB、AC 和BC對螯合率的影響不顯著,可將其從回歸模型中刪除。最終確定回歸模型為Y=99.49?0.46A+0.18C?1.31A?0.77B?1.39C。因此,各因素對響應面的影響并不是簡單的線性關系,值可以反映出各個因素對螯合率的影響程度。本試驗中螯合率的影響因素排序為多糖與鋅質量比>反應pH>反應時間。
2.2.2 響應面圖分析 響應曲面圖可以形象地描述各因素之間的交互作用,各因素交互作用對螯合率的影響見圖5。圖5A 為固定反應pH 的編碼水平為零,考察南瓜皮多糖與鋅質量比和反應時間的交互作用對螯合率的影響。此條件下,等高線形狀呈圓形,等高線稀疏,說明反應質量比和反應時間的交互作用對螯合率的影響較弱。當反應質量比達到最優時,隨著反應時間的增加,螯合率趨于穩定。當反應時間達到最優時,螯合率隨著反應質量比的增加呈現出先上升后下降的趨勢,說明反應質量比對螯合率的影響大于反應時間。圖5B 為固定反應時間的編碼水平為零,考察南瓜皮多糖與鋅質量比和反應pH 的交互作用對螯合率的影響。對應的等高線形狀呈橢圓形,三維圖傾斜面大,說明兩者的交互作用對螯合率影響較大。隨著反應質量比和反應pH 的增加,螯合率逐漸上升,當反應質量比超過20:1,反應pH 超過9 后,螯合率開始下降。圖5C 為固定南瓜皮多糖與鋅質量比的編碼水平為零,考察反應時間和反應pH 交互作用對螯合率的影響。等高線形狀呈橢圓形,說明兩者的交互作用對螯合率影響較大。當反應pH 達到最優時,隨著反應時間的增加,螯合率趨于穩定。當反應時間達到最優時,螯合率隨著反應pH 的增加呈現出先上升后下降的趨勢,說明反應pH 對螯合率的影響大于反應時間。
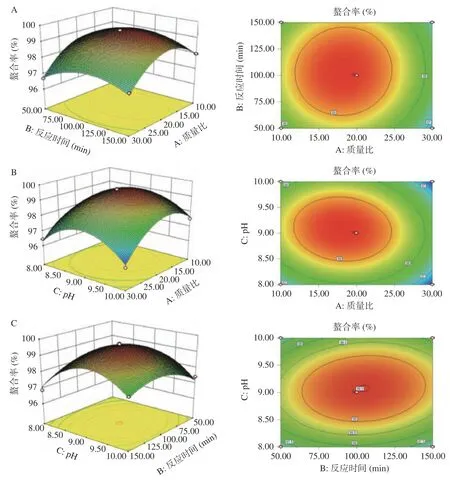
圖5 各因素交互作用對南瓜皮多糖鋅螯合能力影響的響應面圖Fig.5 Response surface diagram of the effects of each factor interaction on polysaccharide zinc chelation ability in pumpkin skin
2.2.3 回歸模型驗證 結合Design Expert 8.0.6 軟件分析可得最佳的螯合條件為:南瓜皮多糖與鋅質量比為18.19:1,反應時間為104.29 min,反應pH 為9.09 時,螯合率達到最大值為99.55%。為考慮實際生產需要,選擇以下條件進行驗證:南瓜皮多糖與鋅質量比為18:1,反應時間為104 min,反應pH 為9,在此條件下實際得到的南瓜皮多糖鋅螯合率為99.37%±0.12%,與預測值相差較小為0.18%,說明該工藝穩定可靠,可用于生產,ICP-MS 測定南瓜皮多糖鋅中鋅含量約為23.17±0.05 mg/g。
2.3 生物利用率分析
2.3.1 南瓜皮多糖鋅在胃中的釋放情況 多糖鋅的溶解率隨時間的增加呈現出上升趨勢,溶解率最高為12.76%,無機鋅在胃中的溶解率比較穩定,結果見圖6。在消化初期(0~60 min),無機鋅中鋅離子的溶解率為48.4%,多糖鋅中鋅離子的溶解率為9.22%,在消化中后期,無機鋅的溶解率為50.52%遠高于多糖鋅的溶解率12.76%,說明多糖鋅對Zn釋放效果平緩,刺激性可能小于無機鋅。這與闞文翰對螯合鋅在胃中Zn的溶解率結論相似,說明多糖鋅受胃液的酸化環境影響不大。整個消化過程中,無機鋅的溶解率維持在50%左右,推測可能是因為無機鋅與胃中的蛋白類物質結合,部分鋅以結合態存在,導致游離鋅離子濃度下降。
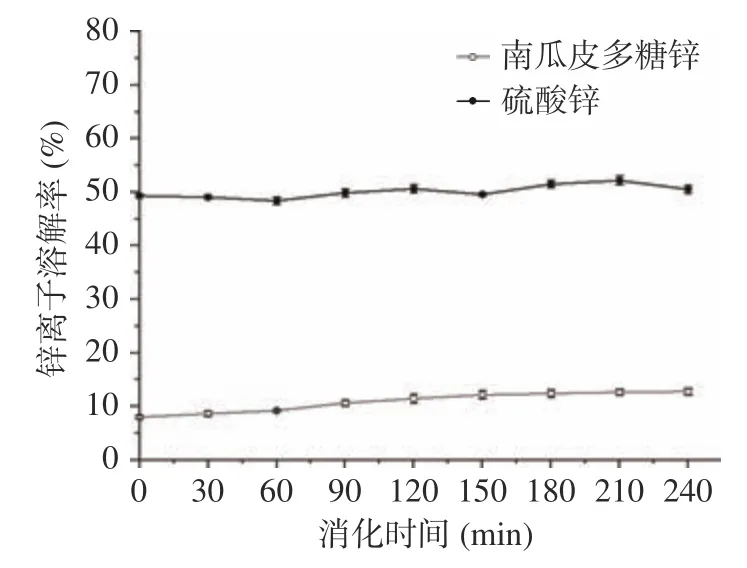
圖6 體外模擬胃腸道消化中鋅離子溶解率的比較Fig.6 Comparison of zinc release rate in simulated gastrointestinal digestion in vitro
2.3.2 南瓜皮多糖鋅在腸中的釋放情況 多糖鋅在腸中溶解率比較穩定,維持在2%左右,無機鋅在腸中的溶解率隨著時間的延長呈現出降低的趨勢,結果見圖7。在消化后期,南瓜皮多糖鋅和無機鋅的溶解率分別為2.18%和0.13%。腸液環境中無機鋅的溶解率明顯降低,推測可能是腸道的弱堿性環境使釋放出的Zn易生成沉淀,導致兩者的溶解率下降,多糖鋅中由于具有多糖的保護作用,使其在腸道中的溶解率高于無機鋅。這與柯梟等研究的螯合鋅在腸道中Zn的溶解率結論相似。

圖7 體外模擬腸道消化中鋅離子溶解率的比較Fig.7 Comparison of zinc release rate in simulated intestinal digestion in vitro
2.3.3 南瓜皮多糖鋅的透析率 多糖鋅和無機鋅在胃中的透析率均隨著時間的增加而增加,8 h 后南瓜皮多糖鋅及無機鋅的透析率分別為16.59%和0.56%,無機鋅的透析率趨于穩定,南瓜皮多糖鋅的透析率增幅較大,結果見圖8。推測可能是因為鋅的主要吸收部位在腸道,在弱堿性的環境下,釋放出的Zn容易生成Zn(OH)或者其它沉淀,無法透過透析袋;多糖環境對鋅具有一定保護作用,不容易生成沉淀,因此多糖鋅的生物利用率高于無機鋅。綜上表明,與無機鋅相比,南瓜皮多糖鋅的生物利用率和穩定性更高。
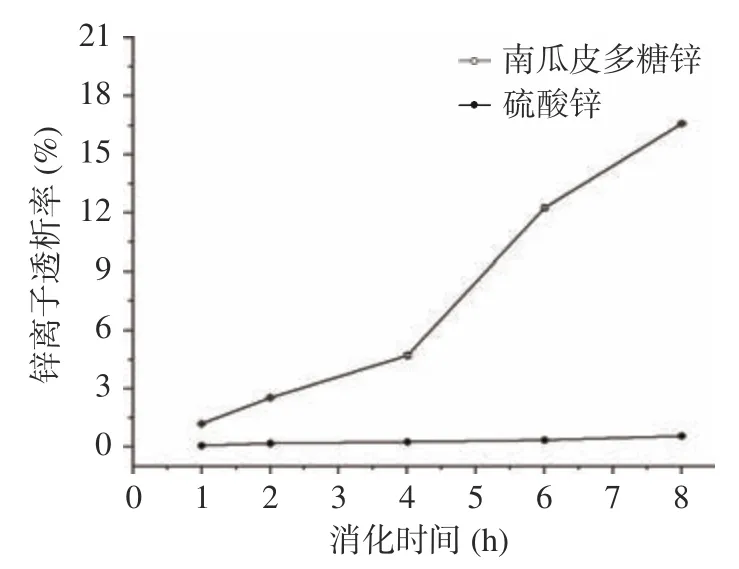
圖8 體外模擬腸道消化中鋅離子透析率的比較Fig.8 Comparison of zinc ion dialysis rate in simulated intestinal digestion in vitro
3 結論
在南瓜皮多糖鋅的制備過程中,各因素對螯合率的影響大小為:反應質量比>反應pH>反應時間。通過響應面法優化后得到最佳制備工藝為:南瓜皮多糖與鋅質量比18:1,反應時間104 min,反應pH9,此時螯合率能達到99.37%±0.12%,在此條件下制備的南瓜皮多糖鋅的鋅含量約為23.17±0.05 mg/g。體外消化模擬試驗表明:南瓜皮多糖鋅受胃的酸化環境影響較小,在胃中的溶解率較低,但在腸道中的溶解率和透析率均明顯高于無機鋅,可以證明多糖鋅具有較好的生物利用率和穩定性。本研究為開發兼具補鋅和腸道益生作用的新型補鋅劑提供了理論依據。

