鼠李糖乳桿菌和乳雙歧桿菌的復(fù)合益生菌粉對小鼠免疫功能的影響及其食用安全性的研究
趙文婷,陳智仙,張海波
(安琪紐特股份有限公司,湖北宜昌 443000)
免疫力簡言之就是身體抵抗病原微生物入侵的能力。但現(xiàn)在人們的很多生活習(xí)慣都使免疫力降低,如生活壓力變大使得人們過度緊張焦慮、長期熬夜導(dǎo)致睡眠不足、營養(yǎng)不均衡、吸煙酗酒、長期缺乏健身運(yùn)動、太愛干凈、濫用藥物等。由此可見,提升免疫力對保持身體健康至關(guān)重要。
益生菌一詞最初源于希臘語,是“有益于生命”的意思,與抗生素定義恰恰相反,抗生素的字面意思是“不利于生命”。專家將益生菌定義為“活的微生物,當(dāng)攝入足夠的數(shù)量時,對宿主能帶來健康益處”。與免疫系統(tǒng)的相互作用是益生菌的一個重要機(jī)制。人體免疫細(xì)胞的70%~80%位于胃腸道,腸道微生物在機(jī)體形成免疫能力的過程中發(fā)揮重要作用。益生菌與免疫細(xì)胞相互作用的能力,可能增強(qiáng)機(jī)體對感染的抵抗力并增加耐受性,降低潛在過敏癥狀。研究證明,鼠李糖乳桿菌LGG 的純化菌毛可以與樹突細(xì)胞上的特定基序(DC-SIGN)相互作用,以增加細(xì)胞因子如IL-12 的表達(dá);LGG 還能夠通過減少單核細(xì)胞上炎癥標(biāo)志物的表達(dá),并通過增加巨噬細(xì)胞中白細(xì)胞介素10、白細(xì)胞介素12 和腫瘤壞死因子-的產(chǎn)生來增強(qiáng)免疫應(yīng)答。此外,鼠李糖乳桿菌LGG 基因組含有一個特定的CpG 基序,命名為ID35,它可以在體外以及卵白蛋白致敏小鼠過敏模型中刺激Th 1 應(yīng)答。乳雙歧桿菌Bi-07 也被證實(shí)能夠增強(qiáng)免疫力。有研究發(fā)現(xiàn),乳雙歧桿菌Bi-07 可以通過改善單核細(xì)胞和粒細(xì)胞的吞噬活性提升老年人的免疫力,Bi-07 還可以減少腸道細(xì)菌易位的發(fā)生、降低炎癥因子的表達(dá),從而增強(qiáng)機(jī)體免疫力。但目前對鼠李糖乳桿菌和乳雙歧桿菌復(fù)合益生菌粉對小鼠免疫功能的影響及食用安全性方面的研究還較為罕見。
本文研究了鼠李糖乳桿菌和乳雙歧桿菌復(fù)合益生菌粉對免疫功能的影響及食用安全性,觀測臟器/體重比值、細(xì)胞免疫功能、體液免疫功能、單核-巨噬細(xì)胞功能、NK 細(xì)胞活性以及急性毒性、遺傳毒性和亞急性毒性等指標(biāo),為進(jìn)一步開發(fā)、應(yīng)用鼠李糖乳桿菌和乳雙歧桿菌復(fù)合益生菌粉提供一定的理論依據(jù)。
1 材料與方法
1.1 材料與儀器
SPF 級昆明種雄性小白鼠、SPF 級SD 大鼠、昆明種小鼠 西安交通大學(xué)醫(yī)學(xué)院試驗動物中心,SPF 級昆明種雄性小白鼠(質(zhì)量合格證號:6100 1700003079、61001700003097、61001700003603、61 001700003577、61001700003636)用于改善免疫力相關(guān)試驗。SPF 級SD 大鼠(質(zhì)量合格證號:6100 1700003129、61001700003149)和昆明種小鼠(質(zhì)量合格證號:61001700003144、61001700003146)用于食用安全性相關(guān)試驗,許可證號為SYXK(陜)2018-009,溫度20~25 ℃,相對濕度45%~65%;鼠李糖乳桿菌、乳雙歧桿菌復(fù)合益生菌粉 安琪酵母股份有限公司;綿羊紅細(xì)胞(SRBC)、雞紅細(xì)胞、YAC-1 細(xì)胞、鼠傷寒沙門氏菌突變型(TA97、TA98、TA100、TA102)Molecular Toxicology 公 司;甲醇、丙酮、酸性異丙醇、甲醛、乳酸鋰、硝基氯化四氮唑(INT)、吩嗪二甲酯硫酸鹽 分析純,國藥集團(tuán);青霉素、鏈霉素、氧化型輔酶 I 上海一基實(shí)業(yè)有限公司;印度墨汁、Hank’s 液、MTT、ConA、RPMI1640 培養(yǎng)液、2-ME、臺酚藍(lán)、補(bǔ)體(豚鼠血清)、Gimsa 染液 北京索萊寶科技有限公司;敵克松、1,8-二羥基蒽醌、疊氮化鈉、2-氨基芴、大鼠肝微粒體酶(S-9)、小牛血清Sigma 公司;環(huán)磷酰胺分析純,上海華聯(lián)制藥有限公司。
酶標(biāo)儀(Epoch)美國BioTek 公司;BS-420 生化分析儀 深圳邁瑞有限公司;DR-6000 紫外分光光度計 Sigma 公司;BC-2800vet 血細(xì)胞分析儀、生物顯微鏡 上海精密儀器儀表有限公司;BSA 124S電子天平 德國賽多利斯公司;BPN-150CRH(UV)細(xì)胞培養(yǎng)箱 上海一恒科學(xué)儀器有限公司;SW-CJ-2D 超凈工作臺 蘇州凈化公司。
1.2 實(shí)驗方法
1.2.1 復(fù)合益生菌粉的制備 向經(jīng)過冷凍干燥的鼠李糖乳桿菌LGG 和乳雙歧桿菌Bi-07 菌粉中,添加一定量的烘干后的食品級輔料(5%果糖、2%低聚果糖、10%麥芽糊精)后混合,得到該復(fù)合益生菌粉。1 g益生菌粉含鼠李糖乳桿菌LGG 和乳雙歧桿菌Bi-07 菌分別為4.0×10、2.0×10CFU。
1.2.2 免疫功能實(shí)驗
1.2.2.1 動物分組及處理 將200 只雄性小鼠隨機(jī)分為五大組(分8 項試驗),每組40 只,并將每大組隨機(jī)分為4 小組,每小組10 只。設(shè)置高、中、低劑量組,即1.00、0.67、0.34 g/kg BW 三個組,并設(shè)溶劑對照組(蒸餾水)。各組小鼠按劑量設(shè)計每天灌胃復(fù)合益生菌粉一次,灌胃容量均為20 mL/kg BW,連續(xù)灌胃30 d 后進(jìn)行各項免疫指標(biāo)測定,期間自由進(jìn)食進(jìn)水,本次實(shí)驗嚴(yán)格遵守動物試驗相關(guān)國標(biāo)。
1.2.2.2 淋巴器官比重測定 10 只小鼠稱重,取小鼠胸腺以及脾臟稱重。計算胸腺/體重比值及脾臟/體重比值。
1.2.2.3 DTH 測定 給復(fù)合益生菌粉第26 d,10 只小鼠腹腔注射0.2 mL 體積分?jǐn)?shù)為2%的綿陽紅細(xì)胞(SRBC)溶液,致敏動物,致敏后第4 d,每只鼠左后足跖皮下注射20 μL 體積分?jǐn)?shù)為20%的SRBC 溶液進(jìn)行攻擊。并于攻擊前和攻擊后24 h 分別測量每只鼠左后足跖同一部位厚度,同一部位測三次,取平均值。計算攻擊前、后的足跖厚度差值來表示DTH值。
1.2.2.4 ConA 誘導(dǎo)的小鼠脾淋巴細(xì)胞轉(zhuǎn)化試驗(MTT法)無菌摘取小鼠脾臟制備成單細(xì)胞懸液,按照MTT 法測定OD 值。
1.2.2.5 抗體生成細(xì)胞檢測(Jerne 改良玻片法)10 只小鼠腹腔注射0.2 mL 體積分?jǐn)?shù)為2%的SRBC溶液,免疫4 d 后取出小鼠脾臟制成單細(xì)胞懸液,用200 目篩網(wǎng)過濾。將細(xì)胞濃度調(diào)整為5×10個/mL,與等量2 倍濃度的Hank’s 液(pH7.2)混合,分裝小試管,每管體積0.5 mL,再向管內(nèi)加50 μL 10% SRBC、20 μL 脾細(xì)胞懸液,迅速混勻,傾倒于己刷瓊脂糖薄層的玻片上,待瓊脂凝固后,將玻片水平扣放在片架上,放入二氧化碳培養(yǎng)箱中培養(yǎng)1.5 h,然后用SA 緩沖液稀釋的補(bǔ)體(1:8)加入玻片架凹槽內(nèi),繼續(xù)培養(yǎng)1.5 h 后,計數(shù)溶血空斑數(shù)。
1.2.2.6 血清溶血素的測定 給復(fù)合益生菌粉第26 d,10 只小鼠腹腔注射0.2 mL 體積分?jǐn)?shù)為2%的SRBC溶液,免疫后第4 d 摘眼球采血,分離血清。用生理鹽水將血清倍比稀釋,將不同稀釋度的血清分別置于微量血凝板內(nèi),每孔100 μL,再加入100 μL 0.5%(v/v)的SRBC 懸液,混勻,裝入濕潤的平盤內(nèi)加蓋,37 ℃培養(yǎng)3 h 后進(jìn)行血清溶血素測定。記錄血球凝集度,計算相應(yīng)抗體積數(shù)。
1.2.2.7 小鼠碳廓清試驗 各組小鼠尾靜脈注射用生理鹽水4 倍稀釋的印度墨汁10 mL/kg BW。每只小鼠在注射墨汁后2 和10 min 分別通過眼內(nèi)眥靜脈叢各取血20 μL,并迅速加入到2 mL 濃度為0.1%的NaCO溶液中搖勻。以NaCO溶液作空白對照。紫外可見分光光度計測試600 nm 波長處光密度值(OD)。將小鼠處死后取肝臟和脾臟,用濾紙吸干臟器表面血污,分別稱重計算吞噬指數(shù)(a)。
1.2.2.8 小鼠腹腔巨噬細(xì)胞吞噬雞紅細(xì)胞試驗 各組小鼠均腹腔注射1 mL 體積分?jǐn)?shù)為20%的雞紅細(xì)胞懸液,間隔30 min 乙醚麻醉后頸椎脫臼處死小鼠,經(jīng)腹腔注入2 mL 生理鹽水。轉(zhuǎn)動鼠板1 min 后吸出腹腔洗液1 mL 平均分滴于2 片載玻片上,放入搪瓷盒內(nèi),37 ℃溫育30 min。后再用生理鹽水洗滌,以1:1 的丙酮甲醇溶液固定,4%(v/v)Giemsa-磷酸緩沖液染色,再用蒸餾水漂洗、晾干。顯微鏡下觀察100 個巨噬細(xì)胞,計數(shù)吞噬雞紅細(xì)胞的巨噬細(xì)胞數(shù)和巨噬細(xì)胞吞噬的雞紅細(xì)胞總數(shù)及其被消化的程度,按公式求出吞噬率、吞噬指數(shù):
吞噬率(%)=吞噬雞紅細(xì)胞的巨噬細(xì)胞數(shù)/計數(shù)的巨噬細(xì)胞數(shù)×100
吞噬指數(shù)=被吞噬的雞紅細(xì)胞總數(shù)/計數(shù)的巨噬細(xì)胞數(shù)
1.2.2.9 NK 細(xì)胞活性測定(乳酸脫氫酶LDH 法)將YAC-1(靶細(xì)胞)進(jìn)行傳代培養(yǎng),調(diào)整細(xì)胞濃度為4×10個/mL。小鼠無菌取脾,制成單細(xì)胞懸液(效應(yīng)細(xì)胞),裂解紅細(xì)胞后調(diào)整細(xì)胞濃度為2×10個/mL。按照靶細(xì)胞和效應(yīng)細(xì)胞比為50:1 將YAC-1 細(xì)胞和脾細(xì)胞各100 μL、靶細(xì)胞自然釋放孔加靶細(xì)胞和培養(yǎng)液各100 μL、靶細(xì)胞最大釋放孔加靶細(xì)胞和1%NP40 各100 μL 加入U 型96 孔培養(yǎng)板,上述各項均設(shè)三個平行孔,放置培養(yǎng)箱中37 ℃培養(yǎng)4 h。1500 r/min,5 min 離心,每孔吸取上清100 μL 置平底96 孔培養(yǎng)板中,同時加入LDH 基質(zhì)液100 μL,根據(jù)室溫反應(yīng)8 min,每孔加入l mol/L 的鹽酸30 μL,在酶標(biāo)儀490 nm 處測定光密度值(OD)。
1.2.3 急性毒性實(shí)驗 選用SD 大鼠20 只,體重180~220 g,雌、雄各半。按最大耐受劑量法設(shè)20.0 g/kg BW 為灌胃劑量(相當(dāng)于人體推薦用量的600 倍)。稱取100.0 g 復(fù)合益生菌粉加蒸餾水至100 mL,混合均勻,配制成100%的混懸液備用。動物禁食16 h,不禁水,灌胃體積按20 mL/kg BW,一次經(jīng)口灌胃給予混懸液。灌胃后連續(xù)觀察14 d 內(nèi)大鼠的中毒癥狀及死亡情況,試驗開始、7 及14 d 稱量大鼠體重,試驗結(jié)束后乙醚麻醉并頸椎脫臼處死大鼠,作大體解剖。
1.2.4 遺傳毒性試驗
1.2.4.1 動物分組及處理 選取昆明種小鼠50 只,體重25~30 g,雌雄各半。將小鼠隨機(jī)分為5 組,每組10 只,雌雄各半。設(shè)10.0、5.0、2.5 g/kg BW 三個劑量組,另設(shè)溶劑對照組(蒸餾水)及環(huán)磷酰胺陽性對照組(CP,40 mg/kg BW)。分別稱取10.0、5.0、2.5 g復(fù)合益生菌粉加蒸餾水至20 mL,混合均勻,分別配制成50.0%、25.0%、12.5%的混懸液。另取CP 0.04 g 加蒸餾水至20 mL,溶解均勻備用。灌胃體積按20 mL/kg BW,試驗采用30 h 灌胃法,兩次間隔24 h,于第二次給樣品后6 h 乙醚麻醉后頸椎脫臼處死動物,取股骨骨髓涂片,固定,Giemsa 染色后,在油鏡下每只小鼠計數(shù)1000 個嗜多染紅細(xì)胞(PCE)中的微核細(xì)胞數(shù),計算微核的千分率。觀察200 個嗜多染紅細(xì)胞中成熟紅細(xì)胞數(shù),并計算嗜多染紅細(xì)胞與成熟紅細(xì)胞的比值(PCE/NCE)。
選取雄性昆明種小鼠50 只,體重25~35 g,將小鼠隨機(jī)分為5 組,每組10 只動物。設(shè)10.0、5.0、2.5 g/kg BW 三個劑量組,另設(shè)溶劑對照組(蒸餾水)及環(huán)磷酰胺陽性對照組(CP,40 mg/kg BW)。分別稱取10.0、5.0、2.5 g 復(fù)合益生菌粉加蒸餾水至20 mL,混合均勻,分別配制成50.0%、25.0%、12.5%的混懸液。另取CP 0.04 g 加蒸餾水至20 mL,溶解均勻,備用。灌胃體積按20 mL/kg BW,每日一次,連續(xù)5 d,首次給樣品后35 d,乙醚麻醉后頸椎脫臼處死動物,取雙側(cè)附睪進(jìn)行制片,甲醇固定,1%伊紅染色后,在高倍鏡下每只動物計數(shù)1000 條完整精子,記錄精子畸形數(shù)、畸形類型并計算精子畸形率。
1.2.4.2 Ames 試驗(平板摻入法)用多氯聯(lián)苯誘導(dǎo)的大鼠肝微粒體酶(S-9)作為體外代謝活化系統(tǒng),用間接致突變物(10 μg/皿2-氨基芴用于TA97、TA98、TA100,50 μg/皿1,8-二羥基蒽醌用于TA102 菌)測定S-9 活性。試驗采用TA97、TA98、TA100、TA102四種菌株,樣品設(shè)5000、1000、200、40、8 μg/皿五個劑量組及溶劑對照組、自發(fā)回變組和陽性對照組。稱取1.00 g 復(fù)合益生菌粉,加蒸餾水至20 mL,混合均勻即為最高工作濃度為5%的混懸液,稀釋即得其余所需濃度混懸液。試驗時分別取各濃度混懸液100 μL 加入平皿即為樣品各劑量。高壓蒸汽滅菌(0.103 MPa,20 min)。在加+S-9 和不加-S-9 的試驗條件下進(jìn)行平板摻入法試驗。每組作三個平行皿,重復(fù)試驗一次。-S-9 陽性對照物(不加S-9):TA100用1.5 μg/皿的疊氮化鈉,其余的三個菌株均采用50.0 μg 皿的敵克松;+S-9 陽性對照物(加S-9):TA102 用50.0 μg/皿的1,8-二羥基蒽醌,其余三個菌株均采用10.0 μg/皿的2-氨基芴。每皿加入陽性對照的體積為0.1 mL。
1.2.4.3 小鼠骨髓細(xì)胞微核試驗 取小鼠股骨骨髓涂片,Giemsa 染色后,在顯微鏡下每只小鼠計數(shù)1000個嗜多染紅細(xì)胞(PCE)中的微核細(xì)胞數(shù),計算微核的千分率。觀察200 個嗜多染紅細(xì)胞中成熟紅細(xì)胞數(shù),并計算嗜多染紅細(xì)胞與成熟紅細(xì)胞的比值(PCE/NCE)。
1.2.4.4 小鼠精子畸形試驗 取小鼠雙側(cè)附睪進(jìn)行制片,甲醇固定,1%伊紅染色后,在顯微鏡下每只動物計數(shù)1000 條完整精子,記錄精子畸形數(shù)、畸形類型并計算精子畸形率。
1.2.5 30 d 喂養(yǎng)試驗 選用離乳SD 大鼠80 只,雌雄各半,體重為65~92 g。將大鼠隨機(jī)分為4 組,每組20 只,雌雄各半。設(shè)3.34、1.67、0.84 g/kg BW 三個劑量組(分別相當(dāng)于人體推薦用量100、50、25倍),另設(shè)溶劑對照組(蒸餾水)。分別稱取33.4、16.7、8.4 g 樣品加蒸餾水至100 mL,混合均勻,分別配制成33.4%、16.7%、8.4%的混懸液備用。各組按10 mL/kg BW 每日經(jīng)口灌胃一次,連續(xù)灌胃30 d。每天觀察SD 大鼠的一般表現(xiàn)、行為、中毒癥狀及死亡,每周稱一次體重和二次食物攝入量,根據(jù)食物攝入量,計算每周及總的食物利用率。試驗結(jié)束稱量禁食16 h 后的大鼠空腹體重,乙醚麻醉后采血并處死動物。測定血液學(xué)指標(biāo)(血紅蛋白、紅細(xì)胞計數(shù)、白細(xì)胞計數(shù)及分類記數(shù)等)以及血液生化學(xué)指標(biāo)(谷草轉(zhuǎn)氨酶、谷丙轉(zhuǎn)氨酶、血清尿素、總蛋白、白蛋白、白/球、總膽固醇、肌酐、甘油三酯、血糖),解剖動物觀察內(nèi)臟改變,稱肝、腎、脾、睪丸濕重值。
1.3 數(shù)據(jù)處理
小鼠骨髓細(xì)胞微核試驗采用卡方檢驗,小鼠精子畸形試驗采用秩和檢驗,其余試驗數(shù)據(jù)應(yīng)用SPSS統(tǒng)計軟件進(jìn)行單因素方差分析。上述統(tǒng)計均用SPSS 17.0 for Windows 軟件處理。
2 結(jié)果與分析
2.1 復(fù)合益生菌粉對小鼠淋巴器官指數(shù)的影響
胸腺和脾臟指數(shù)反映了免疫器官的發(fā)育和免疫細(xì)胞的功能狀況,各劑量組的測試結(jié)果與陰性對照組并無顯著差異(>0.05),如表1 所示。說明復(fù)合益生菌粉對小鼠免疫器官的重量無明顯影響。這可能是因為測試時間不夠且小鼠本身具有一定的調(diào)節(jié)能力導(dǎo)致。

表1 復(fù)合益生菌粉對小鼠淋巴器官/體重比值的影響Table 1 Effect of compound probiotic powder on mouse lymphatic organ/body weight ratio
2.2 復(fù)合益生菌粉對DTH 反應(yīng)的影響
DTH 反應(yīng)是細(xì)胞免疫的體內(nèi)檢測方法,小鼠足趾腫脹度可反應(yīng)小鼠細(xì)胞免疫功能的強(qiáng)弱。結(jié)果表明高劑量組能顯著增強(qiáng)小鼠對SRBC 誘發(fā)的DTH反應(yīng),與陰性對照組比較,差異有顯著性(=0.014<0.05),但中低劑量組與陰性對照組差異不顯著(>0.05),如圖1 所示。這說明高劑量組的復(fù)合益生菌粉(1.00 g/kg BW)能增強(qiáng)小鼠細(xì)胞免疫。
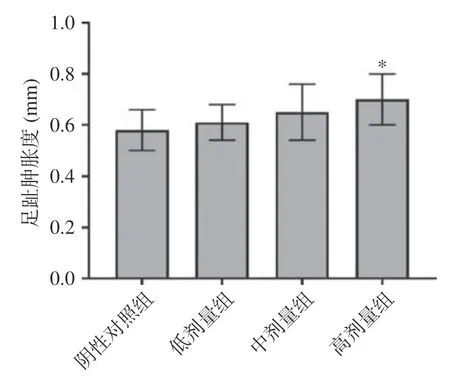
圖1 復(fù)合益生菌粉對DTH 反應(yīng)的影響Fig.1 Effect of compound probiotic powder on DTH reaction
2.3 復(fù)合益生菌粉脾淋巴細(xì)胞轉(zhuǎn)化試驗結(jié)果
T 淋巴細(xì)胞受到Con A 刺激后會轉(zhuǎn)化為母細(xì)胞持續(xù)增殖。通過MTT 法檢測其細(xì)胞增殖能力可以反應(yīng)細(xì)胞免疫功能的強(qiáng)弱。各劑量組測試的ConA 誘導(dǎo)的小鼠脾淋巴細(xì)胞增殖能力與陰性對照組并無顯著性差異(>0.05),如表2 所示。說明復(fù)合益生菌粉對小鼠淋巴細(xì)胞的增殖無明顯影響。
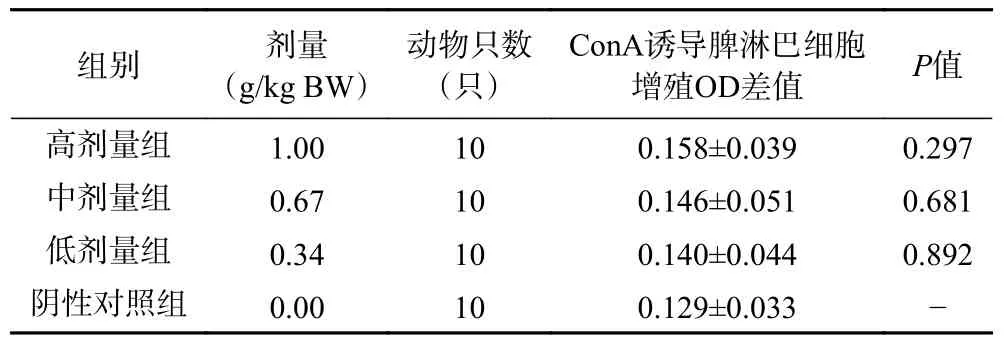
表2 復(fù)合益生菌粉對脾淋巴細(xì)胞轉(zhuǎn)化功能的影響Table 2 Effect of compound probiotic powder on the transformation function of splenic lymphocytes
2.4 復(fù)合益生菌粉抗體生成細(xì)胞檢測試驗結(jié)果
溶血空斑試驗是體外檢測抗體生成細(xì)胞數(shù)目的方法,空斑的數(shù)量是反映機(jī)體的體液免疫功能的重要指標(biāo)。高劑量組的空斑數(shù)與陰性對照組具有顯著差異(=0.036<0.05),中低劑量組與陰性對照組的差異不顯著(>0.05),如圖2 所示。這說明給予高劑量的復(fù)合益生菌粉可以提升小鼠體液免疫功能。
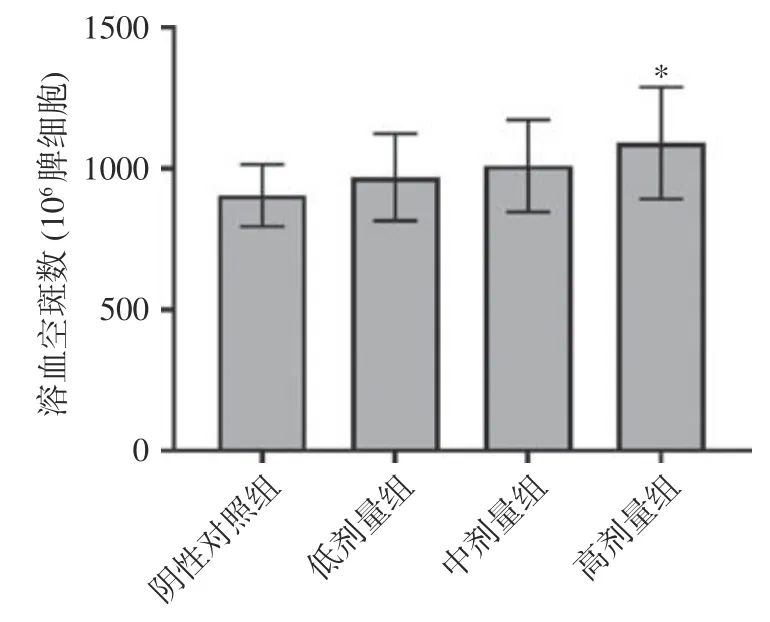
圖2 復(fù)合益生菌粉對抗體生成細(xì)胞功能的影響Fig.2 Effect of compound probiotic powder on the function of antibody-producing cells
2.5 復(fù)合益生菌粉對小鼠血清溶血素水平的影響
小鼠體內(nèi)產(chǎn)生的抗體溶血素在補(bǔ)體的參與下,與SRBC 共同孵育發(fā)生溶血反應(yīng),釋放血紅蛋白,而通過測定血紅蛋白含量能反應(yīng)動物產(chǎn)生溶血素的能力。高劑量組的小鼠溶血素水平與陰性對照組具有顯著差異(=0.015<0.05),中低劑量組與陰性對照組差異不具有顯著性(>0.05),如圖3 所示。這也說明給予高劑量的復(fù)合益生菌粉可以提升小鼠體液免疫功能。

圖3 復(fù)合益生菌粉對小鼠溶血素水平(抗體積數(shù))的影響Fig.3 Effect of compound probiotic powder on mouse hemolysin level(anti-volume number)
2.6 復(fù)合益生菌粉碳廓清試驗結(jié)果
巨噬細(xì)胞的碳廓清指數(shù)的大小可以反映巨噬細(xì)胞吞噬功能的強(qiáng)弱。巨噬細(xì)胞是具有免疫調(diào)節(jié)作用的免疫細(xì)胞,反映了機(jī)體非特異性免疫的強(qiáng)弱。實(shí)驗結(jié)果顯示高、中劑量組均能提高小鼠碳廓清吞噬指數(shù),與陰性對照組比較,差異均有顯著性(=0.012、0.047<0.05),低劑量組與陰性對照組差異不具有顯著性(>0.05),如圖4 所示。這說明高、中劑量組復(fù)合益生菌粉能增強(qiáng)巨噬細(xì)胞的吞噬功能,提升小鼠非特異性免疫。

圖4 復(fù)合益生菌粉對小鼠碳廓清功能的影響Fig.4 Effect of compound probiotic powder on the carbon scavenging function of mice
2.7 大鼠急性毒性試驗
以最大耐受劑量(MTD)20.0 g/kg BW 的劑量給予大鼠灌胃后,動物生長良好、行為正常、反應(yīng)敏捷、體重增加,未見動物有明顯中毒癥狀,14 d 內(nèi)動物無死亡。試驗結(jié)束解剖動物,大體觀察肝、心、腎、肺、脾、胃、腸等主要臟器均未見明顯異常。結(jié)果表明,該復(fù)合益生菌粉對雌、雄大鼠急性經(jīng)口毒性MTD 均大于20.0 g/kg BW,如表3 所示。這說明復(fù)合益生菌粉無急性毒性。

表3 復(fù)合益生菌粉對大鼠急性毒性試驗結(jié)果Table 3 Acute toxicity test results of compound probiotic powder on rats
2.8 遺傳毒性試驗
2.8.1 Ames 試驗 經(jīng)過兩次實(shí)驗,無論在加和不加S-9 條件下,復(fù)合益生菌粉各劑量組的回變菌落數(shù)均未超過自發(fā)回變菌落數(shù)的兩倍,亦無劑量-反應(yīng)關(guān)系,表明該樣品誘變試驗結(jié)果為陰性,如表4 和表5所示。
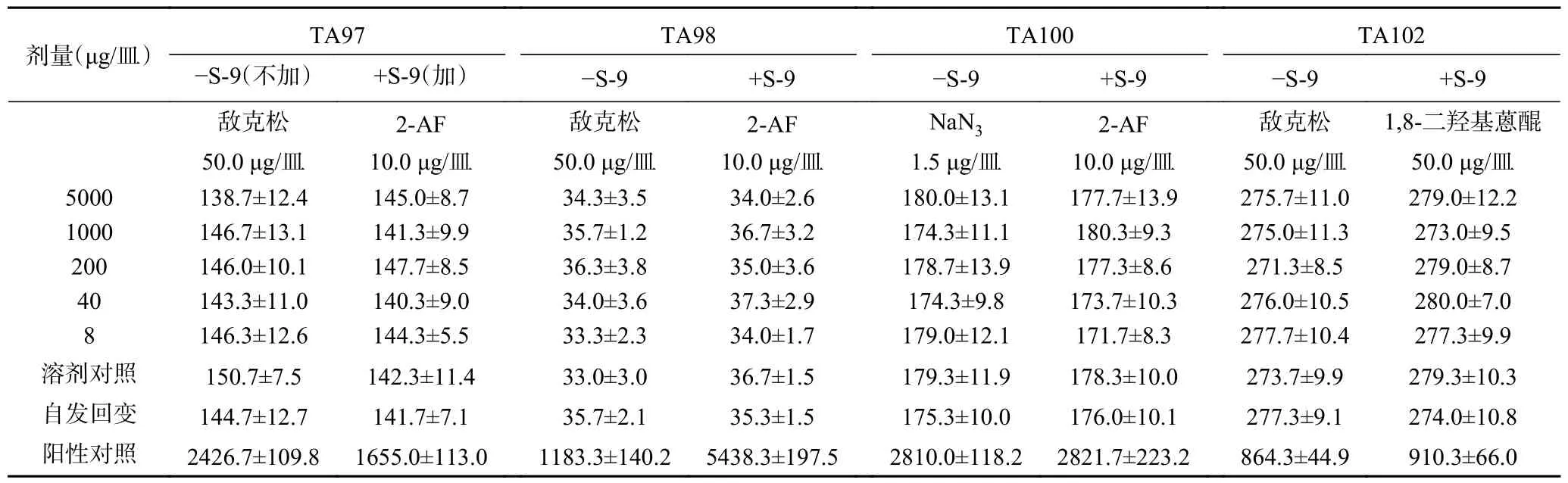
表4 復(fù)合益生菌粉Ames 試驗結(jié)果(第1 次)Table 4 Ames test results of compound probiotic powder (first time)
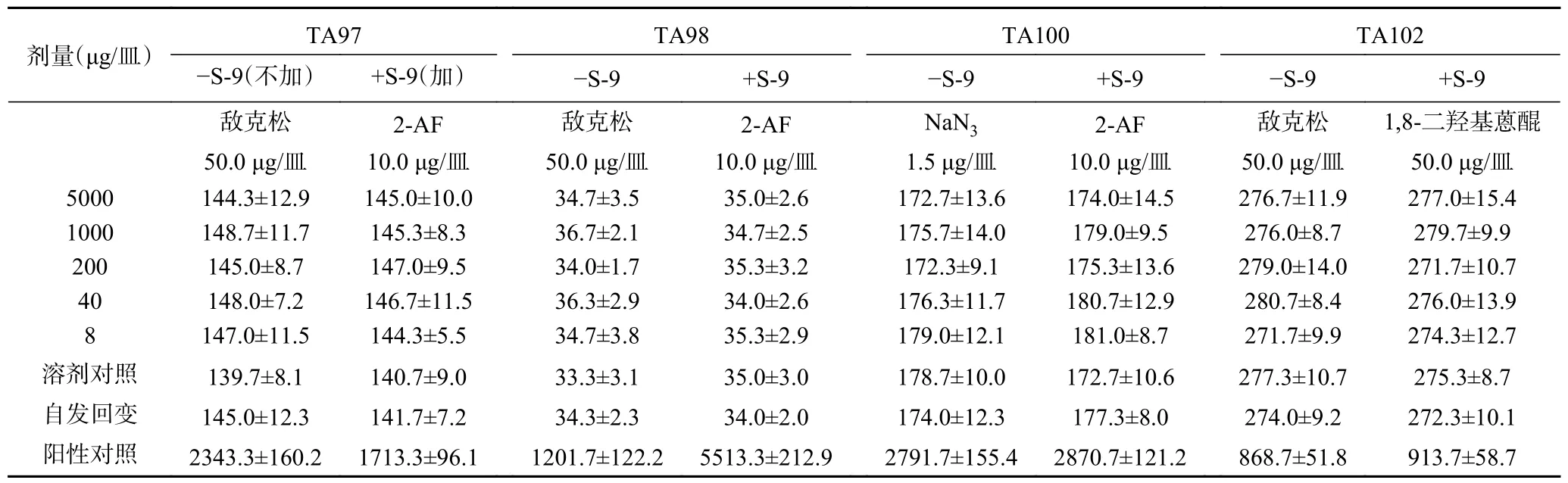
表5 復(fù)合益生菌粉Ames 試驗結(jié)果(第2 次)Table 5 Ames test results of compound probiotic powder (second time)
2.8.2 小鼠骨髓細(xì)胞微核試驗 復(fù)合益生菌粉各劑量組小鼠的骨髓細(xì)胞微核率與溶劑對照組比較,均無顯著性差異(>0.05),而環(huán)磷酰胺陽性對照組的微核率與溶劑對照組比較,差異有極顯著性(<0.01)。各劑量組的PCE/NCE 值均在正常值范圍內(nèi),且各劑量組PCE 占細(xì)胞總數(shù)的比例均不少于溶劑對照組的20%,上述結(jié)果表明復(fù)合益生菌粉對小鼠骨髓細(xì)胞微核試驗結(jié)果為陰性,如表6 所示。
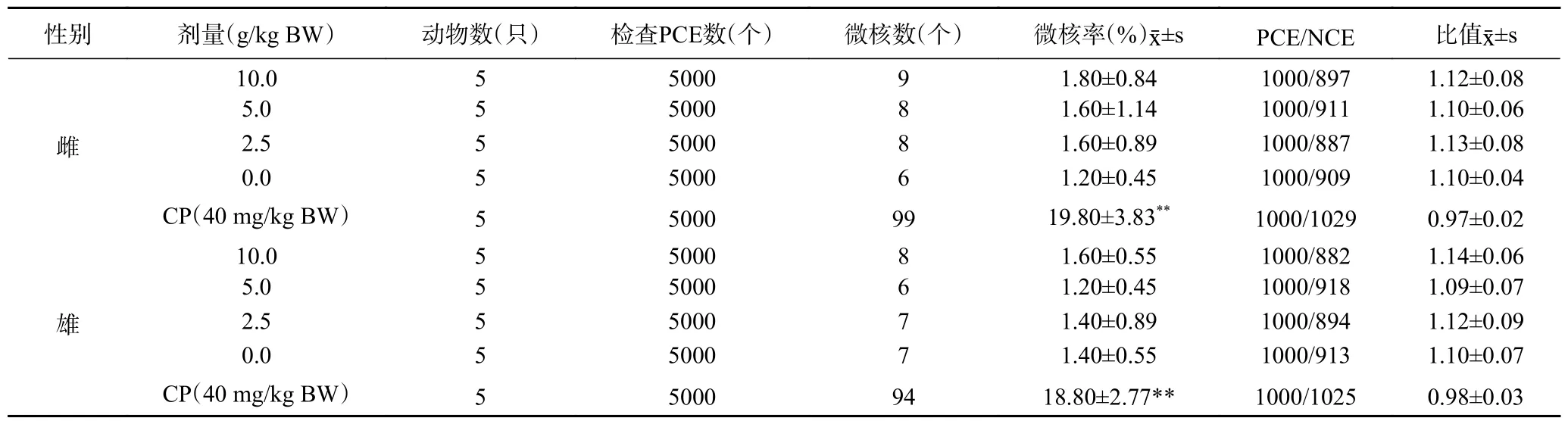
表6 復(fù)合益生菌粉對小鼠骨髓細(xì)胞微核試驗結(jié)果Table 6 Results of the micronucleus test of compound probiotic powder on mouse bone marrow cells
2.8.3 小鼠精子畸形試驗 由表7 可見,復(fù)合益生菌粉對小鼠精子畸形發(fā)生率未產(chǎn)生明顯改變,各劑量組精子畸形率與溶劑對照組比較,差異均無顯著性(>0.05),而環(huán)磷酰胺陽性對照組與溶劑對照組比較,差異有極顯著性(<0.01)。精子畸形類型主要表現(xiàn)以無鉤、香蕉形、無定形、胖頭為主。上述結(jié)果表明該樣品小鼠精子畸形試驗結(jié)果為陰性。

表7 復(fù)合益生菌粉對小鼠精子畸形試驗結(jié)果Table 7 Test results of compound probiotic powder on mouse sperm deformity
2.9 大鼠30 d 喂養(yǎng)試驗
2.9.1 復(fù)合益生菌粉對大鼠體重的影響 由表8 可見,各劑量組雌雄大鼠的初始體重、每周末體重、總增重及空腹重分別與溶劑對照組比較,差異均無顯著性(>0.05),說明實(shí)驗濃度內(nèi),復(fù)合益生菌粉對大鼠體重?zé)o顯著影響。

表8 復(fù)合益生菌粉對大鼠1~4 周體重及空腹重的影響Table 8 Effect of compound probiotic powder on the body weight and fasting weight of rats at 1~4 weeks
2.9.2 復(fù)合益生菌粉對大鼠每周進(jìn)食量的影響 由表9 可見,各劑量組雌雄大鼠的每周進(jìn)食量及總進(jìn)食量分別與溶劑對照組比較,差異均無顯著性(>0.05),說明實(shí)驗濃度內(nèi),復(fù)合益生菌粉對大鼠進(jìn)食量無顯著影響。
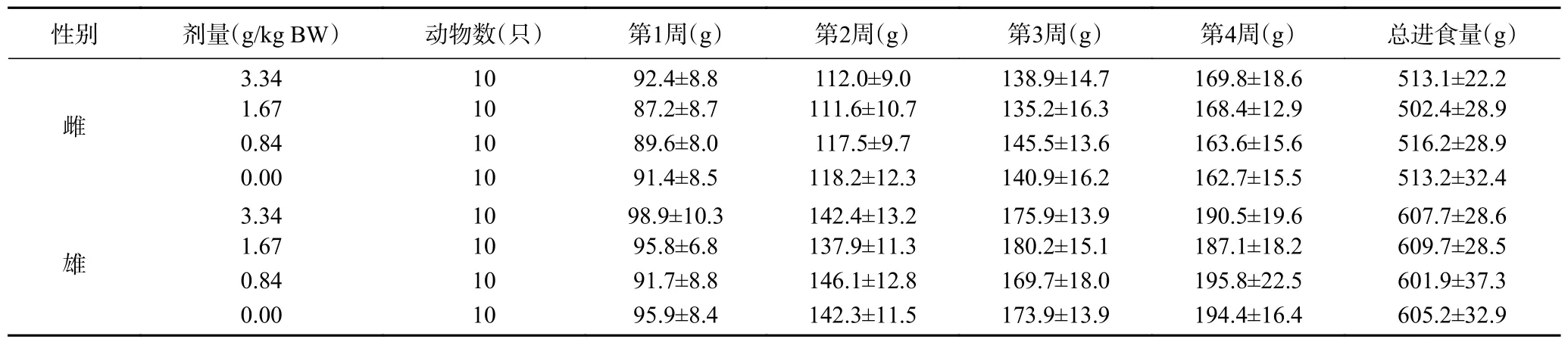
表9 復(fù)合益生菌粉對大鼠1~4 周總進(jìn)食量的影響Table 9 Effect of compound probiotic powder on rats’ total food intake during 1~4 weeks
2.9.3 復(fù)合益生菌粉對大鼠食物利用率的影響 由表10 可見,各劑量組雌雄大鼠的每周食物利用率以及總食物利用率分別與溶劑對照組比較,差異均無顯著性(>0.05),說明實(shí)驗濃度內(nèi),復(fù)合益生菌粉對大鼠食物利用率無顯著影響。

表10 復(fù)合益生菌粉對大鼠1~4 周食物利用率的影響Table 10 Effect of compound probiotic powder on the food utilization rate of rats in 1~4 weeks
2.9.4 復(fù)合益生菌粉對大鼠血常規(guī)指標(biāo)的影響 由表11可見,各劑量組的末期血常規(guī)指標(biāo)檢測結(jié)果分別與溶劑對照組比較,差異均無顯著性(>0.05),說明實(shí)驗濃度內(nèi),復(fù)合益生菌粉對大鼠血常規(guī)指標(biāo)無顯著影響。

表11 復(fù)合益生菌粉對大鼠血常規(guī)指標(biāo)的影響Table 11 Effect of compound probiotic powder on blood routine indexes of rats
2.9.5 復(fù)合益生菌粉對大鼠血液生化指標(biāo)的影響由表12~表13 可見,各劑量組末期血液生化指標(biāo)檢測結(jié)果分別與溶劑對照組比較,差異均無顯著性(>0.05),說明實(shí)驗濃度內(nèi),復(fù)合益生菌粉對大鼠血液生化指標(biāo)無顯著影響。

表12 復(fù)合益生菌粉對大鼠血液生化指標(biāo)的影響Table 12 Effect of compound probiotic powder on the blood biochemical indexes of rats
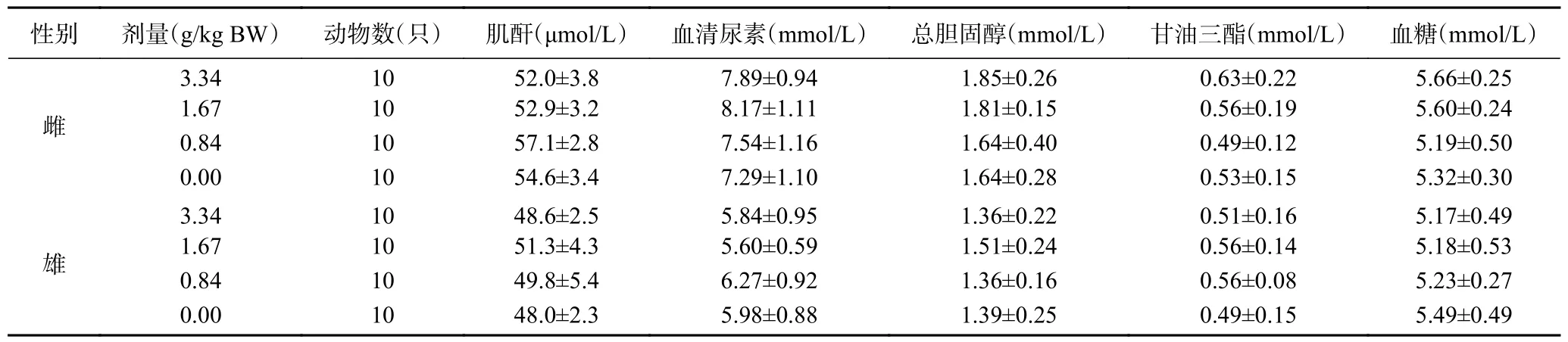
表13 復(fù)合益生菌粉對大鼠血液生化學(xué)指標(biāo)的影響Table 13 Effect of compound probiotic powder on blood biochemical indexes of rats
2.9.6 復(fù)合益生菌粉對大鼠臟體比的影響 由表14可見,各劑量組雌雄大鼠的肝/體比值、脾/體比值、腎/體比值以及雄鼠的睪/體比值分別與溶劑對照組比較,差異均無顯著性(>0.05),說明實(shí)驗濃度內(nèi),復(fù)合益生菌粉對大鼠臟體比值無顯著影響。
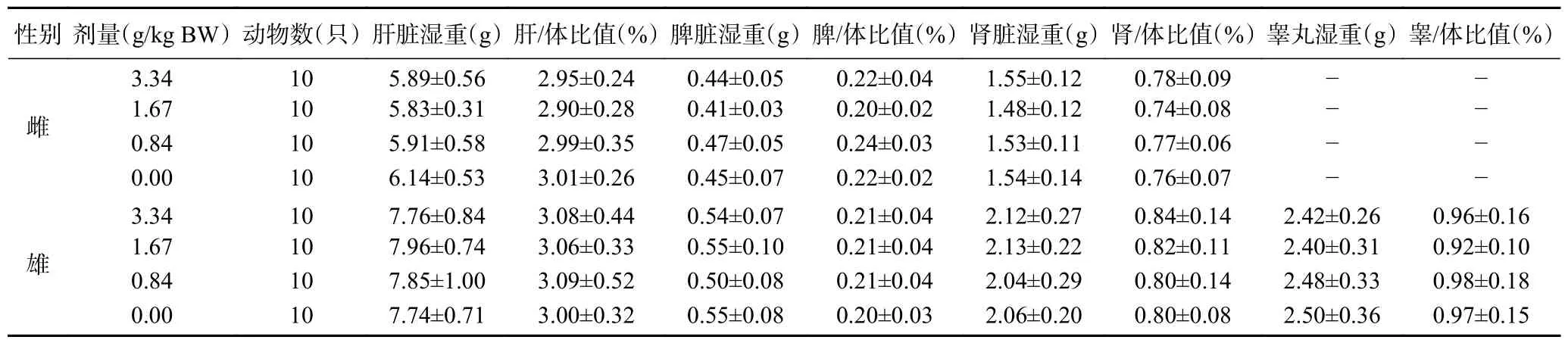
表14 復(fù)合益生菌粉對大鼠臟體比的影響Table 14 Effect of compound probiotic powder on rat’s viscera-to-body ratio
2.9.7 病理學(xué) 實(shí)驗結(jié)束后乙醚麻醉,頸椎脫臼處死大鼠,檢查包括肝臟、腎臟、脾臟、胃腸以睪丸和卵巢等組織。病理學(xué)檢查結(jié)果顯示:溶劑對照組雄性大鼠有2 例輕度肝小葉空泡變,其余組織均未見異常。以上組織病變屬動物的自發(fā)輕型病變,未見樣品高劑量組引起動物中毒性損傷改變。這進(jìn)一步說明了復(fù)合益生菌的食用安全性。
3 結(jié)論
喂食高劑量以鼠李糖乳桿菌粉LGG、乳雙歧桿菌Bi-07 以及低聚果糖等復(fù)配所制得的復(fù)合益生菌粉時可顯著提高DTH、PFC、血清溶血素水平、小鼠碳廓清吞噬指數(shù)等指標(biāo)(<0.05),證明復(fù)合益生菌粉可有效改善小鼠免疫能力。此外,雌雄大鼠對益生菌粉的最大耐受劑量(MTD)均大于20.0 g/kg BW,說明該菌粉屬無毒級;小鼠骨髓細(xì)胞微核試驗、小鼠精子畸形試驗、Ames 試驗三項結(jié)果均為陰性,說明該菌粉無遺傳毒性;試驗劑量在0.84~3.34 g/kg BW 范圍內(nèi),大鼠的生長發(fā)育良好,各劑量組的動物體重、進(jìn)食量、食物利用率、血液學(xué)指標(biāo)、血液生化學(xué)指標(biāo)、臟器濕重及臟器/體重比值與溶劑對照組比較,均無顯著性差異(>0.05),證明復(fù)合益生菌具有很高的食用安全性。
喂食鼠李糖乳桿菌粉LGG、乳雙歧桿菌Bi-07 的復(fù)合益生菌粉可以較好地增強(qiáng)小鼠機(jī)體免疫的能力,且食用安全性良好。因此,以鼠李糖乳桿菌粉LGG、乳雙歧桿菌Bi-07 及低聚果糖等復(fù)配所制得的復(fù)合益生菌粉在保健食品方向具有良好的應(yīng)用前景。

