玫瑰花中新嗩吶草素I的分離、含量測定和體外活性研究
薩仁高娃,蘇龍嘎,才仁拉毛,齊和日瑪
1內蒙古醫科大學民族醫藥創新中心;2內蒙古醫科大學藥學院,呼和浩特 010110
玫瑰(RosarugosaThunb.),多年生落葉灌木,屬于薔薇科薔薇屬植物。野生玫瑰分布于東亞溫帶地區,原產于我國北部,朝鮮,日本及堪察加半島和鄂霍次克海亞北極區地帶[1]。玫瑰花為玫瑰的干燥花蕾,其味甘、微苦、性溫、有疏肝理氣、和血調經的功能,可用于治療肝胃氣痛、食少嘔惡、月經不調、帶下、跌撲傷痛、風濕痹痛[2-5]等。玫瑰花作為藥食同源植物,在我國各地均有栽培種植,主要產區在山東平陰縣、甘肅苦水鎮、新疆和田地區、陜西渭南市、江蘇銅山縣、北京妙峰山等[6]。
玫瑰花的主要化學成分為酚類化合物[7]、揮發油[8]、多糖[9]、黃酮[10,11]和鞣質[12]等,其中,主要研究集中在玫瑰花瓣中酚類化合物及其抗氧化活性[13-15]的研究,而對其他成分的藥理作用和生物活性的研究甚少[16]。
可水解鞣質化合物是一類由酚酸及其衍生物與葡萄糖或多元醇通過苷鍵或酯鍵而形成的化合物。其藥理作用包括抗氧化、抗腫瘤、抗病毒、抑菌、降血糖、抗過敏、抗脂質過氧化等多種生物活性[17,18]。前期研究中報道新疆和田玫瑰中發現了包括新嗩吶草素I的幾種具有糖苷酶抑制作用的可水解鞣質化合物,其總含量為干燥玫瑰花瓣中約占3%~5%[19]。Okuda等[20]首次從日本野生玫瑰中分離出新嗩吶草素I。據報道,新嗩吶草素I具有抗痤瘡和抗炎活性[21]、保肝和抗氧化作用[22]、抗菌作用[23]。
本研究從內蒙古阿爾山區生產的玫瑰花中分離新嗩吶草素I,鑒定其結構,對不同產地玫瑰中新嗩吶草素I的含量進行測定,考察了其對α-葡萄糖苷酶的活性抑制作用和抗氧化活性,為篩選降低餐后血糖的玫瑰花保健品的開發應用提供理論基礎。
1 材料與方法
1.1 材料與試劑
阿爾山玫瑰花(Q/ATY006-2012)、長白山玫瑰花(Q/JMY00015)、北京玫瑰花(Q/YXS HT001)、新疆于田玫瑰花(Q/HSM000 IS-2014)、新疆和田玫瑰花(GB/T19598)、甘肅苦水玫瑰花(Q/SGT0005S)、山東平陰玫瑰花(GB/T19696)、湖南南山玫瑰花(Q/YSNJ0001S)、云南昆明重瓣玫瑰花(Q/KXY0002S)、云南金邊玫瑰(Q/CYC00035)、法蘭西玫瑰(Q/CYC00035)均購自內蒙古天盛蒙中醫藥有限公司。
α-葡萄糖苷酶(美國Sigma,批號G5003-100UN);阿卡波糖(北京拜爾藥業有限公司,國藥準字H19990205);DPPH(1,1-二苯基-2-三硝基苯肼,美國Sigma)。
1.2 儀器
高效液相色譜儀(Shimadzu LC-20303 3D);半制備高效液相色譜儀(Waters 2487);AVANCE NEO600 MHz核磁共振儀(Bruker Biospin AG);超高效液相色譜/質譜聯用儀(Waters XEVO G2-XS Q-Tof);KQ-500DE超聲波清洗器(昆山市超聲儀器有限公司);TELSTAR Cryodos 凍干機(西班牙泰事達公司);Fliter Max F5酶標儀(美國Molecular Devices);NUAIRE培養箱(美國NUAIRE)。
1.3 提取分離及結構鑒定
1.3.1 提取與分離
稱取玫瑰花粉末1.0 kg,加入50%乙醇1 L,混勻,浸泡24 h,過濾,反復提取3次,合并濾液,減壓濃縮至約200 mL。再用等量乙酸乙酯萃取3次,合并乙酸乙酯可溶部分,濃縮,冷凍干燥,得玫瑰花多酚提取物129.0 g。取玫瑰花多酚提取物10.0 g,進行Diaion HP-20(4.6 cm×45.7 cm)柱色譜分離,依次用水、50%乙醇、乙醇、丙酮洗脫,得到4個洗脫部分,濃縮,凍干。經高效液相色譜分析,選取50%乙醇洗脫部分,用水溶解采用Sephadex LH-20(4.6 cm × 45.7 cm)柱,以系統梯度水-乙醇不同比率(100∶1→0∶1)洗脫,對55%乙醇洗脫部分進行3~4次分離,高效液相色譜分析,得到富含多酚的乙醇洗脫液,合并,濃縮,再用半制備液相色譜柱進行分離純化,得到化合物1(47.9 mg)。半制備高效液相色譜條件:色譜柱:Waters T01741S 06(7.8 mm × 300 mm);進樣量:1 mL;流速:3.0 mL/min;檢測波長:280 nm;流動相:純水(A)-乙腈(B),采用二元梯度洗脫(0~5 min,100%→90% A;5~5.10 min,90%→77.5% A;5.10~12 min,77.5% A;12~12.10 min,77.5%→0% A;12.10~17 min,0% A;17~17.10 min,0%→90% A;17.10~20 min,90% A)。
1.3.2 結構鑒定
采用核磁共振儀(NMR)和質譜(Tof-Mass)解析,進行結構表征。質譜條件:毛細管電壓:3.0 kV(正離子)/2.5 kV(負離子);取樣電壓:80 V;源抵消電壓:80 V;離子源溫度:130 ℃;霧化溫度:450 ℃;錐孔氣:100 L/h;脫溶氣:800 L/h;數據采集模式:MSEContinuum;質量范圍:100~1 200 Da。
1.4 新嗩吶草素I的含量測定
1.4.1 色譜條件
色譜柱:Inertsil ODS-4(4.6 mm×150 mm,5 μm);柱溫:40 ℃,進樣量:20 μL,流速:1.0 mL/min,檢測波長:280 nm;流動相:純水加0.1%甲酸(A)-乙腈加0.1%甲酸(B),采用二元梯度洗脫(0~4 min,100%A;4~10 min,100%→85%A;10~18 min,85%→80%A;18~22 min,80%→70%A;22~28 min,70%→50%A;28~30 min,50%→0%A;30~32 min,0%→100%A)。
1.4.2 標準曲線的繪制
稱取“1.3.1”項下方法分離純化的新嗩吶草素I 25.0 mg,溶于50%乙醇定容于25 mL,用50%乙醇稀釋至五個不同濃度(20.0、40.0、50.0、60.0、80.0 μg/mL),0.45 μm濾頭過濾,按“1.4.1”項下色譜條件進行測定,繪制標準曲線。
1.4.3 玫瑰花中新嗩吶草素I含量的測定
分別取11個不同產地的玫瑰花,把花柄、花托、花萼、雌雄蕊等清理干凈后,花瓣粉碎,過100目篩子,備用。取玫瑰花粉末200.0 mg,加40 mL 50%乙醇溶解,超聲提取30 min,離心20 min(3 500 r/min,室溫),取上清液,加50%乙醇定至50 mL,0.45 μm濾頭過濾,按“1.4.1”項下色譜條件進行測定。
1.5 玫瑰花的體外活性評價
1.5.1 樣品制備
稱取上述玫瑰花粉末2.0g,加200 mL 50%乙醇溶解,按“1.4.3”項下方法提取2次,上清液合并,濃縮,冷凍干燥,得玫瑰花提取物。
1.5.2 抑制α-葡萄糖苷酶活性的測定
采用pNPG法測定11種玫瑰花提取物對α-葡萄糖苷酶的抑制作用[24-26]。分別準確稱取玫瑰花提取物0.10、0.15、0.20、0.25、1.25 mg,用50%乙醇溶液溶解分別定容到10 ml,得到濃度為10、15、20、25、125 μg/mL的樣品溶液。96孔培養皿里加12 mm pNPG培養基80 μL,分別加10 μL上述5個不同濃度的樣品溶液(n= 3),再加α-葡萄糖苷酶溶液10 μL,在405 nm波長下測定其吸光度,然后放進37 ℃培養箱里培養20 min,再次測定其吸光度。陽性對照品為0.1 mg/mL阿卡波糖溶液,空白對照品為純水。根據抑制率公式計算樣品抑制率,從而推算其半數抑制濃度值(IC50)。
抑制率=[A空白-(A樣品-A樣品空白)]/A空白×100%
式中,A空白為空白對照溶液吸收度;A樣品為樣品對α-葡萄糖苷酶作用后的吸收度數值;A樣品空白為樣品吸收度數值。
1.5.3 清除DPPH自由基活性的測定
稱取玫瑰花提取物10.0 mg,用50%乙醇溶解定容到10 mL,得到1.0 mg/mL樣品溶液,再用50%乙醇分別稀釋得到濃度為1.0、0.5、0.1、0.05、0.025 mg/mL的溶液。精密吸取樣品溶液20 μL,加1,1-二苯基-2-三硝基苯肼(DPPH,125 mmol/L)180 μL,混勻,在避光條件下,冰塊中靜置20 min,在517 nm下測定其吸光度。空白對照溶液為同樣體積的50%乙醇加125 mmol/L DPPH溶液。使用其吸光度計算DPPH的清除率,從而推算其IC50。
DPPH的清除率=[1-(A樣品-A樣品空白)/A空白]×100%
式中,A樣品為樣品對DPPH作用后的吸光度,A樣品空白為樣品吸光度,A空白為DPPH空白對照溶液吸光度。
2 結果
2.1 化合物的結構解析和純度分析
化合物1黃色粉末;HR-ESI-MS:m/z787.081 3[M + H]+,分子式為C34H26O22。1H NMR(600 MHz,DMSO-d6)δ:6.88(2H,s,HI-2′,6′a),6.87(2H,s,HI-2′,6′b),6.80(2H,s,HII-2′,6′a),6.75(2H,s,HII-2′,6′b),6.38(1H,s,H-3′′a),6.36(1H,s,H-3′′b),6.23(1H,s,H-3′′′a),6.20(1H,s,H-3′′′b),5.68(1H,t,J= 9.8 Hz,H-3a),5.53(1H,t,J= 9.8 Hz,H-3b),5.37(1H,d,J= 1.5 Hz,H-1a),5.16(1H,dd,J= 9.8,1.5 Hz,H-6a),5.11(1H,dd,J= 9.8,1.5 Hz,H-6b),5.04(1H,dd,J= 9.8,8.1 Hz,H-2a),4.98(1H,dd,J= 9.8,8.3 Hz,H-2b),4.94(1H,d,J= 1.5 Hz,H-1b),4.90(1H,dd,J= 9.8,6.3 Hz,H-5a),4.87(1H,dd,J= 9.8,6.3 Hz,H-5b),4.54(1H,t,J= 9.8 Hz,H-4a),4.33(1H,t,J= 9.8 Hz,H-4b),3.82(1H,d,J= 9.8 Hz,H-6a),3.75(1H,dd,J= 9.8,1.5 Hz,H-6b);13C NMR(151 MHz,DMSO-d6)δ:95.7(C-1a),90.4(C-1b),71.3(C-2a),70.7(C-2a),73.3(C-3a),72.9(C-3b),70.5(C-4a),70.3(C-4b),72.2(C-5a),72.2(C-5b),66.2(C-6a),62.8(C-6b),119.3(CI-1′),109.0(CI-2′,6′),146.0(CI-3′,5′),138.6(CI-4′),166.4(CI-7′),119.1(CII-1′),109.0(CII-2′,6′),144.8(CII-3′,5′),138.5(CII-4′),165.7(CII-7′),115.0(C-1′′),124.9(C-2′′),107.2(C-3′′),144.5(C-4′′,6′′),136.2(C-5′′),168.3(C-7′′),115.3(C-1′′′),124.5(C-2′′′),106.7(C-3′′′),143.4(C′′′-4′′′,6′′′),136.2(C-5′′′),167.9(C-7′′′)。將上述波譜數據與文獻[20,27]比較,鑒定化合物1為新嗩吶草素I(結構式見圖1)。化合物1的純度以歸一化法推算,互變異構體峰1的相對峰面積為26.64%;互變異構體峰2的相對峰面積為68.84%,總相對峰面積為95.48%。
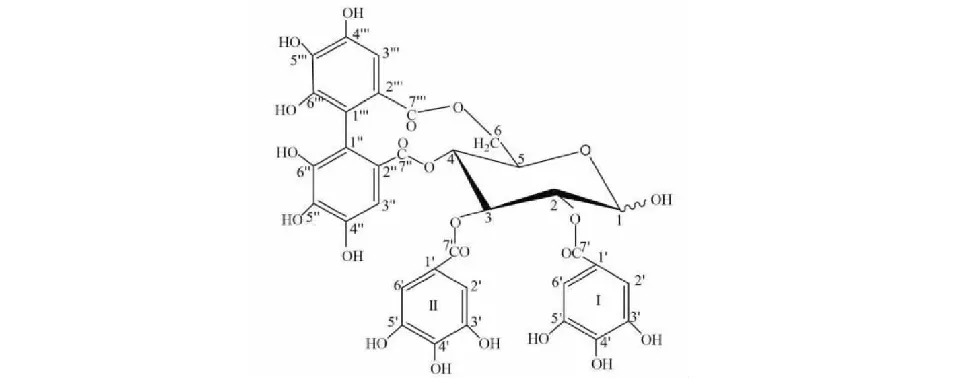
圖1 新嗩吶草素I結構式
2.2 新嗩吶草素I含量測定
2.2.1 標準曲線的繪制
分別以新嗩吶草素I互相異構體的峰面積為縱坐標(Y),對照品濃度為橫坐標(X),繪制回歸曲線,回歸方程分別為Y=51 915X-141 156(R2= 0.999 4)、Y= 63 016X-233 878(R2= 0.998 7),在0.2~0.8 mg/mL范圍內線性關系良好(見圖2)。
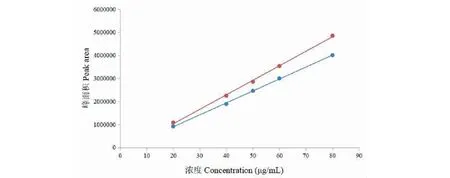
圖2 新嗩吶草素I互變異構體的標準曲線
2.2.2 玫瑰花中的新嗩吶草素I含量的測定
11個不同產地的玫瑰花分別經過超聲處理后,采用高效液相色譜儀進行分析。結果得出,玫瑰花提取物中新嗩吶草素I的分離度較好,色譜圖見圖3。11個不同產地玫瑰花提取物均含有新嗩吶草素I,其含量普遍較高(如表1所示),1 g干燥玫瑰花中含有7.75~73.75 mg新嗩吶草素I,含量為0.8%~7.4%。其中云南重瓣玫瑰花中新嗩吶草素I含量最高,新疆于田玫瑰中含量最低。
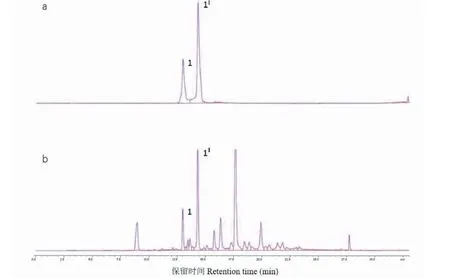
圖3 新嗩吶草素I(a)和玫瑰花提取物(b)的液相色譜圖
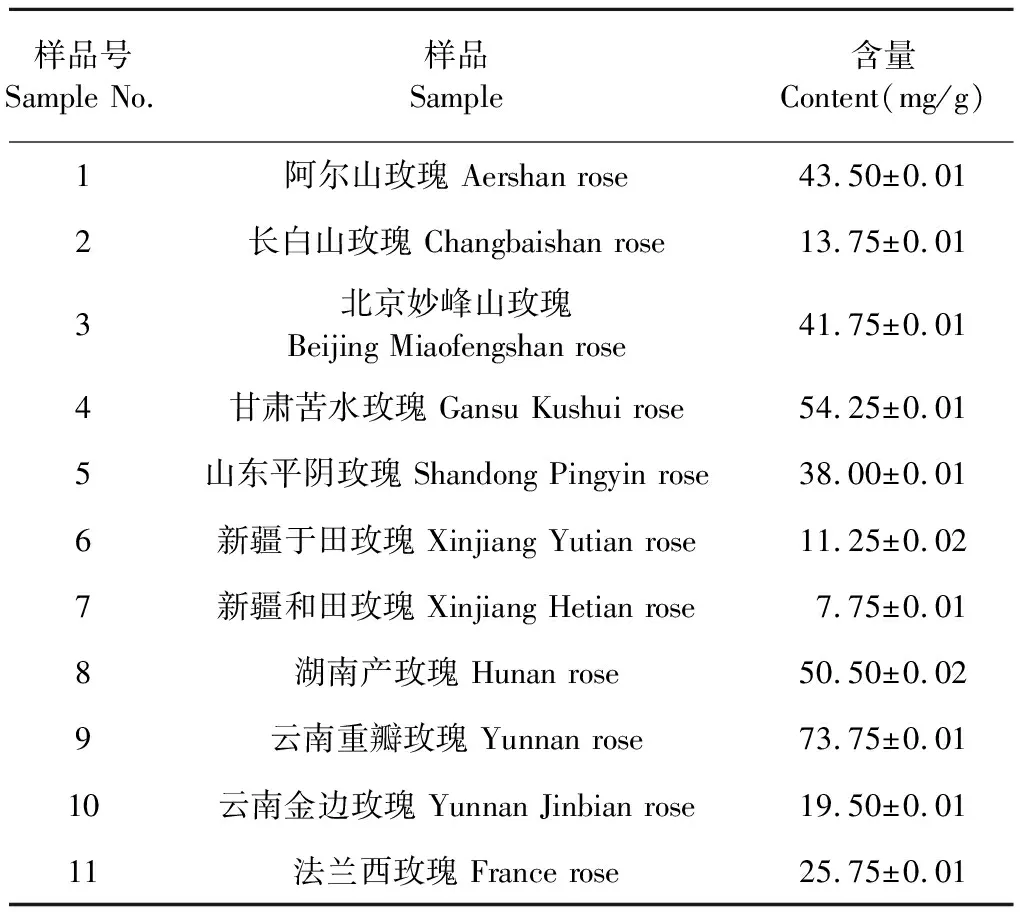
表1 玫瑰花中新嗩吶草素I的含量測定結果
2.3 體外活性評價
2.3.1 抑制α-葡萄糖苷酶的活性評價
對11個不同產地玫瑰花提取物進行α-葡萄糖苷酶抑制活性評價實驗,結果如表2所示,11個不同產地玫瑰花提取物對α-葡萄糖苷酶均顯示較強的抑制活性,其中甘肅苦水玫瑰的IC50為14.73 μg/mL,而新疆和田玫瑰對α-葡萄糖苷酶的抑制作用最弱,IC50為40.96 μg/mL。陽性藥阿卡波糖對α-葡萄糖苷酶抑制活性IC50為38.00 μg/mL,而新嗩吶草素I對α-葡萄糖苷酶抑制活性IC50為10.00 μg/mL,對α-葡萄糖苷酶抑制活性比陽性藥阿卡波糖高3.8倍。
2.3.2 抗氧化活性評價
玫瑰花提取物的抗氧化活性評價結果如表2所示,不同產地玫瑰花提取物均有抗氧化活性,其中北京妙峰山玫瑰的抗氧化作用最強,其IC50為102.1 μg/mL,而新疆和田玫瑰抗氧化作用最弱,其IC50為379.9 μg/mL。
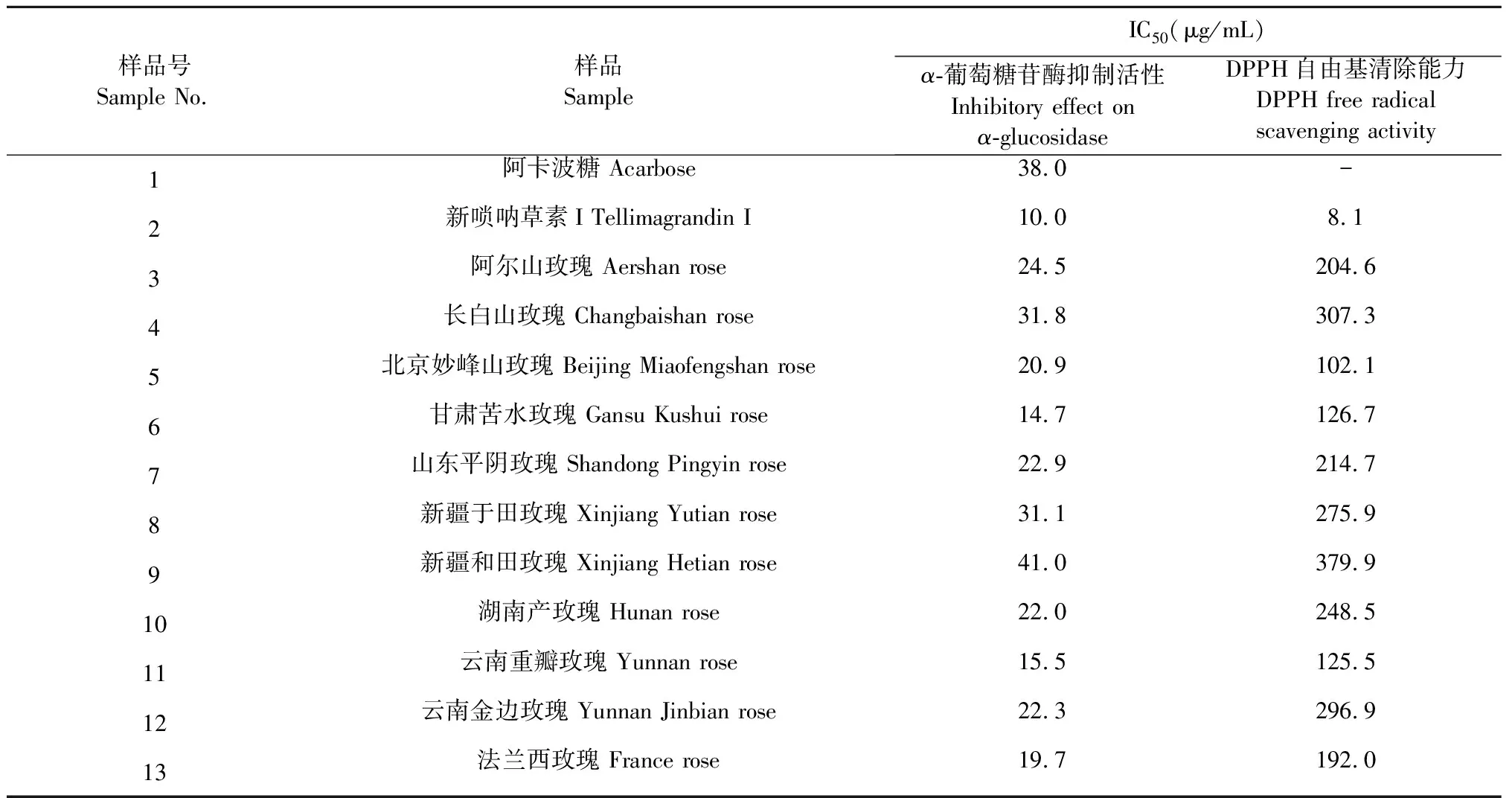
表2 玫瑰花的抑制α-葡萄糖苷酶活性和DPPH自由基清除能力評價結果
3 討論與結論
本文采用葡聚糖凝膠(Sephadex LH-20)柱層析和半制備高效液相色譜法,從阿爾山玫瑰提取物中分離制備了一種可水解鞣質類化合物-新嗩吶草素I,是葡萄糖的2、3位上的沒食子酰基和4、5位上的HHDP(hexahydroxydiphenyl)基組成的鞣花鞣質。該化合物葡萄糖的端基為游離羥基,在液相色譜儀分析,280 nm波長下檢測到兩個峰。以pNPG為底物的酶抑制劑評價實驗發現新嗩吶草素I相對于阿卡波糖(IC50為38.00 μg/mL)有較強的抑制作用,其IC50為10.0 μg/mL。而DPPH自由基清除能力評價實驗顯示,新嗩吶草素具有較強的抗氧化活性,其清除DPPH自由基的半數清除率IC50為8.1μg/mL。
玫瑰花中富含大量可水解鞣質類化合物,主要含有新嗩吶素I、新嗩吶素II、玫瑰素A、玫瑰素B、玫瑰素D、木麻黃鞣亭、木麻黃素、異木麻黃素等化合物[7,12],其中新嗩吶草素I的含量為最高[7,12]。這些可水解鞣質類在酸、堿、酶的作用下,水解為小分子酚酸類化合物和糖或多元醇。本研究中,對11個不同產地玫瑰花進行新嗩吶草素I的含量測定,結果發現均含有新嗩吶草素I,并且含量為0.8%~7.4%,由此可見,新嗩吶草素I為玫瑰花中可水解類化合物中含量比較高的主要成分之一。體外活性實驗中,不同產地玫瑰花提取物均對α-葡萄糖苷酶有抑制活性和清除DPPH自由基活性,并且除了新疆和田玫瑰,其他10個產地的玫瑰花對α-葡萄糖苷酶的抑制活性均高于陽性藥阿卡波糖,表明玫瑰花藥材中存在具有α-葡萄糖苷酶抑制功能的化學成分,可作為玫瑰花的新功能開發潛力的有效成分。通過本研究可以證明,新嗩吶草素I是玫瑰花中抑制α-葡萄糖苷酶活性和抗氧化活性成分之一。不同產地玫瑰花提取物中新嗩吶草素I的含量越高,相應提取物的α-葡萄糖苷酶抑制活性和清除DPPH自由基活性有增加的趨勢,但無顯著性差異,表明無量效關系,這可能是玫瑰花中具有其他新嗩吶草素I結構類似而活性相近的鞣質類化合物或酚酸類化合物的不同而引起的,故進一步研究玫瑰花中其它酚類成分是有必要的。

