口腔鱗狀細胞癌中NCAPD2的表達水平及生物學功能
馬 萍,程璐瑤,金武龍,王 寧,翟榮萍
口腔鱗狀細胞癌(oral squamous cell carcinoma, OSCC)惡性程度高,侵襲性強,是頭頸部鱗狀細胞癌(head and neck squamous cell carcinoma, HNSCC)發生率較高的腫瘤。OSCC是口腔癌最常見的病理類型,約占口腔癌的90%[1],其五年生存率較低[2],晚期OSCC化療極易產生耐藥,且化療效果差[3-4]。因此,尋找新的分子靶標對于OSCC的早期診斷和治療具有重要的意義。非SMC凝集素Ⅰ復合亞基D2(non-SMC condensin Ⅰ complex subunit D2, NCAPD2)是凝集素Ⅰ的一個組成亞基,位于染色體12p13.3上。凝縮素Ⅰ復合體是由兩個“染色體的結構維護”ATPase SMC2/SMC4異源二聚體和三個調節亞基NCAPD2、CAP-G、CAP-H組成[5]。在真核細胞有絲分裂過程中對染色體結構的改變和分離起著不可或缺的作用[6-7]。有研究表明NCAPD2與腫瘤的發生密切相關。在三陰乳腺癌中,NCAPD2與腫瘤細胞的周期、增殖和侵襲相關[8]。NCAPD2與OSCC的關系如何目前尚不清楚。鑒于HNSCC中一半以上病例是OSCC,因此本研究首先通過數據庫分析NCAPD2在HNSCC中的表達及與臨床病理特征的關系。我們發現NCAPD2在HNSCC組織中表達較高,這提示NCAPD2可能與OSCC的發生發展相關,考慮為OSCC的一個分子治療靶點。因此,本研究旨在使用免疫組織化學的方法探討NCAPD2在OSCC中的表達情況,同時在OSCC細胞中探究NCAPD2的生物學功能。
1 材料與方法
1.1 病例選擇
本實驗所用組織標本取自內蒙古醫科大學附屬醫院口腔頜面外科經手術治療,并且術后經過病理學診斷確診的35例OSCC患者,為2018年1月至2020年12月期間手術患者。同時對應收集距腫瘤邊緣≥2.0 cm的癌旁正常口腔黏膜組織作為對照。5例癌旁正常組織和35例OSCC組織,其中舌癌4例,頰癌13例,腭癌8例,牙齦癌6例,唇癌4例。其中男16例,女19例,患者年齡38~87歲,平均年齡65歲。按照口腔癌WHO臨床病理分級,Ⅰ~Ⅱ級為26例,Ⅲ~Ⅳ級為9例;按照AJCC口腔癌臨床分期,Ⅰ~Ⅱ期27例,Ⅲ~Ⅳ級8例;按照是否發生淋巴結轉移,有淋巴結轉移為11例,無淋巴結轉移24例。
1.2 細胞系
OSCC細胞系CAL-27和Tca8113購自北納生物。
1.3 主要試劑
NCAPD2抗體購自美國Abcam公司(1∶50,Abcam,英國,ab198019),免疫組織化學試劑盒購自DAKO公司(貨號:Denmark, K8000),磷酸鹽緩沖液(phosphate-buffered saline,PBS)、檸檬酸緩沖液、蘇木精染劑和二氨基聯苯胺(diaminobenzidine,DAB)顯色劑均購自上海齊一生物有限公司,DMEM培養液和胎牛血清(fetal bovine serum,FBS)均購自美國Gibco公司。
1.4 生物信息學分析
應用UALCAN數據庫(http://ualcan.path.uab.edu/index.html)分析HNSCC組織和正常頭頸組織中NCAPD2的表達及其與臨床病理特征的關系。
1.5 免疫組化染色
將組織切片脫蠟、修復、檸檬酸封閉,并與NCAPD2 抗體在4 ℃下孵育過夜。用磷酸鹽緩沖液(PBS)洗滌5次后,加入通用二抗 IgG,樣品在25 ℃下孵育30 min。隨后用3,3′-二氨基聯苯胺和蘇木精對組織切片進行染色以進行可視化。 使用顯微鏡(奧林巴斯,日本)獲取圖像。結果判讀:NCAPD2的表達以細胞核和細胞質內出現棕黃色顆粒為組織化學染色陽性反應。根據染色強度的評分標準:陰性無著色為0分,淺黃色為1分,棕黃色為2分,深褐色為3分。根據陽性細胞數所占比例的評分標準:0%~25%(包含0%,不包含25%)為1分,25%~50%(包含25%,不包含50%)為2分,50%~75%(包含50%,不包含75%)為3分,≥75%為4分。結果判讀:陽性細胞評分×染色顏色強度評分判斷IHC結果,分值越高抗體表達越高。0 分為(-),1~4分為(+),5~8分為(++), 9~12分為(+++)。其中(+)和(++)為低表達,(++)和(+++)為高表達。
1.6 質粒構建、細胞培養和慢病毒感染
以NCAPD2基因為模板設計了NCAPD2 特異性靶序列shNCAPD2(5′-CAGGTTCTCAGTGGCGATCAA-3′)和一個陰性對照序列shCtrl (5′-TTCTCCGAACGTGTCACGT-3′)并整合到 BR-V108載體(上海生物科學有限公司)。使用 EndoFree Maxi Plasmid Kit (Tiangen, DP118)擴增和提取質粒。用3種質粒(BRV-108、PMD2.G 和 pSPAX2)共轉染293T細胞以獲得慢病毒。CAL-27和Tca8113細胞中加入10% DMEM的完全培養基置于37 ℃、5% CO2的培養箱中進行培養,細胞貼壁后,用含Opti-MEM和 Polybrene的慢病毒載體感染細胞12 ~ 16 h,然后更換新鮮的培養基。72 h后用熒光顯微鏡觀察感染效率。通過qPCR和蛋白印跡法驗證NCAPD2敲低效率。
1.7 細胞增殖實驗
通過Celigo全視野細胞成像分析儀對細胞實現拍照和自動計數,從而大通量地檢測基因對細胞增殖的影響。Celigo是基于全自動圖像采集與圖像數據分析的高通量篩選系統。通過慢病毒感染細胞,使目標細胞表達GFP(綠色熒光),在HCS增殖檢測實驗中,檢測目標即為感染病毒后表達GFP的目標細胞(96孔板)。Celigo能識別帶綠色熒光的細胞并拍照即讀板。然后通過軟件對拍照的圖像進行分析處理,計算孔板中不同組別含有的細胞數目。連續讀板5 d后,即可繪制出細胞生長曲線圖,從而反映出細胞增殖狀況。增殖率=((每組細胞各時間點細胞計數值-該組第一天的細胞計數值)/該組第一天的細胞計數值)×100%。抑制率=((實驗組細胞各時間點細胞計數值-實驗組第一天的細胞計數值)/(對照組細胞各時間點細胞計數值-對照組第一天的細胞計數值))×100%。
1.8 細胞凋亡實驗
將實驗組(感染慢病毒shNCAPD2組)和對照組(感染慢病毒shCtrl組)細胞分別進行慢病毒感染,通過胰酶消化,進行離心和洗滌后棄上清,將binding buffer加入細胞沉淀中收集細胞,使用Annexin V-APC進行染色,24 h內進行流式細胞儀檢測,按照凋亡檢測試盒說明書及流式細胞儀檢測細胞凋亡率。
1.9 蛋白質印跡法(Western Blot)
用RIPA裂解液裂解細胞后提取總蛋白,用BCA試劑盒測蛋白濃度。配制SDS-PAGE膠后進行蛋白電泳,轉膜,脫脂奶粉封閉2 h,加一抗4 ℃孵育過夜。洗膜后加二抗室溫下孵育1 h,之后進行顯色反應,使用電化學發光(electrochemical luminescence,ECL)曝光液曝光。
1.10 實時熒光定量PCR(quantitative real-time PCR,qPCR)
使用Trizol試劑提取RNA,然后用Hiscript QRT Supermix for qPCR (+gDNA wiper)(Vazyme,南京)試劑盒獲得cDNA,最后使用AceQ qPCR SYBR Green Master Mix (Vazyme, Q111-02)試劑盒進行RT-qPCR。引物序列為NCAPD2:正向5′-TCCATCAAACATCTTCCACCAC-3′;反向5′-TGAGGCCAGGATCTATACTTCG-3′。GAPDH:正向5′-TGACTTCAACAGCGACACCCA-3′;反向5′-CACCCTGTTGCTGTAGCCAAA-3′。GAPDH作為內參,用2-ΔΔCT法計算相對表達量。
1.11 統計學分析
使用SPSS 21.0軟件進行統計分析和GraphPad Prism 8進行繪圖。數據分析采用平均值±標準差表示,配對比較采用Student′st檢驗進行統計學分析。采用Mann-WhitneyU分析和Spearman相關性分析NCAPD2表達與OSCC病理分級的相關性。P<0.05為差異有統計學意義。
2 結 果
2.1 數據庫分析NCAPD2在HNSCC中的表達
應用UALCAN數據庫分析發現NCAPD2 mRNA在520例HNSCC組織中表達水平顯著高于44例正常頭頸組織(P<0.001,圖1A)。進一步通過Ualcan數據庫分析NCAPD2 mRNA的表達水平與臨床病理特征的關系,發現其與HNSCC臨床分期、病理分級和淋巴結轉移密切相關。在不同臨床分期及不同病理分級的HNSCC組織中NCAPD2的表達水平顯著高于癌旁正常組織(P<0.001,圖1B~1C);且HNSCC中無淋巴結轉移和有淋巴結轉移組織中NCAPD2 mRNA的表達水平均高于癌旁正常組織(P<0.001,圖1D)。
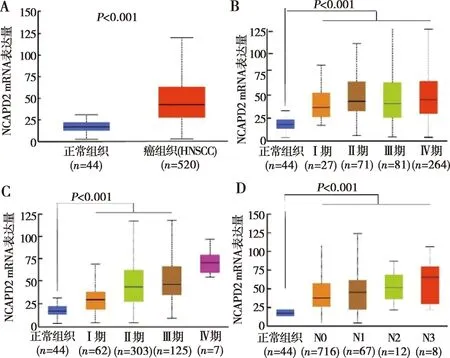
A:HNSCC中NCAPD2的表達;B:不同臨床分期的HNSCC組織中NCAPD2的表達;C:不同病理分級的HNSCC組織中NCAPD2的表達;D:HNSCC中無淋巴結轉移和有淋巴結轉移組織中NCAPD2的表達
2.2 NCAPD2蛋白在臨床OSCC病例組織中的表達
為了驗證NCAPD2在OSCC組織中的表達情況,我們使用免疫組化染色的方法驗證了NCAPD2蛋白在OSCC組織及正常組織的表達情況,結果顯示NCAPD2在細胞核和細胞質中均有表達,主要在細胞質中表達,NCAPD2在OSCC組織中的低表達占比為45.7%(16/35),高表達為54.3%(19/35)。與癌旁正常組織相比,NCAPD2蛋白表達水平在OSCC組織中明顯升高,有統計學差異(P<0.05,圖2,表1)。
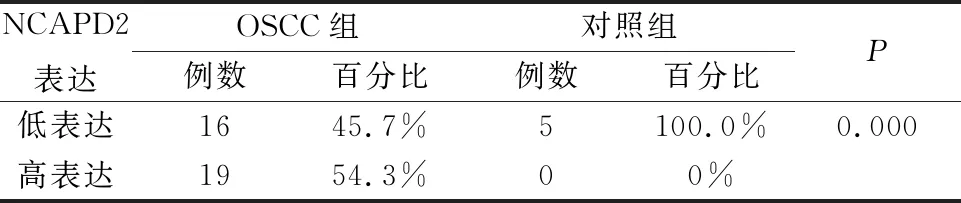
表1 NCAPD2在OSCC和對照組織中的表達

A:癌旁組織中NCAPD2蛋白的表達 (-);B:OSCC組織NCAPD2弱陽性(+);C:OSCC組織NCAPD2陽性染色(++);D:OSCC組織NCAPD2強陽性(+++)。標尺:100 μm
2.3 NCAPD2蛋白的表達水平與OSCC患者臨床病理學特征的關系
為進一步分析NCAPD2蛋白表達水平與OSCC患者臨床病理學特征的關系,通過Mann-WhitneyU
分析和Spearman相關性分析,發現NCAPD2蛋白的表達與OSCC的病理分級顯著相關,但與患者的年齡、性別、腫瘤大小、淋巴結轉移等情況均無關(P>0.05,表2)。提示NAPD2蛋白可能參與OSCC發生、發展的過程。
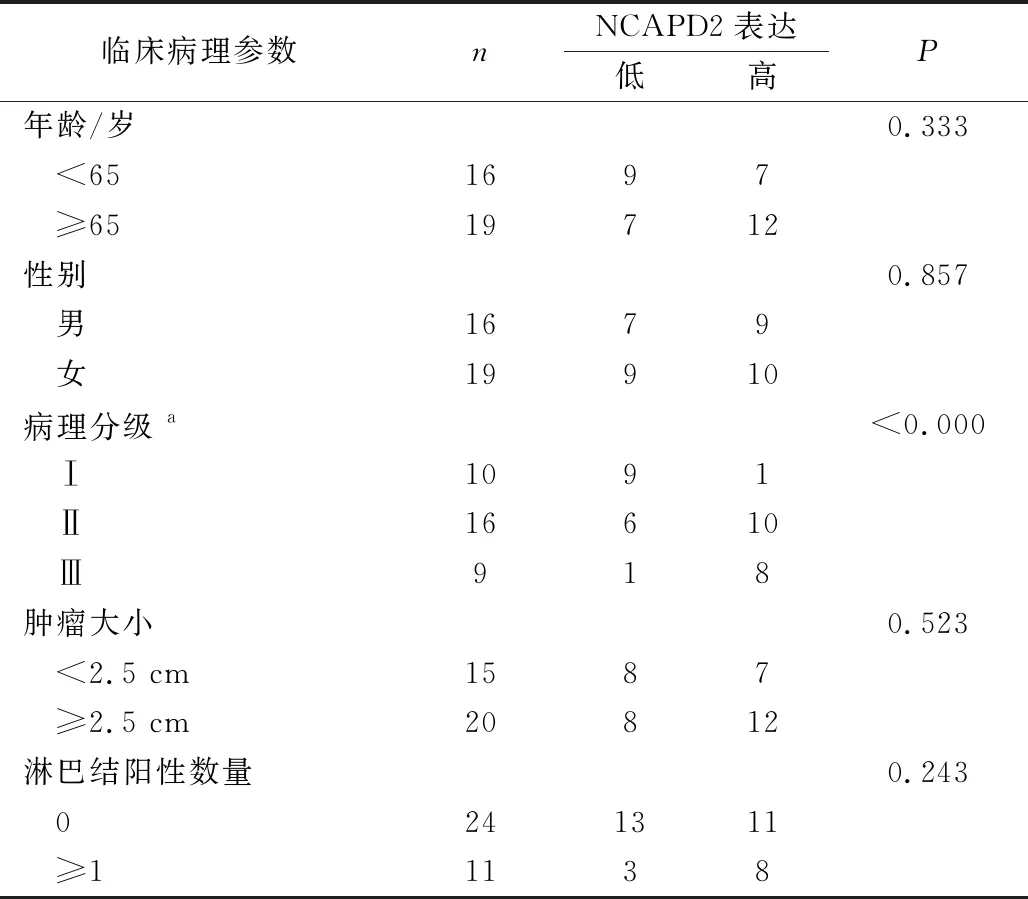
表2 NCAPD2表達與OSCC患者臨床病理學特征的關系
2.4 NCAPD2基因敲減細胞模型的構建
在Tca8113和CAL-27細胞株中,通過轉染shNCAPD2構建NCAPD2敲減細胞模型,陰性對照為轉染shCtrl。通過觀察固定在慢病毒載體上的綠色熒光蛋白(GFP)證實兩株細胞的轉染效率均>80%(圖3A)。qPCR結果表明,NCAPD2在Tca8113和CAL-27細胞中的表達分別下降77.41%和61.94%(P<0.001,圖3B)。Western Blot結果顯示,NCAPD2敲減細胞模型成功建立(圖3C)。
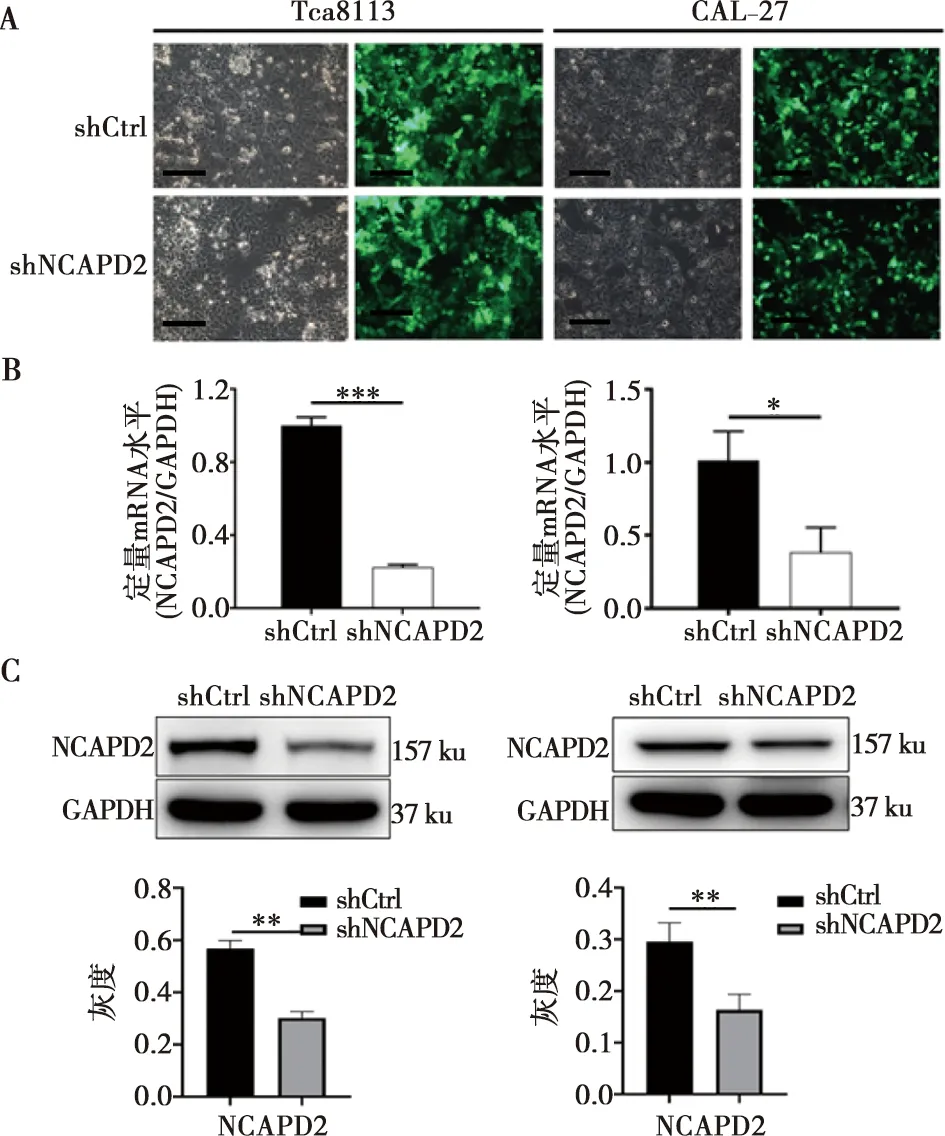
A:通過觀察熒光評估 Tca8113和CAL-27 細胞的轉染效率, 放大200倍,標尺:100 μm; B:qPCR 檢測Tca8113和CAL-27 細胞中NCAPD2的敲低效率; C:蛋白質印跡證實 NCAPD2在Tca8113和CAL-27細胞中的敲除情況;*:P<0.05,**:P<0.01,***:P<0.001
2.5 NCAPD2基因表達變化對CAL-27和 Tca-8113 細胞增殖的影響
通過HCS探究NCAPD2敲減后對OSCC細胞系CAL-27和Tca8113增殖能力的影響。結果表明,相比對照shCtrl組,NCAPD2敲減的shNCAPD2組細胞增殖能力明顯下降。此外,與對照組shCtrl相比,NCAPD2敲減后細胞的生長受到明顯抑制,Tca8113和CAL-27細胞的增殖抑制率分別為45.3%和53.2%,差異有統計學意義(P<0.05,圖4A、B)。
2.6 NCAPD2基因表達變化對口腔癌CAL-27和Tca-8113 細胞凋亡的影響
通過流式細胞儀檢測NCAPD2敲減后對細胞凋亡的影響。結果表明,NCAPD2的敲減促進了OSCC細胞Tca8113和CAL-27的凋亡,凋亡率分別為5.04%(倍數變化=5)和1.91%(倍數變化=1.9),差異有統計學意義(P<0.05,圖4C、D)。
2.7 Tca8113細胞中凋亡相關蛋白的檢測
從Western Blot結果可以看出,相比于對照組,NCAPD2敲減后,Tca8113細胞中促凋亡蛋白Bax和p53表達上調,而抗凋亡蛋白Bcl-2和p21表達水平下調,差異有統計學意義(P<0.05,圖4E)。

A:NCAPD2敲減后對Tca8113細胞增殖能力的影響;B:NCAPD2敲減后對CAL-27細胞增殖能力的影響;C:NCAPD2敲減后對Tca8113細胞凋亡的影響;D:NCAPD2敲減后對CAL-27細胞凋亡的影響;E:Tca8113細胞中凋亡相關蛋白的檢測。與對照組相比,*:P<0.05,**:P<0.01,***:P<0.001
3 討 論
口腔鱗狀細胞癌(OSCC)是口腔癌最常見的亞型,約占口腔癌的90%,它是一種易復發和轉移的惡性腫瘤[9],且治療效果不佳,五年生存率僅有50%[10]。因此, 迫切需要探索OSCC的分子基礎并制定有效的治療策略, 從而最終提高OSCC患者的生存率。
凝集素在有絲分裂染色體凝聚過程中起著重要作用[11]。在真核細胞中有兩種不同類型的凝集素復合物,分別稱為凝集素Ⅰ復合物和凝集素Ⅱ復合物。經典凝集素復合物共享同一對核心亞基,稱為染色體結構維持蛋白(structural maintenance of chromosome proteins,SMC)和3個不同的非SMC亞基[12]。在人類細胞中,凝集素Ⅰ的非SMC亞基是NCAPD2、NCAPG和NCAPH,而凝聚素Ⅱ復合物中的相應對應物是NCAPD3、NCAPG2和NCAPH2[13]。NCAPD2是位于染色體12p13.3上的凝集蛋白Ⅰ中的三個非SMC亞基之一。NCAPD2在真核細胞有絲分裂過程中對染色體結構的改變和分離起著不可或缺的作用[6-7]。轉染研究和定點誘變證實非SMC亞基NCAPD2是E2F的靶標[14]。NCAPD2具有HEAT重復序列,介導蛋白質-蛋白質相互作用[15]。NCAPD2通過其羧基末端的雙核核定位信號介導凝集素復合體在染色質上的募集和靶向定位[16],主要參與細胞周期過程中染色體的凝集和分離。
20多年的研究,NCAPD2的基本生物學功能已被闡明。其與人類疾病關系的研究處于起步階段。據報道NCAPD2與神經系統變性疾病有關。NCAPD2基因多態性與晚發性阿爾茨海默病[17-18]和漢族人群帕金森病有關[19]。Zhang等[8]報道了NCAPD2與乳腺癌之間具有密切關系。NCAPD2在三陰乳腺癌細胞中參與了包括細胞周期、細胞增殖、細胞分裂和侵襲等多種與腫瘤惡性表型密切相關的生物學功能。除此之外,也有研究表明卵巢癌中 NCAPD2的異常表達可能是一個獨立的預后因素[20]。最近有研究表明NCAPD2在結直腸癌臨床組織和腫瘤細胞中高表達,并在促進結直腸癌發生和生長中發揮作用[21]。
本研究結果表明NCAPD2在OSCC中表達上調,并參與OSCC細胞的增殖、凋亡等過程。IHC染色顯示NCAPD2在細胞核和細胞質中均有表達,主要在細胞質中表達,這與Schmiesing等的研究結果相符,即在間期至分裂前期大部分NCAPD2與SMC4-SMC2復合物從染色體解離分布在細胞質中,少部分復合物保留在染色體上[22]。此外,免疫組化結果表明與癌旁正常組織相比,NCAPD2蛋白表達水平在OSCC組織中明顯升高,這與Jing等的研究結果一致,即在結腸癌中NCAPD2的表達水平較癌旁組織升高[21]。
之后,我們使用慢病毒感染構建了NCAPD2低表達的OSCC細胞模型進行驗證。發現與對照組相比,NCAPD2敲減組細胞增殖能力明顯下降。Tca8113和CAL-27細胞的增殖抑制率分別為45.3%和53.2%,與此同時,Tca8113細胞的凋亡率為5.04%,而CAL-27細胞的凋亡率為1.91%,兩組細胞的增殖與凋亡結果相反。在Tca8113細胞中進行的凋亡相關蛋白的檢測結果表明相比于對照組,NCAPD2敲減后,Tca8113細胞中促凋亡蛋白Bax和p53表達增加,而抗凋亡蛋白Bcl-2和p21表達水平降低,凋亡相關蛋白表達檢測結果與細胞的表型實驗結果相一致。本研究表明NCAPD2在負性調控促凋亡蛋白Bax和p53表達的同時,可正向調控抗凋亡蛋白Bcl-2和p21的表達,從而通過抑制Tca8113和CAL-27細胞的凋亡而發揮促癌作用。
綜上所述,NCAPD2在OSCC中高表達,且與病理分級和臨床分期相關,同時,NCAPD2能夠促進OSCC細胞的增殖,抑制其凋亡,可能與其抑制凋亡相關蛋白的表達有關。這些結果表明NCAPD2可能與OSCC的發生發展有關,有望成為OSCC治療的潛在靶點。
盡管我們的研究發現NCAPD2在OSCC發生發展中發揮著重要作用,并與OSCC細胞的增殖和凋亡相關,是一種潛在的OSCC預后標志物。但是具體分子機制如何,我們需要進行進一步研究。

