重癥腦卒中病人腸內營養不耐受風險的預警模型構建與評估
孫曉嵐 李占肖 于曉雯 柴會榮
腦卒中病情重,致殘率與致死率較高[1]。腦卒中急性期病人機體處于高代謝狀態,若營養支持不足,不僅導致免疫功能下降,還可加重原發疾病。既往研究顯示,營養不良與卒中后并發癥、病死率等相關[2]。營養支持可改善腦卒中病人的代謝狀態,糾正負氮平衡,參與器官功能恢復。腸內營養由于更符合生理,是腦卒中病人首要營養支持路徑[3]。但由于病人存在胃腸功能動力和吸收功能異常,腸內營養過程易出現喂養不耐受[4-5]。喂養不耐受的發生與病人機體負氮平衡、死亡等相關[6],早期發現并進行及時干預,規范腸內營養操作,有助于改善預后。目前,研究主要集中于對喂養不耐受發生情況及影響因素進行的橫斷面調查,有關喂養不耐受的個體化預測報道較少。本研究基于重癥腦卒中病人腸內營養不耐受的影響因素建立列線圖預測模型并進行驗證,以期為腸內營養不耐受的篩查與預防提供一定參考依據,現報道如下。
1 資料與方法
1.1 一般資料 回顧性分析2018年1月至2020年6月我院收治的282例重癥腦卒中病人為研究對象,年齡55~86歲,平均(69.73±8.96)歲。本研究經我院倫理委員會批準(CHEC2017-176)。納入標準:(1)符合《中國急性缺血性腦卒中診治指南》[7]中相關標準,并經顱腦CT或MRI確診;(2)入住ICU后48 h經鼻胃管途徑行腸內營養支持,預計時間>3 d;(3)均無顱內感染、顱內占位。排除標準:(1)有腸道疾病、胃部手術史及腹部、食管、胰腺手術史;(2)合并精神障礙疾病。
1.2 研究方法
1.2.1 腸內營養支持方法:采用鼻胃管以20~50 mL/h速度給予營養支持,并依據耐受程度逐漸增加至80~100 mL/h,腸內營養制劑包括腸內營養混懸液(百普力)、腸內營養乳劑(瑞素)及腸內營養乳劑(瑞能),腸內營養液溫度為37~40 ℃。
1.2.2 臨床資料收集:通過查閱文獻、咨詢專家并結合本院實際情況確定影響因素。(1)基本資料:性別、年齡、BMI、便秘史。(2)病情監測:收集腸內營養開始前1 d格拉斯哥昏迷評分(GCS)、血糖、白蛋白水平以及白細胞升高、CRP升高情況。(3)治療因素:使用2種以上抗菌藥物、使用促胃動力藥物、使用益生菌、實施機械通氣、實施亞低溫治療、營養液配方、首次營養液泵入量、營養液濃度、過渡到目標用量時間。缺失數據采用多重插補法填補。由2名經過培訓的專職人員收集資料,雙人核對數據以確保無誤。
BMI:參照世界衛生組織亞洲人BMI分級標準,BMI<18.5為體重過輕,18.5≤BMI<24.0為體重正常,BMI≥24.0為超重。
GCS評分:評價內容包括睜眼(1~4分)、語言(1~5分)、運動(1~6分),滿分為15分,昏迷越嚴重則分值越低。
1.3 腸內營養不耐受評價標準 參照2016年美國腸外與腸內營養協會(ASPEN)重癥病人營養支持指南[8]并借鑒葛世偉等[9]的研究內容,確定營養不耐受性評價指標,即嘔吐、腹瀉、胃潴留、誤吸4項,以上癥狀均未出現為耐受性良好;出現≥1項上述癥狀,但經調整腸內營養速度、量等積極處理后,可繼續進行腸內營養,為耐受性差;出現≥1項上述癥狀,且經積極處理后癥狀仍較重,不能繼續腸內營養,為完全不耐受。耐受性每6 h評定1次,共觀察7 d。

樣本量確定:本研究共納入18個因素,每個因素至少需要5~10例病人驗證,根據周乾曉等[10]的研究結果,危重癥病人腸內營養不耐受發生率為38%,假設失訪率為10%,預計樣本量為(18×5/0.38)/0.9=263,(18×10/0.38)/0.9=526,因此樣本量在263~526之間,本研究共納入282例重癥腦卒中病人。
2 結果
2.1 影響重癥腦卒中病人腸內營養不耐受的單因素與多因素分析 建模組282例重癥腦卒中病人中,107例出現喂養不耐受,發生率為37.94%,其中71.96%發生于腸內營養后1~3 d。單因素Logistic分析結果顯示,年齡、使用2種以上抗菌藥物、使用益生菌、實施機械通氣、營養液配方與腸內營養不耐受有關(P<0.05)。將單因素分析有統計學意義的因素[年齡(<60歲=0,≥60歲=1)、使用2種以上抗菌藥物(否=0,是=1)、使用益生菌(否=0,是=1)、實施機械通氣(否=0,是=1)、營養液配方(短肽型=0,整蛋白型=1,短肽型+整蛋白型=2)]作為自變量,并設置短肽型為啞變量,是否發生喂養不耐受作為因變量,采用逐步回歸法構建Logistic回歸模型,結果顯示,年齡≥60歲、使用2種以上抗菌藥物、實施機械通氣是重癥腦卒中病人腸內營養不耐受的獨立危險因素,使用益生菌為保護因素。見表1。
2.2 重癥腦卒中病人腸內營養不耐受的列線圖預測模型的構建 建立Logistic回歸方程:Y=0.675×年齡賦值+1.011×使用2種以上抗菌藥物賦值+(-1.136)×使用益生菌+1.110×實施機械通氣賦值,并將其繪制成列線圖,以分值形式呈現各因素對喂養不耐受的貢獻度,年齡≥60歲為60分,使用2種以上抗菌藥物為97分,實施機械通氣治療為95分,不使用益生菌為70分,見圖1。各變量的取值通過垂直線在列線圖頂端的評分(Points)標尺上獲得相應的計分,各變量計分相加為總分,總分處作垂線與列線圖底部預測概率相交可得喂養不耐受的發生風險預測值。
2.3 列線圖模型的驗證 基于列線圖預測概率構建ROC曲線,得到建模隊列與驗證隊列的AUC分別為0.794(95%CI:0.741~0.847)、0.764(95%CI:0.690~0.839),建模隊列ROC最大Youden指數0.449所對應的風險預測值0.322為腸內營養不耐受發生風險的臨界值,對應的預測臨界值總分為200分,即總得分≥200分病人為高危病人;建模組、驗證組的校準曲線均趨近于理想曲線(圖2)。Hosmer-Lemeshow 擬合優度檢驗χ2=5.899,P=0.659。
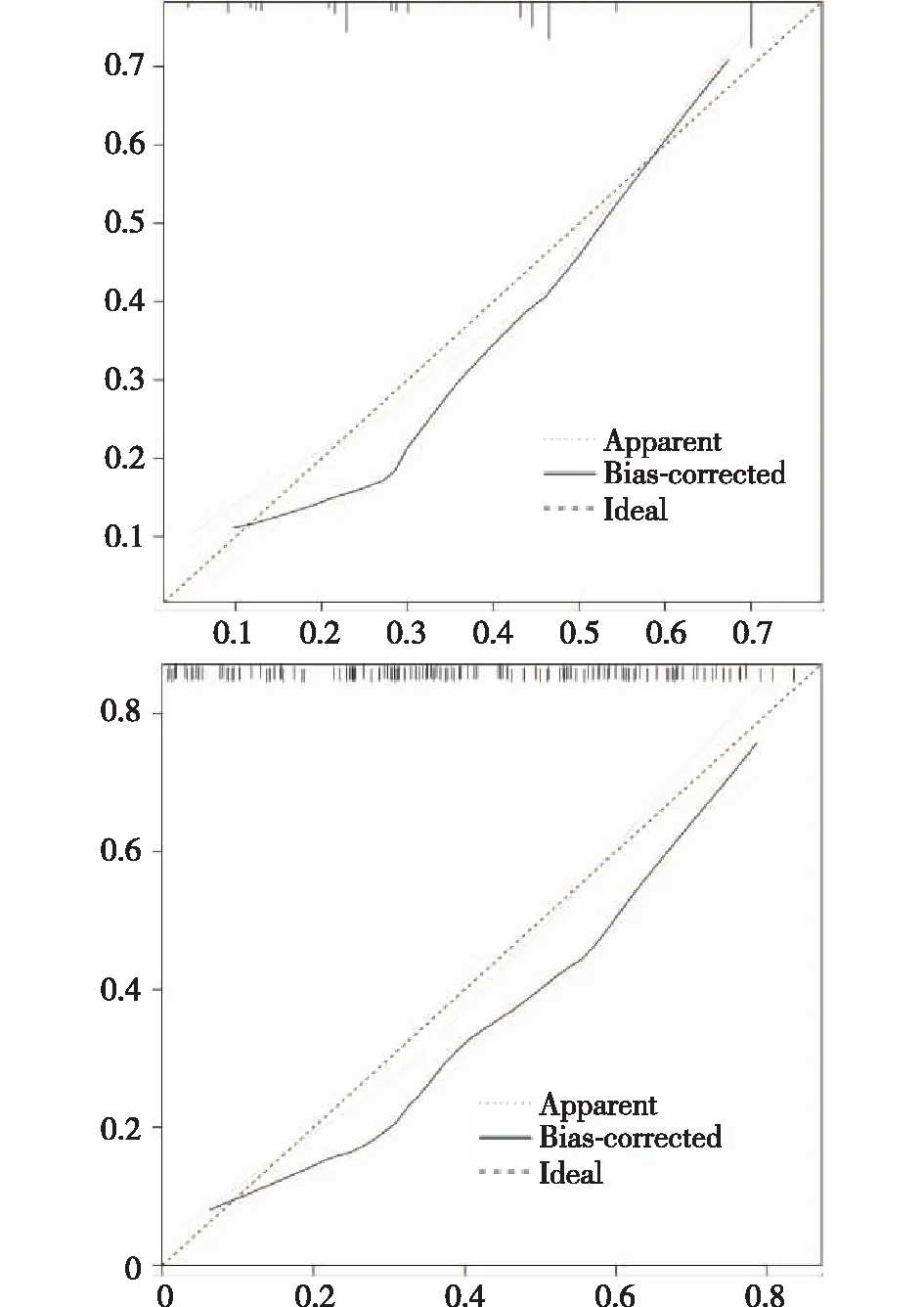
圖2 列線圖的校準曲線
2.4 列線圖模型的臨床可用性評價 DCA顯示閾概率范圍為0.10~0.85時,模型表現為正的凈效益,見圖3。圖中兩條線代表兩種極端情況,標“None”的橫線表明所有病人均無營養不耐受,且未進行干預,獲得的效益為0,標“All”的斜線表示所有病人均出現營養不耐受,且均進行干預所獲得的效益。紅色的線是采用重癥腦卒中病人腸內營養不耐受的預測模型將病人分為喂養不耐受組與喂養耐受組所獲得臨床效益。
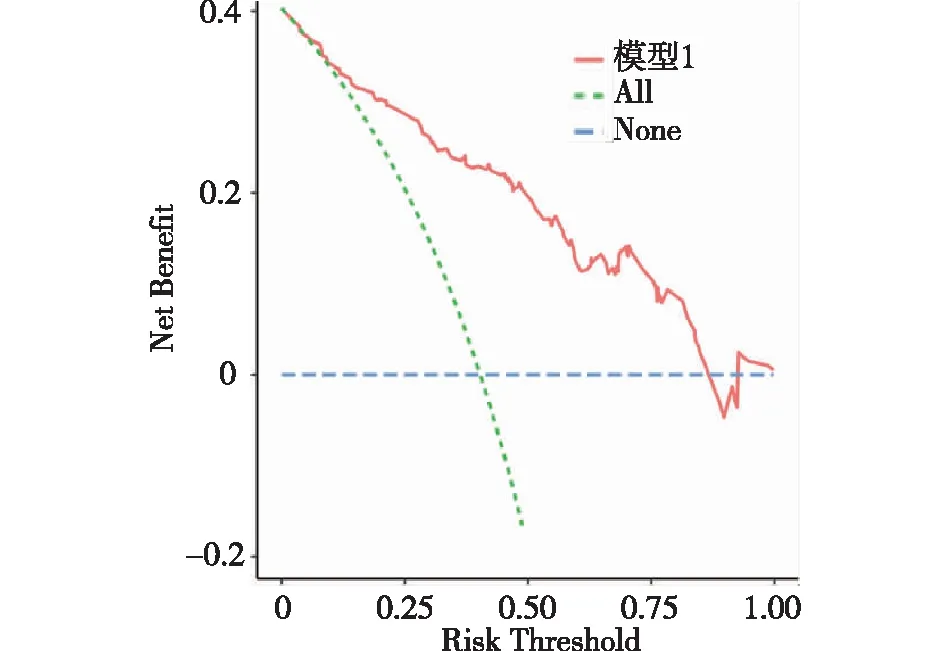
圖3 DCA曲線
2.5 列線圖模型推廣 通過對模型進行驗證,本課題組認為該列線圖能夠對腦卒中病人腸內營養不耐受發生風險進行良好評估,為臨床治療決策提供一定參考價值。考慮到圖形及數字公式在臨床實際工作中應用難度相對較大,本課題組通過“DynNom”程序開發了一個可視化動態列線圖模型(https://changshengzi.shinyapps.io/intolerance/),可通過網頁進行操作,使用者即使沒有R語言基礎也可輕松操作。
3 討論
3.1 重癥腦卒中病人腸內營養不耐受現狀及研究意義 臨床報道指出,危重癥病人喂養不耐受發生率在2%~75%之間[11-12]。本研究結果顯示,重癥腦卒中病人喂養不耐受發生率為37.94%(107例),其中71.96%發生于腸內營養后1~3 d,主要癥狀為單純腹瀉與胃潴留。原因可能在于腦卒中病人神經系統受到重創,機體應激反應劇烈,交感神經興奮性高,因此循環中兒茶酚胺分泌較多,因此腸內營養時易出現胃腸動力紊亂。此外,由于昏迷或吞咽障礙病人食管括約肌松弛,胃排空緩慢,因此會出現不同程度胃潴留[13]。腸內營養后1~3 d為喂養不耐受高發期,因此該階段應加強喂養不耐受監測,以確保腸內營養安全有效進行。既往有關腦卒中病人喂養不耐受的研究主要為探究其危險因素,但對于喂養不耐受的預防指導仍顯不足。
腦卒中腸內營養不耐受預測模型的建立將出現癥狀后的干預轉變為自主篩查,并進行預防性護理。列線圖模型為臨床常用的預測模型,可將各影響因素對喂養不耐受的影響程度以分值形式呈現,有助于醫護人員及時將喂養不耐受的高危病人篩選出來,具有一定的研究價值。
3.2 重癥腦卒中病人腸內營養不耐受風險相關因素分析 本研究顯示,年齡≥60歲、使用2種以上抗菌藥物、實施機械通氣是腦卒中病人腸內營養不耐受的獨立危險因素,使用益生菌為保護因素。隨著年齡增長,機體各臟器功能出現不同程度減退,包括反射功能、吞咽功能,因此易出現誤吸。同時,年齡較大病人腸黏膜萎縮,胃腸功能退化,且多數伴隨基礎疾病,影響胃腸道黏膜血流灌注,因此喂養過程中易出現胃腸道不良反應。
使用2種以上抗菌藥物可使喂養不耐受風險升高2.749倍,列線圖顯示其影響權重為97分。研究表明,廣譜抗菌藥物的大量不合理使用可殺滅腸道有益菌,使宿主微生態的平衡遭到破壞,進而引起人體腸道菌群失調[14]。同時,還可引起腸道耐藥菌株增殖,破壞腸道生物屏障,引起腹瀉等喂養不耐受癥狀。Martinez等[15]報道指出,大量抗生素的使用可破壞正常的腸道微生態系統,增加喂養不耐受發生風險。益生菌具有改善人體消化道菌群狀態,促進腸道屏障功能修復的作用。本研究顯示,益生菌為喂養不耐受的保護因素,列線圖顯示未使用益生菌的影響權重增加70分。但也有研究顯示,使用益生菌與不使用益生菌的病人在喂養不耐受發生率方面無明顯差異[16],與本研究結果不一致,這可能與研究對象不一致有關。
列線圖顯示,實施機械通氣治療的影響權重為95分。陳瑩等[17]的研究表明,42.71%的機械通氣病人會出現急性胃腸損傷。機械通氣為重癥病人常見治療支持手段,呼氣末正壓通氣與喂養不耐受密切相關。高水平呼氣末正壓通氣可增加胸腔壓力,導致心輸出量減少,靜脈回流阻力增加,胃腸灌注不足,引起胃腸道缺血、腸道屏障功能受損。既往研究顯示,腸內營養病人出現胃腸道并發癥可能與高水平呼氣末正壓通氣誘發肺內炎性因子釋放有關[18]。Dagar等[19]的研究表明,以較低的氣道峰壓正向誘導內臟血流灌注,可能會在一定程度上減少機械通氣相關的喂養不耐受。機械通氣病人胃排空延遲,耐受性下降,也是影響喂養不耐受的重要因素。
3.3 重癥腦卒中病人腸內營養不耐受列線圖預測模型驗證及臨床應用建議 本研究對模型進行驗證,內部驗證與外部驗證顯示,校準曲線均趨近于理想曲線,列線圖模型預測腸內營養不耐受具有良好的區分度與一致性。模型總分≥200分的病人應引起醫護人員重視,并積極進行干預。DCA顯示閾概率范圍為0.10~0.85時,模型表現為正的凈效益。提示該模型具有較高的臨床實用價值。列線圖模型能夠實現對腸內營養不耐受的評估,但仍存在一定缺陷,精確的數值主要通過尺子丈量,尤其是對于連續變量的測量易出現誤差。動態列線圖網頁版不需要使用者一個個加分,僅通過點擊幾下操作即可獲得精確的預測風險值,從而更直觀反映個體發生腸內營養不耐受的風險。但目前生成的動態列線圖網頁版部署在shinyapps.io上,主要缺點就是shinyapps.io服務器在國外,所以訪問速度對于國內用戶而言會有點慢,因此后期我們會嘗試將其部署在國內阿里、騰訊等服務器上。
綜上所述,基于重癥腦卒中病人腸內營養不耐受的危險因素建立的列線圖模型具有良好的區分度與一致性,對于模型總分≥200分的高危病人應給予高度關注,盡早實施預防性干預,以減少腸內營養不耐受的發生。但本研究仍存在以下不足:(1)本研究屬于回顧性研究,存在一定信息偏倚,會影響結果的準確性;(2)本研究為單中心研究,代表性存在一定不足,會影響結果的外推性;(3)由于樣本量較少,本研究在模型驗證方面僅采用內部驗證,未將數據分割成訓練集和驗證集,因此模型雖然在本研究中效果較好,但是否在驗證集中也有較好效果,尚不得而知。因此,下一步,本課題組將擴大樣本量,并聯合多家外部單位開展前瞻性驗證,完善并改進重癥腦卒中病人腸內營養不耐受發生風險的列線圖模型,以更好地指導臨床醫護人員。

