新型冠狀病毒肺炎無癥狀感染者的臨床與免疫學特征分析
申 川,秦 浩,馬路園,李星宇,宋枚芳,張云濤,高會霞,王 洋,戴二黑,趙彩彥
新型冠狀病毒肺炎(coronavirus disease 2019, COVID-19)是由嚴重急性呼吸綜合征冠狀病毒2型(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)引起的一種以病毒性肺炎為突出表現的全身感染性疾病。截至到2022年7月26日,已導致全球200個以上的國家和地區超過5.6億人感染,死亡人數達637萬人[1],嚴重影響了全球社會經濟活動與人類的生活,也造成了巨大的經濟損失。COVID-19的疾病譜中除包括輕型、普通型、重型、危重型患者外,還存在一部分“無癥狀”感染者。這些感染者無明顯臨床癥狀,尤其在聚集性感染病例中較為常見,常通過密切接觸者篩查、聚集性疫情調查、傳染源追蹤調查發現,極易被忽視,且作為隱匿傳染源可造成疫情廣泛傳播。本研究通過分析河北省COVID-19救治定點醫院(石家莊市第五醫院)2020年1月22日—6月22日期間確診的COVID-19患者的臨床資料,初步探討COVID-19無癥狀感染者的臨床特征和宿主T淋巴細胞亞群、細胞因子/趨化因子譜的特征,完善對COVID-19疾病譜及致病機理的認識,為疫情防控提供理論依據。
1 對象與方法
1.1 對象 選取2020年1月22日—6月22日石家莊市第五醫院收治的59例COVID-19患者作為研究對象,同時選取24例健康者作為對照組。本研究通過河北醫科大學第三醫院(科2020-009-1)、石家莊市第五醫院(2020013)倫理委員會審核批準,所有研究對象均知情同意并簽屬知情同意書。
1.2 方法
1.2.1 信息收集 收集59例COVID-19患者的人口學(年齡、性別等)資料、流行病學特征、臨床表現、胸部CT等臨床資料。
1.2.2 納入、排除標準 納入標準:參照《新型冠狀病毒感染的肺炎診療方案(試行第八版)》[2],COVID-19患者須具有流行病學史,咽或鼻拭子SARS-CoV-2核酸檢測陽性,伴或不伴臨床表現、COVID-19胸部CT特征。排除標準:①疑似患者;②由其他病原體導致的肺部或全身感染、自身免疫性疾病、惡性腫瘤者;③無癥狀感染者應該排除入組時尚處于潛伏期而無癥狀,但隨疾病進展出現相應臨床表現的輕型、普通型、重型/危重型COVID-19患者。
1.2.3 患者分組 根據《新型冠狀病毒感染的肺炎診療方案(試行第八版)》[2],將59例COVID-19患者分為4組:無癥狀感染組(n=28)、輕型組(n=6)、普通型組(n=19)、重型/危重型組(n=6)。無癥狀感染:核酸檢測陽性至核酸轉陰,自始至終不出現任何癥狀、體征和影像學表現。輕型:臨床癥狀輕微,影像學檢查未見COVID-19表現。普通型:具有發熱、呼吸道等癥狀,影像學檢查可見COVID-19表現。重型:符合以下情況之一者,①出現氣促,呼吸頻率≥30 次/min;②靜息狀態下,吸氣時指氧飽和度≤93%;③動脈氧分壓(PaO2)/吸氧濃度(FiO2)≤300 mmHg;④臨床癥狀進行性加重,胸部影像學顯示24~48 h內病灶明顯進展(>50%)。危重型:符合以下情況之一者,①出現呼吸衰竭,且需要機械通氣;②出現休克;③合并其他器官功能衰竭,需ICU監護治療。因重型、危重型患者例數較少,故將其合并為重型/危重型組。
1.2.4 標本采集與處理 留取59例COVID-19患者EDTA-K2抗凝管靜脈血標本用于檢測T細胞亞群計數;留取59例COVID-19患者和24例健康對照者的促凝管靜脈血標本,分離血清后,置于-80 °C冰箱保存,檢測細胞因子和趨化因子水平。首次血液標本采集在入院48 h(治療前)內完成,根據臨床診治需要,部分患者同時采集入院第(14±2)d(治療后)血液標本。全部檢測均在符合生物安全要求的實驗室完成。
1.2.5 T細胞亞群計數檢測 取EDTA-K2抗凝血50 μl置于流式細胞管,加入 10 μl TriTESTCD3-PerCP/CD4-FITC/CD8-PE抗體,室溫避光溫育15 min,加入溶血素2 ml,溫育15 min后離心,PBS洗滌2次,用FACS-Canto II流式細胞儀(美國BD公司)檢測T細胞亞群計數。
1.2.6 血清細胞因子和趨化因子檢測 用Procarta Plex多細胞因子檢測系統(美國Thermo Fisher公司)檢測血清中25種細胞因子:IFN-α、IFN-γ、TNF-α、TNF-β、IL-1α、IL-1RA、IL-1β、IL-2、IL-4、IL-5、IL-6、IL-7、IL-9、IL-10、IL-12p70、IL-13、IL-15、IL-17A、IL-18、IL-21、IL-22、IL-23、IL-27、IL-31、 粒 細 胞 -巨噬細胞集落刺激因子(granulocyte macrophage colony stimulating factor, GM-CSF)及9種趨化因子:IL-8、干擾素誘導蛋白10(interferoninducible protein-10, IP-10)、嗜酸性粒細胞趨化因子(Eotaxin)、生長調節致癌基因(growthrelated oncogene, GRO)-α、單核細胞趨化蛋白-1(monocyte chemotactic protein 1, MCP-1)、巨噬細胞炎性蛋白(macrophage inflammatory protein, MIP)-1α、MIP-1β、基質細胞衍生因子(stromal cell derived factor, SDF)-1α、調節激活正常T細胞表達和分泌的趨化因子(regulated upon activation normal T-cell expressed and secreted, RANTES)的水平。具體方法為:將50 μl磁珠加入微孔板,離心棄去液體后,每孔加入25 μl緩沖液和25 μl樣品或標準品,室溫反應60~120 min,清洗微孔板2次,加入25 μl檢測抗體混合液溫育30 min后洗滌,再加入鏈霉親和素-熒光色素偶聯物溫育30 min。采用LuminexTM200流式熒光檢測儀讀取數據。
1.3 統計學處理 用SPSS 26.0軟件進行統計分析。計數資料以例數(%)表示,組間比較采用χ2檢驗。呈正態分布的計量資料以±s 表示,呈偏態分布的計量資料以M(P25,P75)表示,多組間總體差異比較采用Kruskal-Wallis H檢驗,組間比較采用Bonferroni法校正。配對設計采用Wilcoxon符號秩和檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 人口學數據和臨床特征 59例COVID-19患者中,男性37例,女性22例,年齡31.0(22.0,49.0)歲;各組患者性別比較差異無統計學意義(χ2=0.716,P=0.869)。各組患者年齡比較,差異具有統計學意義(H=17.787,P=0.001),其中無癥狀感染組[23.0(19.3,34.8)歲]顯著低于普通型組[35.0(24.0,52.0)歲]和重型/危重型組[64.5(52.0,68.3)歲](P均<0.05),而與輕型組[25.0(21.0,46.3)歲]比較,差異無統計學意義(P>0.05)。無癥狀感染組患者均無臨床癥狀和特異性胸部CT病變,而普通型組、重型/危重型組具有不同程度的發熱、乏力及呼吸道癥狀等,且至少存在累及1個肺葉的影像學改變。所有COVID-19患者均康復出院,無死亡病例,見表1。
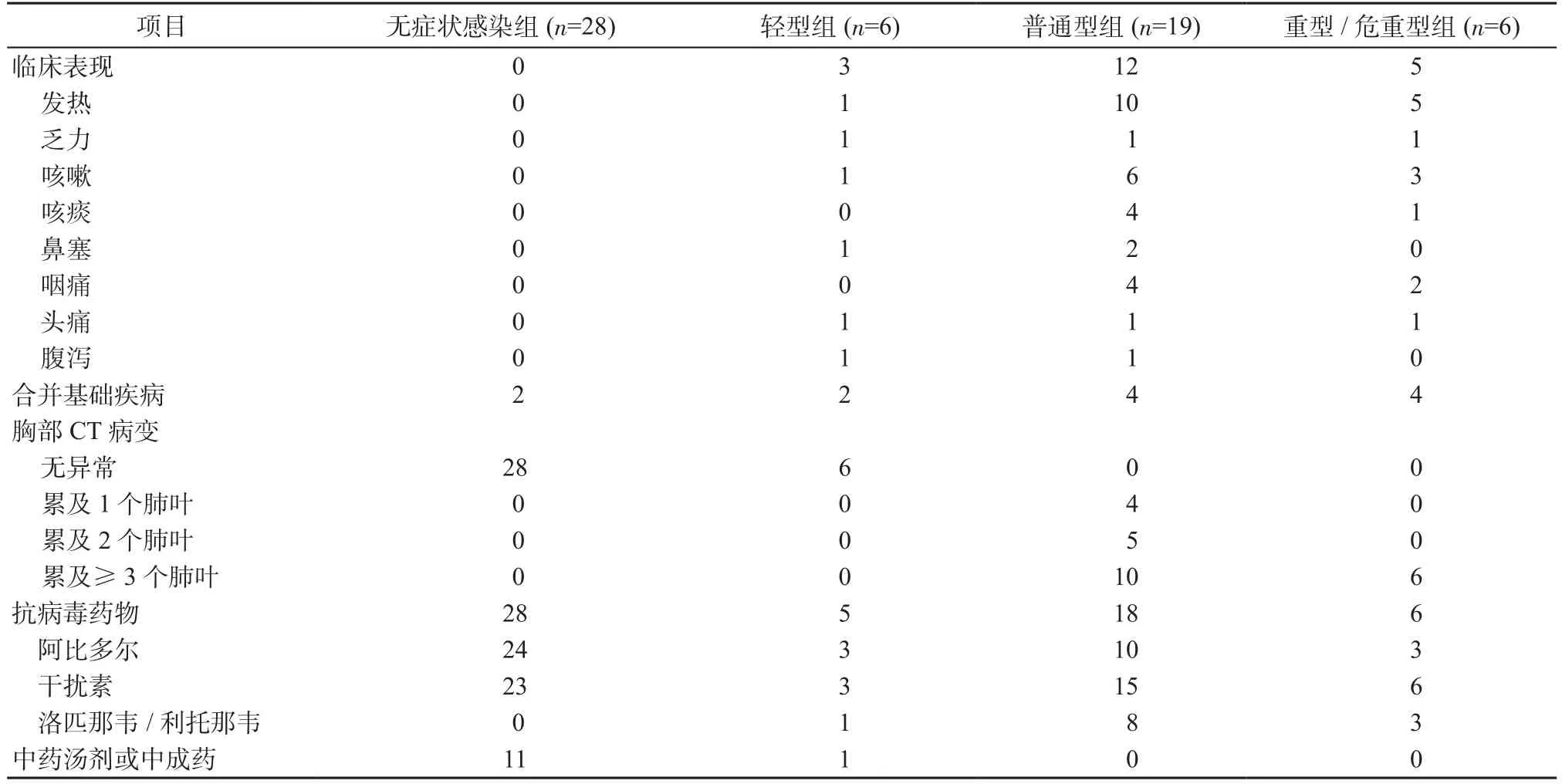
表1 COVID-19患者的臨床特征(例)Table 1 Clinical characteristics of patients with COVID-19 (cases)
2.2 各組COVID-19患者治療前T細胞亞群計數的比較 所有COVID-19患者入院首次T細胞亞群檢測結果顯示:無癥狀感染組10例(35.7%)、輕型組0例、普通型組13例(68.4%)、重型/危重型組6例(100%)患者的CD4+T細胞計數低于正常值下限(參考范圍:550~1440個/μl);無癥狀感染組3例(10.7%)、輕型組0例、普通型組2例(10.5%)、重型/危重型組5例(83.3%)患者的CD8+T細胞計數低于正常值下限(參考范圍:320~1250個/μl)。無癥狀感染組外周血CD4+T細胞、CD8+T細胞計數均顯著高于重型/危重型組(P均<0.05),與輕型組比較差異均無統計學意義(P均>0.05),無癥狀感染組CD4+T細胞計數顯著高于普通型組(P<0.05),見表2。

表2 各組COVID-19患者治療前T細胞亞群計數的比較[M(P25,P75)]Table 2 Comparison of T-cell subsets in patients with various types of COVID-19 before treatment [M (P25, P75)]
2.3 各組COVID-19患者治療前與治療后T細胞亞群計數差值的比較 無癥狀感染組14例、普通型組13例、重型/危重型組6例患者在入院后第(14±2)d進行了第2次外周血T細胞亞群檢測。與治療前相比,治療后無癥狀感染組4例(28.6%)、普通型組11例(84.6%)、重型/危重型組4例(66.7%)患者CD4+T細胞計數升高;無癥狀感染組8例(57.1%)、普通型組10例(76.9%)、重型/危重型組5例(83.3%)患者CD8+T細胞計數升高。14例無癥狀感染組患者治療前與治療后CD4+T細胞和CD8+T細胞計數比較,差異均無統計學意義(P均>0.05),見表3。普通型組、重型/危重型組治療后CD4+T細胞、CD8+T細胞計數均較治療前有不同程度的回升,但僅CD4+T細胞計數在上述2組中的上升幅度顯著高于無癥狀感染組的變化幅度,差異具有統計學意義(P均<0.05),見表4。

表3 14例無癥狀感染者治療前和治療后T細胞亞群計數的變化[M(P25,P75)]Table 3 Changes of T cell subsets in 14 asymptomatic infected patients before and after treatment [M (P25, P75)]

表4 各組COVID-19患者治療前后T細胞亞群計數差值的比較[M(P25,P75)]Table 4 Comparison of T cell subpopulation count differences between patients with various types of COVID-19 before and after treatment [M (P25, P75)]
2.4 各組COVID-19患者治療前細胞因子和趨化因子表達譜的比較 無癥狀感染組24例、普通型組15例、重型/危重型組6例患者和24例健康對照者進行了外周血細胞因子和趨化因子的檢測。統計發現,在34種細胞因子和趨化因子中,23種在COVID-19患者及健康對照者中不能被檢測到,故未進行統計學分析。不同臨床分型COVID-19患者及健康對照者的血清細胞因子和趨化因子水平見圖1。無癥狀感染組血清IL-7水平顯著高于對照組(P<0.05),雖低于普通型組、重型/危重型組患者,但差異均無統計學意義(P均>0.05)。無癥狀感染組血清IP-10水平均顯著低于普通型組、重型/危重型組(P均<0.05),但與對照組相比,差異無統計學意義(P>0.05)。

圖1 各組COVID-19患者和對照組血清11種細胞因子和趨化因子水平直條矩形柱代表中位數,誤差線代表四分位數間距;Kruskal-Wallis H檢驗比較多組間總體差異,IL-7:H=10.230,P=0.017;IL-8:H=1.101,P=0.777;IL-18:H=2.293,P=0.514;Eotaxin:H=2.152,P=0.411;GRO-α:H=2.797,P=0.424;IP-10:H=18.355,P=0.001;MCP-1:H=2.703,P=0.440;MIP-1α:H=2.271,P=0.518;MIP-1β:H=3.777,P=0.287;SDF-1α:H=7.393,P=0.060;RANTES:H=2.002,P=0.672;a. 與對照組比較,P<0.05;b. 與普通型組比較,P<0.05;c. 與重型/危重型組比較,P<0.05Figure 1 Serum levels of 11 cytokines and chemokines in patients with COVID-19 in each group and control group
3 討 論
COVID-19無癥狀感染者是指沒有可以自覺感知的相關臨床表現如發熱、咳嗽、咽痛或可以臨床識別的癥狀和體征,而從呼吸道等標本中檢測出SARS-CoV-2核酸陽性的一組人群[3-4]。研究發現,2020年COVID-19疫情早期時無癥狀感染者的占比在1.6%~59.0%之間[5-6];2021年廣州暴發的德爾塔變異株疫情,無癥狀感染者占比為4.6%[7];2022年上海奧密克戎變異株疫情中,無癥狀感染者高達90%以上[8]。這提示隨著SARS-CoV-2病毒株的不斷進化,病毒毒力下降,加之疫苗的廣泛接種后形成免疫屏障,無癥狀感染者成為最主要的感染類型。無癥狀感染者因具有高度的隱匿性,早期識別困難,常在密切接觸者篩檢、聚集性疫情調查、對有境內外SARS-CoV-2持續傳播地區旅行或居住史的人員開展主動核酸檢測時發現,因此探索無癥狀感染者的臨床及免疫學特征,有助于及時發現和遏制疫情傳播。
本研究顯示,COVID-19無癥狀感染者主要集中在青年人群,較少伴有基礎疾病,而普通型主要為中青年患者,重型/危重型更多見于老年患者,提示COVID-19的嚴重程度有年齡分布差異,這與其他一些研究的結果一致[9-11]。老年患者因免疫防御功能障礙、免疫衰老、發生免疫病理損傷的風險增高,使其發生重型、危重型COVID-19病例的比例顯著增高,并導致較高的病死率[12]。而年輕患者的T細胞和B細胞功能較強,能更好地控制病毒復制,同時減輕機體的炎癥反應,使得患者未出現臨床癥狀[13]。世界衛生組織的報告顯示全球70萬例COVID-19患者的男女比例為1.03:1,而本研究也未發現COVID-19嚴重程度存在性別差異。
既往研究證實,潛伏期無癥狀感染者與持續無癥狀感染者具有不同的免疫表型,如CD8+初始T細胞、CD107alow經典單核細胞、過渡型單核細胞等亞群比例降低,并存在單核細胞過渡活化和分化抑制現象,提示2種“無癥狀”具有截然不同的進展方向[14]。本研究在納入無癥狀感染者作為研究對象時,排除了處于潛伏期的COVID-19輕型、普通型、重型/危重型患者,只納入屬于持續無癥狀感染者,因此能真實反映該類型患者的免疫狀態。
宿主免疫功能是決定感染性疾病臨床轉歸的決定性因素之一。與前期一些研究結果相同,本研究也觀察到CD4+和CD8+T細胞計數在COVID-19患者中隨疾病進展明顯降低,尤其是CD4+T細胞更為顯著[11,15]。在SARS-CoV-2感染后,適應性免疫系統的輔助性T細胞、殺傷性T細胞及體液免疫的協同作用對疾病的預后和轉歸具有重要作用[16]。抗原特異性CD4+T細胞較CD8+T細胞介導的免疫應答對早期的病毒控制更為關鍵,無癥狀感染者被發現擁有更多具有功能性的抗原特異性CD4+T細胞[17],因此與較快的病毒清除和較輕的臨床癥狀密切相關。同時,無癥狀感染者存在豐富的T細胞受體克隆,以及效應T細胞中干擾素刺激基因、細胞毒活性相關基因等的表達上調也對病毒的控制發揮重要作用[17-18]。本研究還發現,無癥狀感染者在治療前后外周血CD4+T細胞計數差值未見明顯上升甚至部分患者略有下降,這可能與免疫細胞上鞘氨醇-1及趨化因子受體的表達升高,促進免疫細胞向次級淋巴組織及肺組織遷移有關,從而有利于肺部SARS-CoV-2的清除同時避免嚴重的免疫炎癥損傷[17]。
COVID-19危重型患者常出現免疫的過度激活、細胞因子風暴,表現為血清中多種細胞因子水平的顯著增加,如IL-2、IL-6、IP-10、IP-10/CXC-10、MCP-1/CCL-2、GM-CSF、MIP1α/CCL3和TNF-α等[19]。這種過度的免疫反應導致免疫損傷,引起多器官功能障礙甚至衰竭死亡。但無癥狀感染者的細胞因子表達譜的特點在不同研究中差異較大[20]。本研究共檢測34種細胞因子和趨化因子,發現COVID-19患者外周血IL-7和IP-10水平明顯升高,且變化趨勢隨疾病嚴重程度遞增。IL-7的產生相對恒定,其水平主要由T細胞消耗控制,外周血IL-7水平的升高預示著T細胞庫的消耗,實質是對淋巴細胞減少產生的負反饋[21],故重型/危重型患者升高幅度最大。IP-10屬于趨化因子CXC家族,可以通過激活機體免疫系統抵抗病毒抑制病毒復制。IP-10在單核巨噬細胞、活化的成纖維細胞、內皮細胞、淋巴細胞等多種免疫細胞表達,具有趨化炎癥細胞、促進炎癥因子釋放、參與機體免疫調節等功能。與既往的研究結果一致,IP-10在COVID-19重型/危重型患者中顯著升高,但在無癥狀感染者中未見明顯變化,提示IP-10與COVID-19疾病嚴重程度相關,是反映疾病進展的一種重要趨化因子[22]。
本研究尚具備一定的局限性,如樣本量偏小,尤其是輕癥、重癥、危重癥患者例數較少,可能使研究結果對上述臨床分型的代表性下降,同時因隨訪時間相對較短,未能觀察到SARS-COV-2不同分型感染者的遠期預后和轉歸。其次,因傳染病標本檢測的特殊性,本研究未能進一步對其他免疫細胞亞群(如B細胞、NK細胞、單核細胞等)、活化標記、效應功能等進行檢測。上述問題有待于更深入的研究進一步闡明。
綜上,COVID-19無癥狀感染者以青年為主,但未發現與性別因素相關。外周血T細胞亞群計數、細胞因子和趨化因子水平隨COVID-19嚴重程度而變化,但在無癥狀感染者中未見顯著改變,提示COVID-19無癥狀感染者通過適度的免疫應答實現SARS-CoV-2清除與避免免疫病理損傷的平衡。

