谷氨酸棒桿菌細胞工廠構建與應用的研究進展
上官玲玲,盧慧芳,夏會麗,陳雄,2,代俊,2,3,4*
1(湖北工業大學 生物工程與食品學院,湖北 武漢,430068)2(發酵工程教育部重點實驗室(湖北工業大學), 湖北 武漢,430068)3(工業發酵湖北省協同創新中心(湖北工業大學),湖北 武漢,430068) 4(工業微生物湖北省重點實驗室(湖北工業大學),湖北 武漢,430068)
谷氨酸棒桿菌(Corynebacteriumglutamicum)為革蘭氏陽性菌,具有兼性厭氧、無芽孢、生長速度快、無致病性等特點。在20世紀50年代后近半個世紀被廣泛用于各種L-氨基酸的大規模生產,如L-谷氨酸、L-賴氨酸、L-絲氨酸、L-蘇氨酸等[1]。該菌株的實用性范圍不斷擴大,除了生產L-氨基酸外,還被用于生產有機酸、生物燃料、萜類化合物及芳香族化合物等[2]。目前該菌株已成為工業生產的模式微生物之一,被廣泛用于微生物細胞工廠的構建。
為了提高谷氨酸棒桿菌的性能和生產效率,常采用新技術對菌株進行誘變、篩選和改造。如通過常壓室溫等離子體等新型誘變技術使菌株對環境的耐受性提高,同時菌株對底物的利用率及一些代謝物質增加;利用新型的高通量篩選技術加速菌株的開發及提高篩選效率;采用基因編輯技術實現有機酸、生物燃料、萜類化合物等一系列增值化合物的生產。因此,新技術的應用能促使谷氨酸棒桿菌成為最有希望的微生物細胞工廠之一[3]。
傳統的谷氨酸棒桿菌發酵一般采用成本較高的淀粉類糧食為原料,在進行大規模工業化生產時不利于節約成本[4]。目前研究者采用合成和系統代謝工程的方法,以微生物為底盤細胞,利用可再生原料合成一些大宗或精細化學品,并通過馴化和基因改造等手段可進一步提高可再生原料預處理水解液中抑制物的耐受性,最終擴大菌株對纖維素等可再生資源底物的利用[5]。
本文針對谷氨酸棒桿菌新型誘變技術、高通量篩選技術、基因編輯技術及其高附加值產品的生產情況進行綜述,并總結了高效的谷氨酸細胞工廠能利用可再生原料生產高附加值產品的實例,為研究構建多功能谷氨酸棒桿菌細胞工廠,利用新原料生產高附加值產品提高參考(圖1)。
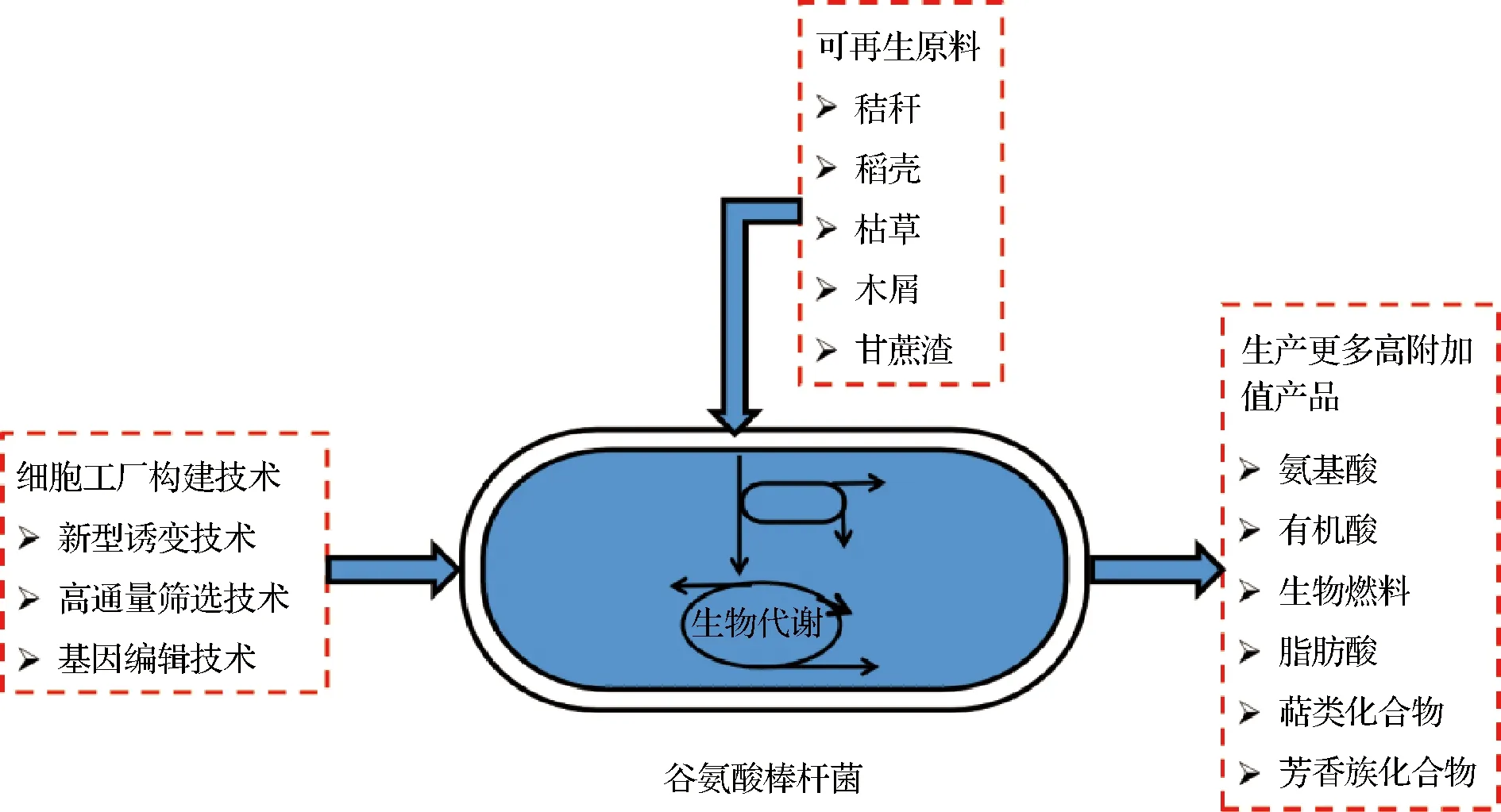
圖1 谷氨酸棒桿菌多功能細胞工廠的構建[6]Fig.1 Construction of C.glutamicum multifunctional cell factory[6]
1 構建細胞工廠的新技術
1.1 新型誘變技術
誘變技術普遍應用于菌株選育,主要分為物理誘變、化學誘變和生物誘變等3大類[7]。傳統的誘變技術如紫外誘變或使用化學誘變劑誘變等,存在安全風險和效率低等問題,制約著細胞工廠的發展。近年來,涌現出多種新型高效誘變技術例如常壓室溫等離子體(atmospheric and room temperature plasma,ARTP)、重離子輻射和復合誘變等(表1)。這些新型誘變工具與傳統的誘變技術相比不僅安全可靠,還加速了微生物細胞改良效率。

表1 新型誘變技術在谷氨酸棒桿菌選育中的研究成果Table 1 Research results of novel mutagenesis techniques in the breeding of C.glutamicum
ARTP誘變技術是一種新型物理誘變技術。它在常溫下發射高活性粒子濃度的等離子體射流作用于菌株,使細胞膜的結構改變并誘發細胞啟動SOS修復機制,修復過程所產生的錯配位點能使 DNA 序列顯著變化,最終使菌株突變[8]。該技術操作方便、安全高效、條件溫和、環境友好[9],并能顯著提高目標產物。ARTP誘變后谷氨酸棒桿菌能高產氨基酸或有機酸等,如孔帥等[10]以C.glutamicum23798為出發菌株經ARTP誘變后獲得高產L-異亮氨酸的突變體,L-異亮氨酸在搖瓶中的產量為18.5 g/L,比原始菌株提高62.03%,且遺傳性狀穩定。該技術成為提高谷氨酸棒桿菌對酸、堿、溫度、有毒副產物等耐受性的新手段。
重離子輻照是一種高效人工電離技術,該技術作用于生物體細胞時會發生物理能量轉移、化學結構改變和生物學效應[11]。與傳統的紫外線射線、γ射線或X射線的誘變技術相比,重離子輻照表現出損傷較低、突變廣及突變效率高等優勢,而且重離子輻照的深度及部位均能精確控制,使突變更具方向性[12]。隨著核物理學的不斷進步,重離子輻照技術在高等植物育種方面取得了較大的進展,也逐漸被用于谷氨酸棒桿菌性能改良,如楊陽[13]以谷氨酸棒桿菌為出發菌株,利用12C6+離子束對其進行輻照誘變,經24孔板初篩和搖瓶復篩后獲得一株谷氨酸高產菌株,產酸為90.25 g/L,較出發菌株提高9.1%。
復合誘變是一種通過物理、化學多因子組合的細胞誘變方法,一般是2種或以上物理或化學誘變因子結合。該技術具有基因突變類型豐富、突變范圍廣、變異穩定等特點,并能彌補不同誘變技術之間存在的缺陷。在微生物細胞工廠選育方面,單一的誘變手段所產生的基因突變相對單一,不能滿足基因突變類型的豐富性和菌株變異的穩定性。復合誘變技術有利于打破單一誘變存在的局限性,已成為現代誘變技術的主流,在谷氨酸棒桿菌提高目標產物方面也得到了廣泛應用[14]。
1.2 高通量篩選技術
傳統的篩選技術需要進行人工分離、純化及搖瓶培養等步驟,因繁瑣、費力和低效制約著細胞工廠的發展進程[14]。先進的高通量篩選技術越來越多地應用于細胞工廠的有效構建,如基于顏色或熒光的激活細胞分選(fluorescence-activated cell sorting,FACS)、以液滴流體為平臺的液滴微流控分選(droplet-based microfluidic sorting,DMFS)及基于生物傳感器的篩選等(表2),在很大程度上提高了突變庫中的篩選效率。
FACS是一種高通量篩選細胞內帶有熒光物質的方法,它能在高達109個的突變體文庫中快速篩選。例如,ZHANG等[19]在菌種經ARTP誘變之后,利用FACS監測谷氨酸棒桿菌中單細胞內L-絲氨酸的濃度,從而在1.2×105的誘變體文庫中篩選出一株高產L-絲氨酸的菌株。因此,該技術適用于細胞膜或細胞內目標物的篩選。
DMFS是一種高通量篩選胞內外酶及代謝物的分選技術,其可以彌補 FACS 技術存在的不足,同時與傳統的高通量篩選技術比較,更大程度上降低篩選成本和時間。基于DMFS技術新開發的微生物微液滴培養儀(microbial microdroplet culture system,MMC),因具有自動化、微型化和智能化等優勢而被廣泛應用于細菌、酵母等單細胞微生物的篩選。該技術與誘變技術結合能更高效地獲得目標菌株。如鄧磊等[20]采用ARTP對出發菌株C.glutamicumATCC 14067進行誘變處理后,通過自動化的MMC系統結合平板選育具有組氨酸結構類似物的抗性菌株,然后經48孔板初篩及搖瓶復篩后得到一株L-組氨酸產量為(0.561±0.016)g/L的菌株,且穩定性良好。
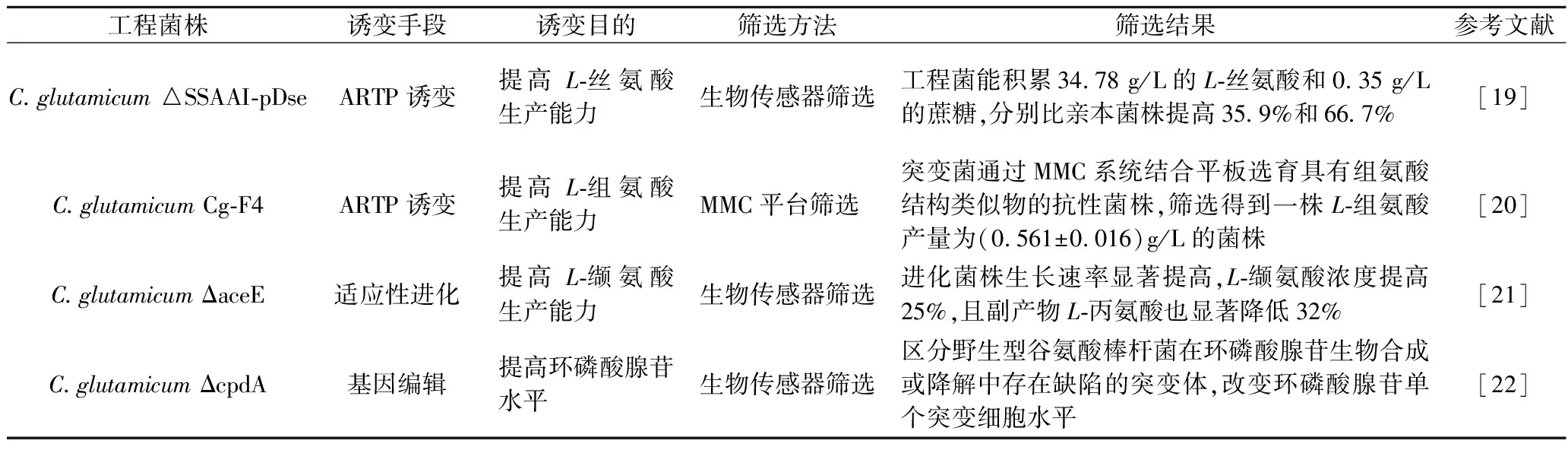
表2 高通量篩選技術在谷氨酸棒桿菌選育中的研究成果Table 2 Research results of high-throughput screening technology in the breeding of C.glutamicum
在突變文庫的篩選中,有些微生物在生產化學品時只有少部分能通過顏色或熒光的方法直接篩選,大多數化學物質本身不具有顏色或熒光,甚至不易于染色。因此,科研人員開發出通過特定的識別元件來響應胞內特定代謝產物濃度的生物傳感器篩選技術,如以轉錄因子為識別元件構建的生物傳感器響應技術,轉錄因子能結合基因的啟動子獨自或與其他蛋白組成復合體,使其促進或阻斷RNA聚合酶參與轉錄過程來控制基因表達。細胞內的部分小分子代謝物能通過激活或者失活轉錄因子,控制相關基因的表達,從而將代謝物濃度與細胞生長等相關檢測信號聯系起來,達到高通量篩選的目的。目前,研究者利用轉錄因子開發響應不同代謝物的高通量篩選生物傳感器,可以響應氨基酸、脂質、糖磷酸等代謝物。
1.3 基因編輯技術
20世紀90年代初,谷氨酸棒桿菌質粒的分離和第一代DNA編輯技術的開發成為了谷氨酸棒桿菌基因改造的里程碑。21世紀初,德國和日本的學者公布了ATCC 13032 模式菌株的全基因組序列,奠定了谷氨酸棒桿菌基因改造的基礎[3]。截至2021年12月30日,美國國立生物技術信息中心(National Center for Biotechnology Information, NCBI)已收錄74株全基因組測序的谷氨酸棒桿菌,包括C.glutamicumS9114、C.glutamicumATCC 13032、C.glutamicumATCC 14067等。基因組時代的到來,轉變了科研人員依賴于誘變策略的育種模式,轉而采用理性策略改造和重構微生物細胞工廠中的代謝和網絡調控的方法[23],加速了基因編輯技術在谷氨酸棒桿菌中的應用和研究。
傳統的基因編輯技術效率低、耗時長,主要依賴于同源重組手段對目的基因進行缺失、突變和插入。JGER等[24]開發sacB的谷氨酸棒桿菌基因缺失方法。TAN等[25]對這種基因編輯進行改進,成功構建了質粒pDXW-3,構建該質粒需要2步同源重組,耗時較長。HU等[26]基于Cre/loxP介導的特異性位點建立了谷氨酸棒桿菌基因缺失系統,該系統由pDTW109、pDTW201和pDTW202三個質粒進行基因組編輯,用于敲除谷氨酸棒桿菌的目的基因,但這種方法會在基因組位點留下殘留序列。由此可見傳統的基因編輯方法雖然能進一步提高篩選效率,但會影響微生物細胞工廠的構建。
CRISPR/Cas(Clustered Regularly Interspaced Short Palindromic Repeats/CRISPR-associated proteins)的新系統可以解決耗時和效率低的問題。CRISPR序列于1978年被日本學者發現,2007年法國科學家證實了CRISPR/Cas的Cas蛋白在病毒抵御過程中的作用[27]。CRISPR/Cas 系統包括Class I和Class II兩大類,其中最新發展的Type II-CRISPR/Cas9因在設計和操作上簡單、高效、易操作、成本低被廣泛應用于微生物細胞工廠,如畢赤酵母、鏈霉菌、枯草芽孢桿菌、大腸桿菌等。但研究發現CRISPR/Cas9 系統攜帶Cas9基因的質粒在谷氨酸棒桿菌中難以轉化插入,說明該系統對谷氨酸棒桿菌有較大的毒性,需要通過嚴格調控Cas9蛋白降低毒性影響。CHO等[28]克服了該困難,通過對Cas9基因密碼子進行優化,成功降低了Cas9表達對細胞的毒性,并將其應用于谷氨酸棒桿菌細胞工廠的基因改造(表3)。

表3 基因編輯篩選技術在谷氨酸棒桿菌中的應用Table 3 Application of gene editing and selection technology in C.glutamicum
2 谷氨酸棒桿菌細胞工廠生產高附加值產品的應用
2.1 有機酸
谷氨酸棒桿菌早期主要用于生產各類氨基酸。隨著研究人員的不斷開發,其已從氨基酸生產的宿主發展成為一個多功能細胞工廠,能生產有機酸(琥珀酸、乳酸、α-酮戊二酸等)、生物燃料(3-甲基-1-丁醇、異丁醇等)、萜類化合物(類胡蘿卜素、香葉醇、朱欒倍半萜等)等多種產品(圖2)。下面主要對這幾類高附加值化合物的谷氨酸棒桿菌細胞工廠進行闡述。
有機酸是一類含有羧基的酸性化合物。可作為工業中的洗滌劑、硅影劑或食品的護色劑和防腐劑等。谷氨酸棒桿菌被認為是生產有機酸的菌株之一,通常在微氧或厭氧條件下合成琥珀酸、乳酸和α-酮戊二酸等化合物。
琥珀酸是重要的四碳平臺化合物,最早于1993 年發現琥珀酸能在供氧不足的谷氨酸棒桿菌中大量積累[33]。隨著科學的進步,研究者在谷氨酸棒桿菌合成琥珀酸方面進行了更深入的研究,OKINO等[34]通過過表達丙酮酸羧化酶的pyc基因,使L-乳酸脫氫酶的ldhA基因斷裂,并在厭氧條件下采用流加NaHCO3和葡萄糖的方式積累146 g/L琥珀酸。夏慧華等[35]在厭氧下過表達sucE琥珀酸輸出蛋白使琥珀酸得率和生產率分別提高7%和19%。研究者除了采用基因手段外,還結合關鍵代謝流提高琥珀酸產量,如CHUNG等[32]通過過表達NCgl0275下調解除終產物抑制使分批補料發酵的琥珀酸產量提高37.7%,達55.4 g/L,并進一步提高從磷酸烯醇式丙酮酸到草酰乙酸的代謝流量,最終使琥珀酸產量達到152.2 g/L。
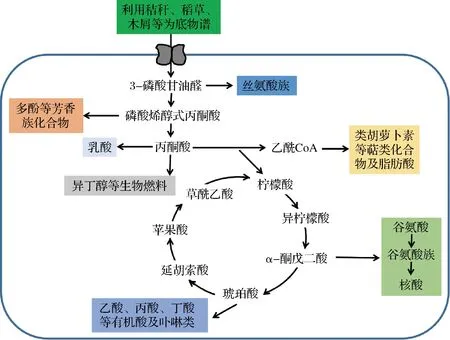
圖2 谷氨酸棒桿菌細胞工廠高附加值產品的生物合成途徑Fig.2 Biosynthetic pathways of high value-added products from C.glutamicum cell factories
除高產琥珀酸之外,谷氨酸棒桿菌也能同時大量積累乳酸和α-酮戊二酸等。如TSUGE等[36]利用代謝工程大量合成L-乳酸和D-乳酸,通過過表達糖酵解酶和葡萄糖激酶等6種酶的基因,使L-乳酸和D-乳酸濃度增加了146%和56%,再通過整合ED途徑中關鍵基因,進一步使L-乳酸和D-乳酸濃度分別提高了11%和44%,最后L-乳酸和D-乳酸的產量分別高達212 g/L和264 g/L。TENHAEF等[37]通過對谷氨酸棒桿菌Weimberg途徑的改造,使菌株WMB2evo在微氧條件下利用D-木糖生產α-酮戊二酸和琥珀酸,并通過補料分批工藝使α-酮戊二酸和琥珀酸產量分別為11.45 g/L和11.36 g/L。
2.2 生物燃料
生物燃料泛指由生物體組成或轉化的固體、氣體或液體燃料,被應用于食品、化工、醫藥等多個領域。在以微生物法生產生物燃料方面,以谷氨酸棒桿菌為底盤微生物已廣泛應用于生產3-甲基-1-丁醇、異丁醇等生物燃料。
3-甲基-1-丁醇是一種清潔、綠色和可再生的高級鏈醇能源。目前,作為汽油的理想補充或可持續替代品具有獨特的優勢,如它能以任何比例與汽油混合甚至完全取代汽油,與生物乙醇相比具有更高的能量密度和更低的吸濕性,且無腐蝕性,利于長期儲存。以谷氨酸棒桿菌發酵生產3-甲基-1-丁醇時,很多學者主要通過增強基因表達、擴增新基因功能或消除反饋抑制等增加通量的方法來構建高效生產3-甲基-1-丁醇的細胞工廠。ZHANG等[38]通過沉默谷氨酸棒桿菌中的aceE基因和敲除ldh基因,同時利用硫酸二乙酯對菌株進行誘變獲得谷氨酸棒桿菌突變體,使突變體的3-甲基-1-丁醇產量達659 mg/L。為了進一步將碳通量更多地引入3-甲基-1-丁醇合成途徑,還通過刪除ilvE基因構建沒有ilvE活性的工程菌,使菌株產量從659 mg/L提升至697 mg/L。VOGT等[39]通過突變ilvE基因的起始密碼子來降低其在谷氨酸棒桿菌中高產L-亮氨酸的活性,并抑制ldhA基因,實現aro10和yqhD的過表達,使改造后的菌株生產3-甲基-1-丁醇時,產量高達2.76 g/L。
異丁醇是一種新型生物燃料,具有廣闊的發展前景。研究發現,高細胞毒性是微生物法生產異丁醇面臨的巨大挑戰,而谷氨酸棒桿菌能耐受異丁醇,在好氧和厭氧條件下能成功地將前體物2-酮異戊酸轉化為異丁醇,實現高效生產。目前已有學者通過代謝工程對谷氨酸棒桿菌進行改造,使其能利用葡萄糖高產異丁醇,為構建高效生產異丁醇細胞工廠提供了新思路[40]。SMITH等[41]在構建谷氨酸棒桿菌合成異丁醇的細胞工廠中,通過敲除異丁醇合成途徑中的一系列基因,使丙酮酸進入異丁醇的通量進一步加大,最終使異丁醇的產量提高至 4.9 g/L。但以葡萄糖為碳源生產異丁醇時,因其成本高,不適用于工業化的大規模生產,朱年青等[30]對C.glutamicumATCC 13032進行改造,利用餐廚廢棄物為原料制備生產異丁醇的細胞工廠,通過基因敲除和強化合成途徑使異丁醇產量高達165 mmol/L。
2.3 萜類化合物
萜類化合物是一類以異戊二烯碳骨架作為基本單元的化合物及其衍生物,其功能多樣、種類繁多,在醫療、食品、保健品等領域具有很高的應用價值。谷氨酸棒桿菌因其自身具有獨特的優勢可作為生產復雜萜類化合物的底盤微生物,可通過改造和優化其代謝途徑來合成類胡蘿卜素和香葉醇等萜類化合物[2]。
類胡蘿卜素是一種四萜類化合物,廣泛存在于自然界中,如蝦青素、番茄紅素和β-胡蘿卜素等均屬于類胡蘿卜素。以谷氨酸棒桿菌為底盤微生物生產類胡蘿卜素時,一般通過基因表達調控手段來實現類胡蘿卜素的合成,HEIDER等[42]通過對類胡蘿卜素生物合成途徑進行基因工程研究,證明谷氨酸棒桿菌可以生產一系列不同的C40和C50類胡蘿卜素。蝦青素是一種C40萜類色素,可采用化學或生物手段合成,其中生物合成蝦青素更為安全。研究發現,在谷氨酸棒桿菌中代謝合成蝦青素前體物質的存在及其合成途徑中關鍵基因的確定,為構建高產蝦青素的細胞工廠提供了可能。番茄紅素是一種常用于醫藥和食品等行業的萜類化合物,可對谷氨酸棒桿菌內含的萜類色素合成途徑進行改造來合成大量番茄紅素,如DOMINGUEZ等[33]通過刪除谷氨酸棒桿菌ATCC 13032中的crtEb基因,使番茄紅素積累到(0.03±0.01) mg/g,同時過表達crtE、crtB、crtI基因將番茄紅素產量提高80倍,達(2.4±0.3)mg/g。
香葉醇是一種無環單萜類化合物,在香水和醫藥方面有很大的商業價值。在谷氨酸棒桿菌合成萜類化合物的代謝途徑中,香葉基焦磷酸(geranylpyrophosphate,GPP)是單萜類化合物的前體,通過引入香葉醇合成酶轉化成內源前體物GPP即可合成香葉醇。為進一步在谷氨酸棒桿菌中高產香葉醇,還需要通過引入合成香葉醇的相關基因來實現高產。如徐碩[43]以野生型C.glutamicumATCC 13032為出發菌株導入香葉醇合成基因,同時過表達了谷氨酸不棒桿菌中糖酵解途徑的dxs和idi內源基因,使香葉醇產量從(5.38±0.38) mg/L提升至(12.18±0.44) mg/L。
3 谷氨酸棒桿菌細胞工廠利用可再生資源生產高附加值產品的實例
谷氨酸棒桿菌主要以富含糖和淀粉的小麥、馬鈴薯、玉米、木薯等糧食作物作為發酵原料。然而,這種傳統的生產方法存在糧食競爭問題。可再生原料如秸稈、稻殼、枯草、甘蔗渣、木屑等非食品的農業廢棄物,因其具有可重復生產,價格低廉,來源廣泛等特點,被開發作為原料生產高附加值產品,擴大了細胞工廠的底物譜(圖3)。

圖3 谷氨酸棒桿菌細胞工廠利用可再生原料 生產高附加值產品的實例Fig.3 Example of C.glutamicum cell factory producing high value-added products from renewable raw materials
玉米秸稈、玉米芯和小麥秸稈等是常見的可再生農業廢棄物,自身含有豐富的葡萄糖等營養物質,通過生物煉制過程可將其酶解或水解液作為發酵性糖用于生產高附加值產品。華珂君[5]以C.glutamicumS9114為出發菌株,通過引入來自藍藻的酰基-ACP還原酶-醛去甲酰化加氧酶產烴途徑成功構建1株具備產烴能力的菌株,同時將脂肪酸脫羧酶分泌表達途徑與酰基-ACP還原酶-醛去甲酰化加氧酶產烴途徑整合形成雙烴途徑的工程菌,并對其發酵條件優化后使烴產量提高81.3%,達29.1 mg/L。該菌株利用玉米秸稈水解液進行初步產烴時,產量達10.8 mg/L,實現了以木質纖維為原料發酵生產烴類化合物的目的。肖雁秋[4]通過對不同谷氨酸發酵菌株進行發酵性能的篩選,得到一株發酵性能較好的菌株C.glutamicumSⅡMB460,其自身能利用15%未脫毒的玉米秸稈水解液在青霉素誘導的條件下生產31 g/L的谷氨酸,產量和得率均可達到甚至超過合成培養基的水平。溫經柏[44]以C.glutamicumS9114為出發菌株,通過對菌株進行多層次的代謝工程改造后解決了影響谷氨酸棒桿菌利用玉米秸稈水解液生產谷氨酸和γ-氨基丁酸的關鍵問題,最終得到的重組菌株在以玉米秸稈水解液為碳源的條件下,谷氨酸和γ-氨基丁酸的產量分別達65.2和39 g/L。李浩[45]以C.glutamicumKBJ07為出發菌株,通過在菌株中異源表達cod、p4h基因和敲除putA基因,構建合成反式-4-羥基-L-脯氨酸(Hyp)的突變菌,突變菌株最高生產水平為310 mg/L,將其在玉米芯酶解液配制的發酵培養基中發酵時,表現出良好的利用玉米芯酶解液產酸的能力,Hyp產量高達327 mg/L。而潘浩等[46]研究了經代謝工程改造后的突變株以麥秸稈水解液為原料在厭氧條件下利用其阿拉伯糖或木糖合成34.1 mmol/L的琥珀酸,得率高于以葡萄糖為底物合成的琥珀酸。
4 結論
近幾十年來,谷氨酸棒桿菌仍是氨基酸生物制造的核心菌種。如今新型的誘變技術、高通量篩選技術和基因編輯技術的快速發展,加速了谷氨酸棒桿菌作為微生物細胞工廠的構建和優化。谷氨酸棒桿菌在生產其他大宗化學品、天然產物、蛋白質、生物燃料等產品方面表現出高潛力和多功能性。此外,在代謝工程技術的發展推動下,谷氨酸棒桿菌的底物譜擴展到其他廉價和非食品競爭的可再生原料(如纖維素、乳漿、青貯及秸桿和麥麩的水解液等),且菌株在這些原料中能同時利用多種碳源來生產各種高附加值產品,使谷氨酸棒桿菌成為一種有前途的高效工業平臺菌株。
目前,菌株利用新原料生產產品的效率還有待進一步提高。因此,仍需借助系統的生物學手段全面分析谷氨酸棒桿菌的功能基因,并利用代謝工程繼續挖掘其代謝潛力,使細胞工廠實現高產量、高速率和高純度的目標。此外,預處理的原料不可避免地存在各種抑制物,抑制物濃度較高時影響菌株的生長,需進一步提高菌株在各種碳源的共同利用、增強高濃度產物或底物的耐受以及抑制物耐受等方面的能力,使其更適用于工業化生產。

