微小RNA在早發性卵巢功能不全中的研究進展
袁秀秀,趙鵬偉,王煜
(1.內蒙古醫科大學,呼和浩特 010000;2.內蒙古醫科大學基礎醫學院微生物與免疫學研究室,呼和浩特 010000;3.內蒙古醫科大學附屬醫院,呼和浩特 010000)
早發性卵巢功能不全(premature ovarian insufficiency,POI),曾稱卵巢早衰(premature ovarian faliure,POF),是指女性在40歲之前出現卵巢功能減退,常伴月經紊亂、FSH水平升高(FSH>25 U/L),而POF為POI的終末階段,FSH升高更為顯著(FSH>40 U/L),患者常伴閉經、潮熱多汗、性功能減退、骨質疏松等圍絕經期臨床表現[1]。近年來,隨著生活方式改變和婚育年齡的推遲,POI的發病率逐年升高,發病趨于年輕化,是女性不孕的重要原因之一。POI病因復雜,90%以上病因不明。POI按卵巢功能下降程度分為隱匿期、生化異常期和臨床衰竭期3個階段。目前,臨床用激素替代療法來改善癥狀,但POI患者卵巢功能減退不可逆轉,故POI發病機制研究成為國內外熱點。微小RNA(miRNA)是一類內源性非編碼小RNA,其通過完全互補或不完全互補結合方式與靶基因3’UTR miRNA結合,抑制靶基因表達。miRNA可調控人類1/3的基因,值得注意的是,1個miRNA可調節多個基因,而多個miRNAs也可調控同一個基因[2]。近年來,隨著轉錄后調控機制研究迅速興起,miRNA為生殖系統的研究帶來了新視角,許多功能性miRNAs被證實參與調控卵巢功能。miRNA在女性生殖疾病中的作用,尤其是在POI中的作用正逐漸被深入研究。本文將對miRNA調控POI分子機制的最新研究進展進行綜述。
一、miRNA多態性與POI
POI是常見的異質性性腺病,遺傳因素約占POI總病因的10%~20%。POI的遺傳物質異常不僅發生在染色體水平,還可能源于單基因異常。單核苷酸多態性(SNP)是由單個核苷酸堿基的轉換或顛換而引起的DNA序列多態性,是人類可遺傳變異中最常見的一種。目前,已發現基因突變和SNP通過不同的致病途徑影響卵巢功能,且SNP與POI密切相關。研究發現,miRNAs在POI中起著重要的調控作用,其通過靶向與卵巢功能相關的基因如,調控細胞色素P450家族17亞家族A成員1(CYP17a1)、抗苗勒管激素(AMH)、抑制素亞基βA(INHBa)、細胞色素P450家族19亞家族A成員1(CYP19a1)、透明帶(ZPS)、骨形態發生蛋白15(BMP-15)和生長分化因子9(GDF-9)等發揮作用[3]。Cho等[4]研究發現,miR-146a的SNP(C>G)轉染人顆粒細胞后,miR-146a的表達水平降低并影響叉頭框蛋白O3(FOXO3)、叉頭框蛋白 L2(FOXL2)和Cyclin蛋白家族(CCND2)等POI相關基因的表達。Cho等[5]研究發現,在143例POI患者血漿中miR-938的正常和變異等位基因與GnRHR3’UTR的識別存在差異,與miR-938的正常基因型(GG)相比,雜合型(GA)變異有更高的POI發生風險,此外,miR-938多態性影響人顆粒細胞中GnRHR的表達,推測miR-938多態性通過調控靶基因從而參與調控POI發生。可見,miRNA多態性研究可為POI遺傳性病因機制的研究提供新思路。
二、miRNA參與調控POI 的途徑
1.miRNA在顆粒細胞中參與調控POI:卵巢顆粒細胞是卵巢的主要功能細胞,miRNAs通過調控顆粒細胞的生物功能參與POI的發生。研究發現,POF模型小鼠卵巢顆粒細胞中miR-181b、miR-15a和miR-30d表達顯著升高,其中miR-15a表達升高最為顯著;熒光素酶報告證實miR-15a的靶基因為Last1,當miR-15a表達升高時,抑制Hippo-YAP/TAZ通路及效應器Lats1的表達,抑制顆粒細胞的增殖,促進顆粒細胞凋亡,促進POF發生[6]。在高脂高糖飲食建立的POF小鼠模型中,高糖高脂飲食激活Dab2ip/Ask1/p38-Mapk信號通路,抑制miR-146b-5p表達,誘導γH2A.X磷酸化,誘導卵巢顆粒細胞老化和POF發生[7]。Klotho基因是一種抗衰老基因,位于人類第13條染色體上,其中α-Klotho是一種主要的Klotho蛋白。在環磷酰胺誘導的POF小鼠模型中α-Klotho基因表達顯著降低,敲除α-Klotho基因后卵巢中閉鎖卵泡數顯著增加而正常卵泡數量顯著減少,miR-15b表達上調時,內源性α-Klotho基因表達水平降低并激活下游TGF-β1/Smad信號通路,誘導POF發生[8]。研究發現,在牛顆粒細胞中過表達miR-424和miR-503時,Smads家族蛋白7(SMAD7)和激活素A受體ⅡA(ACVR2A)表達顯著下降,促進牛顆粒細胞增殖[9]。用微陣列分析生化卵巢功能不全(bPOI)患者顆粒細胞發現,miR-379-5p表達上調,miR-379-5p靶向作用于聚腺苷二磷酸核糖聚合酶1(PARP1)和X射線修復互補缺陷修復基因6(XRCC6)調控顆粒細胞增殖,為bPOI提供表觀遺傳學依據[10]。miR-127-5p在bPOI患者血漿中表達上調,miR-127-5p直接靶向高遷移率族蛋白 B2(HMGB2)調控顆粒細胞增殖,證實miR-127-5p在POI中有預測價值,HMGB2可作為POI的新候選基因[11]。研究發現,在豬、鼠、羊等不同物種中miR-1306、miR-30d-5p、miR-202-5p、miR361-5p、miR-1275、miR-126*分別靶向作用于轉化生長因子-β受體II(TGFβR2)、Smad2、TGFβR2、血管內皮生長因子(VEGFA)、肝受體源蛋白-1(LRH-1)、促卵泡激素受體(FSHR),并調控卵巢顆粒細胞凋亡[12-17]。在化療誘導的小鼠POF模型中Let-7a表達下調,體外實驗將Let-7a模擬物轉染到出生后第3天的小鼠卵巢中,發現Let-7a的表達上調抑制跨膜蛋白分子配體(FASL)表達,使化療誘導的凋亡顆粒細胞數減少,表明Let-7a可能在化療誘導的卵巢損傷中起關鍵作用[18]。研究發現,在POI患者血清中miR-483-5p表達顯著升高,在人和小鼠顆粒細胞系中過表達FK506結合蛋白(FKBP4)可以抑制miR-483-5p升高,引起的顆粒細胞凋亡[19]。從POI患者血中檢測到的差異表達miRNAs可做為預測POI發生發展的非侵入性生物標志物。研究發現,功能性miRNA通過作用于相應靶基因參與調控顆粒細胞自噬,如miR-21a和miR-21-3p分別靶向于自噬小體標志物蛋白輕鏈3(LC3B-II)和VEGFA,從而影響卵巢功能[20-21]。但尚無研究報道證實這些與顆粒細胞自噬相關的miRNA是否在人卵巢內也有類似功能進而影響POI的發生。在卵巢中與類固醇激素合成和分泌有關的miRNA,如miR-4463和miR-214-3p分別靶向作用于CYP19A1、雌激素受體α(ESR1)和核受體亞家族5A成員(NR5A1),調控雌激素的合成[22-23]。上述與POI相關的miRNAs在卵巢顆粒細胞中的具體調控機制總結見表1。
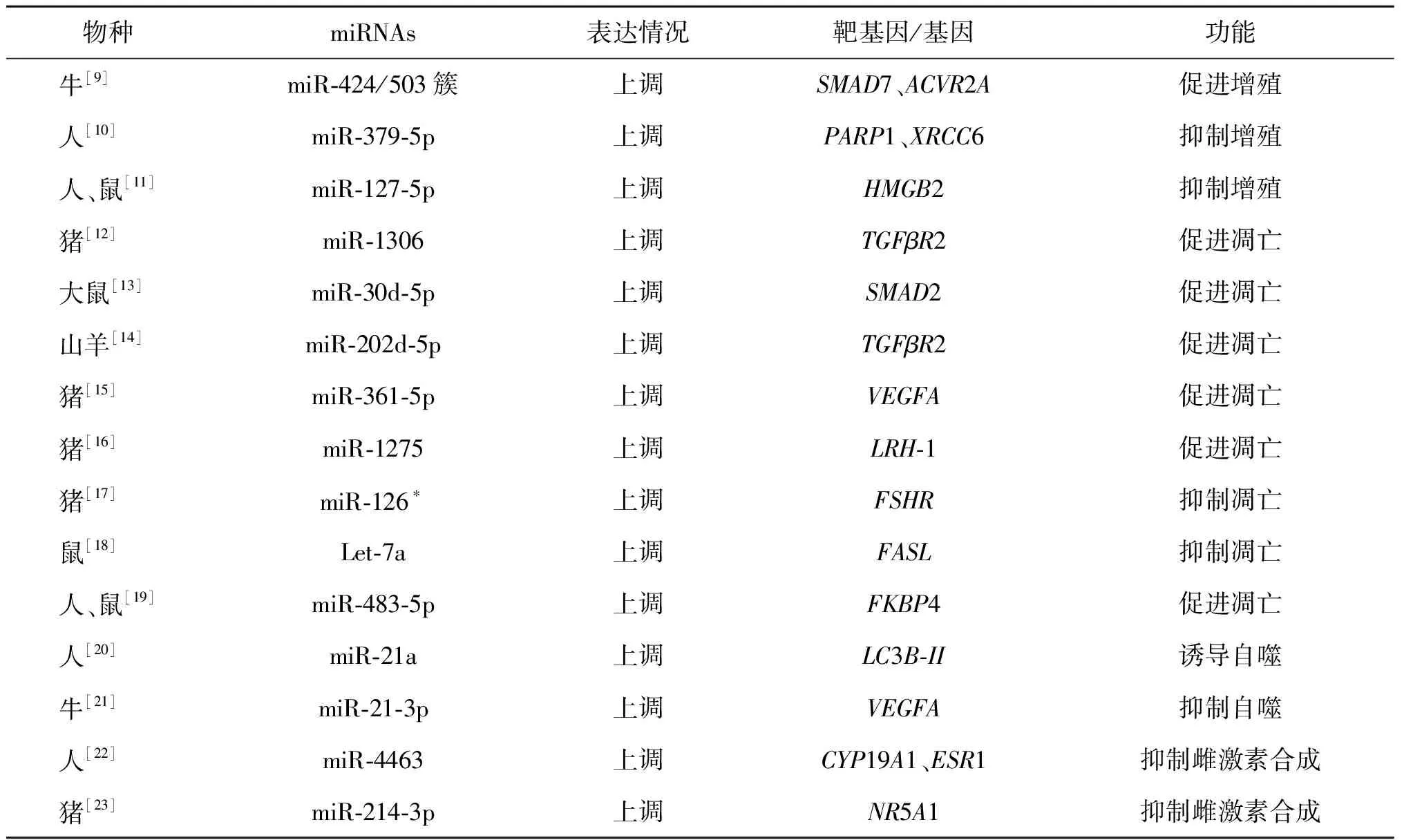
表1 miRNA在顆粒細胞中的調控作用
2.miRNA在卵泡膜細胞中的作用:卵泡膜細胞參與構成卵母細胞和顆粒細胞發育的微環境。在哺乳動物中miRNA參與調節卵泡膜細胞的增殖、分化、合成等功能。牛卵泡膜細胞中miR-221表達水平顯著高于顆粒細胞,卵泡膜細胞可能是牛卵泡中miR-221的主要來源,體外實驗證實用成纖維細胞生長因子9(FGF9)治療牛卵泡膜細胞后,卵泡膜細胞中miR-221的表達水平增加,可抑制類固醇激素生成[24]。當雞卵泡膜細胞中miR-135a-5p的表達受到抑制時,Krüppel樣因子4(KLF4)、ATP酶磷脂轉運8A1(ATP8A1)和復合蛋白-1(CPLX1)表達水平顯著上調,參與調控雞卵巢卵泡膜細胞的增殖和分化[25]。目前,影響卵泡膜細胞功能的miRNA是否參與調控POI的發病機制的研究報道還比較少。在哺乳動物中被證實的有功能的miRNAs需要繼續在人類細胞中進行研究,探討其在POI中的發病機制。
3.miRNA在卵泡發育中參與調控POI:POI是常見的卵泡發育障礙性疾病之一,POI患者卵巢儲備功能降低。卵泡發育是指原始卵泡發育為成熟卵泡的過程,卵泡成熟障礙或卵泡閉鎖加速影響卵泡發育,致使卵巢功能下降。多項研究發現,miRNAs調控卵泡發育[26-27]。在小鼠卵泡中用慢病毒轉染過表達miR-378后,細胞凋亡相關基因(Bax/Bcl2)表達水平顯著增加而卵泡發育相關基因BMP15和GDF9表達顯著降低,推測miR-378可能通過調控其靶基因影響卵泡的成熟[28]。在人卵丘細胞中miR-145-5p的表達水平與卵母細胞成熟呈負相關[29]。miR-21過表達促進豬卵母細胞成熟[30]。miR-23a-3p可能靶向調控縫隙連接蛋白43(Gja1)的表達,調控大鼠卵泡發育及閉鎖[31]。研究發現,miR-378-3p的表達隨著原始卵泡的增多而升高,過表達miR-378-3p后可使原始卵泡百分比增加,敲除miR-378-3p后可使原始卵泡百分比降低,并證實miR-378-3p通過靶向磷酸肌醇依賴的蛋白激酶 1(PDK1)和半胱氨酸蛋白酶(Caspase9),參與調節原始卵泡池的大小,影響POI發生[32]。研究發現,牛閉鎖卵泡中miR-21-5p/-3p、miR-150、miR-409a、miR-142-5p、miR-378、miR-222、miR-155和miR-199a-5p的表達水平顯著高于健康卵泡,以上這些miRNAs在卵泡膜細胞中的表達水平均顯著高于顆粒細胞[33]。在牛卵泡膜細胞中miR-155和miR-222的靶基因為轉錄因子(ETS1),miR-199a-5p和miR-155的靶基因分別為Jagged1和錯配修復蛋白(MSH2),在顆粒細胞中miR-199a-5p、miR-150和miR-378的靶基因為VEGFA[33],上述與卵泡發育過程密切相關的miRNAs及其靶基因可能參與調控 POI的發生發展,但具體調控機制有待深入研究。此外,有研究發現,在自身免疫性POI患者血清中miR-21的表達顯著降低,miR-21與E3泛素連接酶(Pellino-1)呈正相關,推測miR-21在卵巢卵泡發生中可能發揮重要作用[34]。
三、miRNA在POI治療中的潛在價值
目前,國內外學者試圖通過調控miRNA來改善患者的卵巢功能。Zhang等[35]研究發現,在POF小鼠模型中注射人羊膜上皮細胞(hAECs)來源的外泌體后小鼠卵泡數量增加且卵巢功能可得到改善,hAECs外泌體通過轉移功能性miRNA(如miR-1246)顯著抑制化療誘導的顆粒細胞凋亡。研究發現,從小鼠中分離得到的骨髓間充質干細胞來源的外泌體攜帶的主要功能性miRNA有miR-644-5p[36]和miR-144-5p[37],其分別作用于p53和磷酸酶(PTEN)基因,從而抑制卵巢顆粒細胞凋亡,改善卵巢功能。Ding等[38]研究發現,人臍帶間充質干細胞來源外泌體富集miR-17-5p后,沉默信息調節因子(SIRT7)、基因修復關鍵基因PARP1、磷酸化的染色體組蛋白H2A(γH2AX)和XRCC6的表達下調,抑制活性氧的積累,改善POF小鼠卵巢功能。綜上所述,干細胞來源的外泌體作為POI的新治療方法,其主要機制是通過miRNA調控顆粒細胞功能從而改善卵巢功能,這為使用miRNA替代直接使用干細胞治療POI的無細胞治療方案成為可能。
四、總結和展望
隨著基因測序技術及再生醫學的發展,miRNAs在POI中的分子調控機制逐漸被認識。其中,miRNAs多態性與POI靶基因表達密切相關,使得miRNA在POI遺傳性病因中的調控機制不斷被證實。學者們通過體內、外細胞實驗發現,在POI患者卵巢中存在差異表達miRNAs,這些miRNAs通過作用于特定的靶基因參與卵泡成熟和閉鎖等過程,但它們是否與人POI發生有關有待繼續驗證。隨著與POI相關的功能性miRNAs、靶基因及調控網絡不斷被發現,證實miRNAs在POI發病機制中扮演重要角色。此外,通過外泌體轉移的miRNAs可以通過調控顆粒細胞功能從而改善卵巢功能。以上研究說明,miRNAs在POI發生發展及中起關鍵作用,與POI密切相關的miRNAs可能成為潛在治療靶點。

