幽門螺桿菌悉尼標準菌株傳代培養方法研究
樊玉娟,李福興,王 黎,程明璟,肖 敏,熊苗苗,趙衛東
(大理大學臨床醫學院,云南大理 671000)
幽門螺桿菌(Helicobacter pylori,H.pylori)于1984年由Marshall和Warren首次從胃黏膜組織成功分離〔1〕。近40年,隨著對H.pylori研究的深入,發現H.pylori感染是嚴重胃炎相關疾病的重要危險因素,包括消化性潰瘍、胃黏膜相關淋巴組織淋巴瘤以及胃癌〔2〕。據流行病學統計,在中國,約70%的人感染H.pylori,其中15%~20%的感染者出現臨床癥狀;在發展中國家,70%~90%的人在10歲前攜帶H.pylori;但在發達國家,H.pylori感染的流行率從25%~50%不等〔3〕。世界衛生組織將H.pylori列為胃癌的一類致癌因子〔3〕。雖然目前臨床已有多種檢測H.pylori的方法,但H.pylori培養仍是診斷其感染的金標準。由于H.pylori的培養條件高、對環境要求極其嚴苛,并且不能與其他細菌在同一實驗室培養,故目前國內外常采用的培養H.pylori的方法成本較高。幽門螺桿菌悉尼標準菌株(SS1菌株)是最常見的H.pylori菌株之一,目前主要用于動物模型的建立以及細胞模型的感染〔4〕。本文通過對SS1菌株進行傳代培養,旨在尋找一種廉價、簡單、有效、快捷的H.pylori培養方法。
1 材料
幽門螺桿菌悉尼標準菌株(SS1菌株)購買于廣州微生物所(GDMCC 1.1820);哥倫比亞血平板(鄭州安圖生物工程股份有限公司);胎牛血清(天杭生物科技股份有限公司);腦心浸潤液(青島海博生物技術有限公司);厭氧產氣包(青島海博生物技術有限公司);密封厭氧袋(青島海博生物技術有限公司);MGCC-31 2.5 L密封培養罐(三菱瓦斯化學株式會社);CO2培養箱(賽默飛世爾科技有限公司);MVS-38立式壓力蒸汽滅菌器(日本松下電器產業株式會社);禾信康元CMI-1600飛行時間質譜儀(廣州禾信儀器股份有限公司);一次性接種環(唐人康醫療器械有限公司);OLYMPUS CX21FS1顯微鏡(日本奧林巴斯株式會社)。
2 方法
2.1 前期準備 將SS1菌株甘油凍存液1 mL迅速解凍,分裝于5支凍存管中,200 μL/支,放入-80℃冰箱。配制腦心浸潤液:稱取3.85 g腦心浸潤液肉湯,溶解于100 mL去離子水中,緩慢、充分攪拌至完全溶解。準備50 mL甘油倒入玻璃瓶中,將甘油和自配的腦心浸潤液高溫高壓滅菌30 min。甘油和自配腦心浸潤液按照1∶4的體積比配制成液體培養基,分裝在經高溫滅菌的10 mL離心管中,備用。
2.2H.pylori培養方法
2.2.1 方法一 向哥倫比亞血平板(10個)中加入50 μL腦心浸潤液,取出SS1菌株凍存液,37℃水浴解凍,使用無菌一次性接種環(10 μL)分別沾取5次菌液(共50 μL),均勻地將SS1菌株接種在哥倫比亞血平板上,隨后放入裝有厭氧產氣包的密封厭氧袋中,每個袋子中置入1個已完成接種的哥倫比亞血平板,密封后放入CO2培養箱,觀察3~14 d。
2.2.2 方法二 向哥倫比亞血平板(5個)中加入50 μL腦心浸潤液和50 μL解凍菌液,使用無菌一次性接種環均勻涂布。在密封培養罐中培養,需要檢查密封培養罐的密封性是否良好,然后在密封培養罐對應的凹槽中倒入滅菌后的去離子水,并放置1個厭氧產氣包,最后放入已完成接種的哥倫比亞血平板,密封后放入CO2培養箱中,觀察3~14 d〔5〕。
2.2.3 方法三 向哥倫比亞血平板(5個)中加入50 μL腦心浸潤液和50 μL解凍菌液,使用無菌一次性接種環均勻涂布。在方法二的基礎上使用燭缸法消耗密封培養罐中的氧氣,即在密封培養罐中加入1支點燃的蠟燭,蓋上蓋子,待蠟燭熄滅后放入CO2培養箱中,觀察3~14 d〔6〕。
2.2.4 方法四 向哥倫比亞血平板(5個)中加入50 μL腦心浸潤液和50 μL解凍菌液,使用無菌一次性接種環均勻涂布。培養條件同方法三,與之不同的是需要每天在密封培養罐中點燃1次蠟燭。
2.3 復蘇實驗 使用無菌一次性接種環緩慢刮拭哥倫比亞血平板上的菌落,將菌落溶于液體培養基,并分裝于1 mL凍存管中,置于-70℃冰箱保存備用。復蘇當天,隨機取出1支凍存管,37℃水浴解凍,并接種于哥倫比亞血平板中,使用方法四進行培養,觀察3~14 d。
2.4H.pylori菌株鑒定(1)菌落形態:觀察哥倫比亞血平板中的菌落形態是否典型。(2)革蘭染色:滴1滴0.9%氯化鈉溶液于干凈載玻片上,用無菌一次性接種環刮取少許菌落在0.9%氯化鈉溶液中涂開,制成厚薄適宜的細菌涂片。涂片用火焰固定,待涂片冷卻后,滴加結晶紫進行初染,染色1 min,清水洗凈涂片;滴加碘液進行媒染,染色1 min,清水洗凈涂片;滴加丙酮乙醇進行脫色,直至無藍紫色液體流出,清水洗凈涂片;滴加稀釋復紅進行復染,染色30 s,清水洗凈涂片,干燥后使用油鏡觀察染成紫紅色的待測菌涂片。(3)質譜檢測:將H.pylori菌液直接涂布至靶板,用甲酸破壞細菌細胞壁,添加適量儀器配套基質,干燥后放入靶倉,進行檢測。根據細菌質核比(m/z),計算機軟件分析得到最匹配菌株。
3 結果
3.1H.pylori菌株培養及鑒定 采用上述4種方法均能成功培養出H.pylori菌株。從哥倫比亞血平板中均觀察到大小不一、半透明狀、圓形菌落,此為H.pylori菌株肉眼觀察的典型形態。見圖1A。為進一步驗證是否為H.pylori菌株,將其做成細菌涂片,并進行革蘭染色。鏡下可見革蘭染色陰性,細菌形態呈S形、弧形彎曲、海鷗狀〔7〕。見圖1B。在復蘇實驗中觀察到相同菌落,證明本實驗中凍存菌株的方法是可行的。
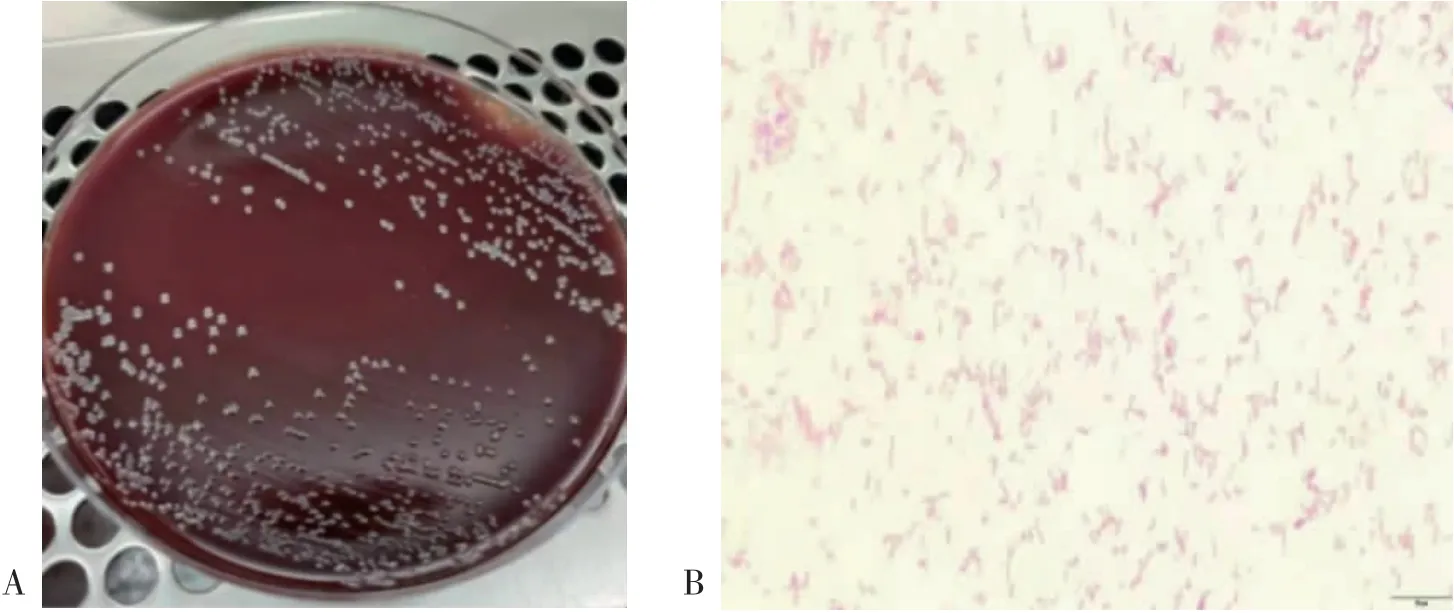
圖1 H.pylori菌株鑒定
3.2H.pylori菌株質譜檢測結果 飛行時間質譜儀是一種新型的微生物鑒定儀器,與傳統檢測方法相比,具有靈敏度高、特異性強、分析速度快的優勢。相關研究表明,當細菌最高峰位處于m/z值6 900~7 000時,該菌株即為H.pylori〔8〕。本實驗中,細菌最高峰位m/z值為6 964.1,與文獻〔10〕報道一致,確定該菌株為H.pylori。見圖2。
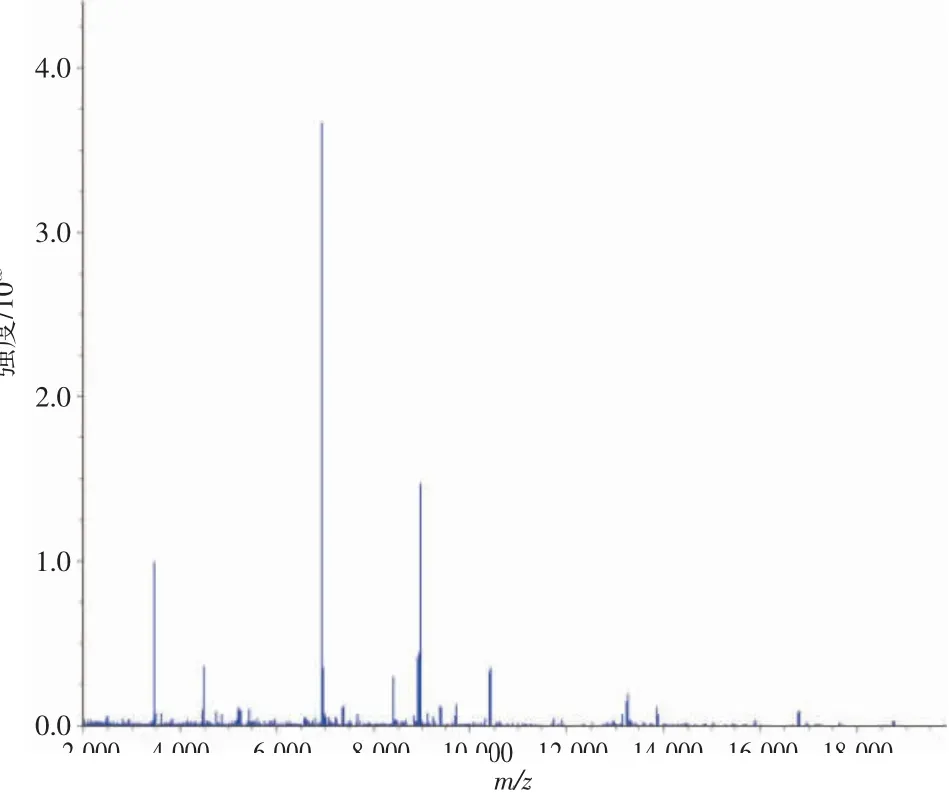
圖2 H.pylori質譜檢測結果
3.3 不同培養方法生長速度比較4種方法均能成功培養出H.pylori菌株,通過測定哥倫比亞血平板上的菌落數,對4種培養方法的生長速度進行比較。結果顯示,在達到同等菌落數量的情況下,方法四用時顯著少于其他3種方法,差異有統計學意義(P<0.05)。見表1。
表1 4種培養方法生長速度比較(d,±s)

表1 4種培養方法生長速度比較(d,±s)
注:方法四與方法一比較*P<0.05;方法四與方法二比較#P<0.05;方法四與方法三比較△P<0.05。
?
4 討論
H.pylori是一種單極、多鞭毛、末端鈍圓、螺旋形彎曲的細菌,革蘭染色陰性,有動力,在胃黏膜上皮細胞表面常呈典型的螺旋狀或弧形,與本實驗革蘭染色鏡下觀察的菌落形態相一致。肉眼觀察呈灰白色、半透明、顆粒狀菌株,與哥倫比亞血平板中呈現的菌落形態相一致。H.pylori菌株的培養條件相對較為嚴格,通常需要在特定的培養基中培養,并且需要在培養基中添加一定的營養物。研究報道表明,腦心浸潤液和胎牛血清可以作為首選的培養基營養物,對H.pylori的生長起著重要的促進作用〔9-10〕。同時,H.pylori的生長與環境中的氣體有著密切的關系,因此,還需要嚴格把控氣體濃度〔9-10〕。正常情況下,空氣中O2占21%、CO2占0.03%,H.pylori的標準培養環境是在三氣培養箱(O2:2%~8%,CO2:10%~15%,N2:85%)中進行培養,這種培養箱可以嚴格控制O2和CO2濃度,從而為H.pylori的生長提供適宜環境,但是三氣培養箱價格高昂,使其應用受限。有研究者采用燭缸法培養H.pylori,此方法成本較低,可有效進行H.pylori菌株的傳代培養,但操作較為復雜〔6〕。
H.pylori對培養環境的要求極為嚴格,特別是低氧環境,在本研究中,方法一僅使用了裝有厭氧產氣包的密封厭氧袋,袋內氣體由厭氧產氣包產生,它可以消耗袋內的O2產生CO2,但濕度不夠,由于袋內氣體達到適宜比例的速度較慢,導致傳代時間長;方法二是在密封培養罐中培養,罐中相應凹槽內放入去離子水,培養罐內氣體主要由厭氧產氣包產生,它可以消耗罐內的O2產生CO2,由于僅存在厭氧產氣包,罐內氣體達到適宜比例的速度仍較慢,故菌株培養時間也比較長,但優于方法一;方法三是在密封培養罐內點燃蠟燭,蠟燭燃燒可以消耗O2產生CO2和水,這樣可以保持低氧環境和適宜比例的CO2,使得罐內氣體快速達到H.pylori生長的最適比例,但隨著細菌生長繁殖消耗掉一定量的CO2,使得氣體比例不斷發生變化,因此,H.pylori生長并未達到最理想的效果;方法四是在方法三的基礎上增加蠟燭點燃次數,即每天都打開密封培養罐的蓋子點燃1次蠟燭,這樣可以使罐內持續保持H.pylori生長的最適氣體環境,因此,H.pylori生長效果較好。但本實驗也有相對局限性,首先由于不具備合適的培養箱,為了選擇較為合適的培養環境,只選擇了CO2培養箱進行培養,而未在普通空氣培養箱中進行實驗,在未來的研究中,將進一步探索使用普通空氣培養箱的培養方法。
綜上所述,通過比較SS1菌株的傳代培養方法,找到一種操作簡便、價格低廉的H.pylori培養方法,可有效節約H.pylori感染的研究成本,具有較強的應用前景,值得推廣。

