血清外泌體、胎盤來源外泌體和外泌體miR-210與子癇前期的相關性
段玉萍,謝 驪,蔡雷鳴,吳晶晶,洪 茂,厲 倩
(1.上海市寶山區吳淞中心醫院檢驗科,上海 200940;2.上海市寶山區吳淞中心醫院婦產科,上海 200940)
子癇前期(preeclampsia,PE)是一種嚴重威脅孕婦和胎兒健康的妊娠期綜合征,發病率為5%~7%,主要臨床特征為妊娠20周后出現高血壓或蛋白尿,是引起孕婦和胎兒死亡的主要原因[1]。PE的具體病理機制尚不完全清楚,一般認為由內皮功能紊亂、代謝異常、氧化應激增強、炎癥反應和高凝狀態等引起[2]。
有研究發現,組織特異性外泌體可在疾病的診斷和治療中發揮重要作用,如在肺部疾病中具有信號傳遞的功能[3],在腸道疾病中具有潛在的生物標志物和靶向治療作用[4]。有研究發現,在妊娠第6周,孕婦外周血中外泌體的分泌量開始增多,妊娠第6~12周,由于各種病理生理因素的刺激,母體胎盤滋養層細胞分泌的外泌體持續增多,外周血中胎盤堿性磷酸酶(placental alkaline phosphatase,PLAP)陽性的外泌體從妊娠第6周開始也明顯增多[5]。微小RNA-210(microRNA-210,miR-210)是低氧誘導RNA,已有研究發現其在PE孕婦胎盤和血清中的表達升高[6-7],本課題組前期發現在PE孕婦血清miR-210與炎癥因子白細胞介素6(interleukin-6,IL-6)密切相關[8]。目前,臨床上尚缺乏早期診斷和預測PE的方法。PE患者在臨床癥狀出現前是否已存在血清外泌體、胎盤來源外泌體(PLAP)和外泌體miR-210水平的變化目前尚不清楚。為此,本研究擬分析不同孕期PE患者血清外泌體和胎盤來源外泌體的差異,以及外泌體miR-210表達的差異,旨在尋找早期診斷和預測PE的方法。
1 材料和方法
1.1 研究對象
選取2018年1月—2019年12月在上海市寶山區吳淞中心醫院分娩的PE患者30例(PE組),年齡為22~37歲,初胎比為56.7%(17/30),孕前體質量指數(body mass index,BMI)為(22.5±2.3)kg/m2,PE診斷孕周為(35.1±2.8)周。PE的診斷標準參照第9版《婦產科學》[9]:妊娠20周后出現收縮壓≥18.62 kPa(140 mmHg)和/或舒張壓≥11.97 kPa(90 mmHg),伴尿蛋白≥300 mg/24 h,或隨機尿蛋白(+),或雖無蛋白尿但合并血小板減少、肝功能損傷、腎功能損傷、肺水腫、新發中樞神經系統異常或視覺障礙中任意1項。另選取同期上海市寶山區吳淞中心醫院無明確妊娠相關疾病的孕婦30例(正常妊娠組),年齡22~38歲,初胎比為53.3%(16/30),孕前BMI為(23.6±3.2)kg/m2。所有孕婦均排除妊娠感染、妊娠糖尿病,且均為單胎妊娠。2個組之間年齡、初胎比、孕前BMI等一般資料差異均無統計學意義(P>0.05)。本研究經上海市寶山區吳淞中心醫院倫理委員會批準,所有對象均知情同意。
1.2 方法
1.2.1 樣本采集及處理 采用真空采血管采集所有對象孕早期(12~14周)、孕中期(20~24周)和孕晚期(28~32周)的空腹靜脈血3~5 mL,靜置20 min,以1 500×g離心10 min,分離血清,再以12 000×g將血清離心10 min,轉移上清液至無RNA酶的無菌容器中,-80 ℃保存備用。
1.2.2 血清外泌體的分離和鑒定 采用ExoQuick試劑(美國System Biosciences公司)分離血清外泌體,嚴格按試劑說明書操作。簡要步驟:將已處理好的血清樣本以3 000×g離心15 min,去除細胞和細胞碎片,吸取250 μL血清至潔凈的1.5 mL容器內,加入63 μL外泌體提取試劑,震蕩混勻后,4 ℃靜置30 min,1 500×g離心30 min,棄上清,1 500×g再次離心5 min,棄上清,沉于管底的灰白色沉淀物即為外泌體。采用免疫印跡法鑒定外泌體,采用蛋白裂解液(上海碧云天公司)裂解外泌體蛋白,采用二喹啉甲酸(bicinchoninic acid,BCA)法檢測總蛋白濃度,試劑購自上海碧云天公司。取30 μg蛋白上樣,采用12%聚丙烯酰胺凝膠進行蛋白電泳,80 V電泳30 min,110 V電泳1.5 h。250 mA、1.5 h電轉至0.45 μm聚偏二氟乙烯(polyvinylidine difloride,PVDF)膜。轉膜后使用5%脫脂牛奶封閉1 h,加入1∶1 000稀釋的CD63(英國Abcam公司),4 ℃孵育過夜。孵育后使用1×三羥甲基氨基甲烷-吐溫緩沖液(tris-hydroxymethyl aminomethane-Tween,TBST)洗3次,每次10 min。加入辣根過氧化物酶標記的羊抗兔二抗(1∶2 000稀釋),室溫孵育2 h,1×TBST洗3次,每次10 min。用電化學發光法顯影,并用6000型全自動凝膠成像系統(上海勤翔科學儀器有限公司)檢測蛋白條帶。
1.2.3 血清外泌體數量檢測 在分離的血清外泌體中加入200 μL磷酸鹽緩沖液(phosphatebuffered saline,PBS),混勻。采用CD63 ELISA試劑盒(美國System Biosciences公司)檢測外泌體數量。嚴格按試劑盒說明書要求操作。
1.2.4 PLAP水平檢測 在分離的血清外泌體中加入200 μL PBS,混勻。采用酶聯免疫吸附試驗檢測PLAP水平,試劑盒購自上海江萊生物科技有限公司。嚴格按試劑盒說明書要求操作。
1.2.5 外泌體中RNA的提取和miR-210檢測 采用miRNeasy serum/Plasma kita(德國Qiagen公司)提取外泌體RNA。采用二步法分別進行逆轉錄和熒光定量聚合酶鏈反應(polymerase chain reaction,PCR)。采用miScriptⅡ逆轉錄試劑盒(德國Qiagen公司)合成cDNA第1鏈(加尾法),將總體積為20 μL的逆轉錄體系置于TC-96基因擴增儀(杭州博日公司)中,逆轉錄條件為37 ℃ 1 h,95 ℃ 5 min。采用miScirpt SYBR green PCR試劑盒(德國Qiagen公司)和ABI 7500熒光定量PCR儀(美國ABI公司)進行PCR擴增。采用ΔCt值計算miR-210相對表達量。ΔCt值數值越小,表示miR-210相對表達量越高。具體操作參照文獻[8]。
1.3 統計學方法
采用SPSS 20.0軟件進行統計分析。采用Shapiro-Wilk正態性檢驗評估數據的正態性。呈正態分布的計量資料以±s表示,2個組之間比較采用t檢驗。采用Pearson相關分析評估PLAP與miR-210的相關性。以P<0.05為差異有統計學意義。
2 結果
2.1 血清外泌體的鑒定
免疫印跡法結果顯示,提取的外泌體中有特異性標志CD63表達,提示外泌體分離、提取成功。見圖1。
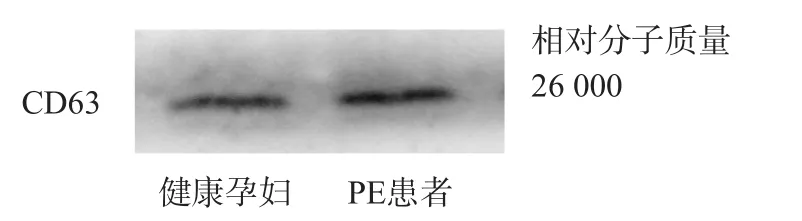
圖1 血清外泌體CD63表達
2.2 PE組與正常妊娠組不同孕期血清外泌體數量比較
在正常妊娠組中,孕晚期孕婦血清外泌體數量顯著高于孕早期(P<0.05)。在PE組中,孕中期、孕晚期孕婦血清外泌體數量顯著高于孕早期(P<0.05)。PE組各孕期孕婦血清外泌體數量均顯著高于正常妊娠組同孕期(P<0.05)。見表1。
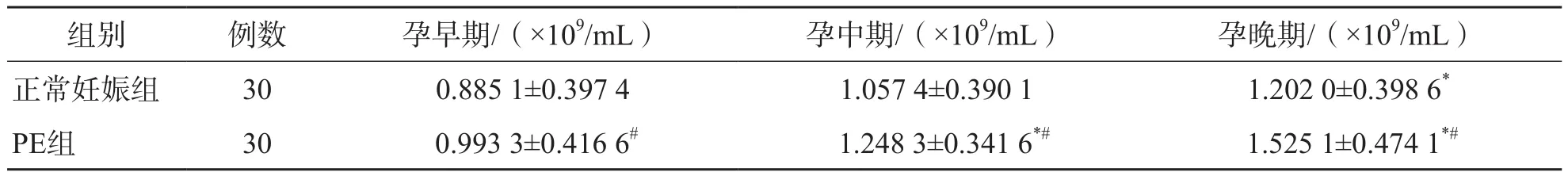
表1 PE組和正常妊娠組不同孕期血清外泌體數量的比較
2.3 PE組與正常妊娠組不同孕期PLAP水平比較
在正常妊娠組中,孕晚期孕婦PLAP水平顯著高于孕早期(P<0.05)。在PE組中,孕中期和孕晚期孕婦PLAP水平顯著高于孕早期(P<0.05)。PE組各孕期PLAP水平均顯著高于正常妊娠組同孕期(P<0.05)。見表2。

表2 PE組和正常妊娠組不同孕期PLAP水平比較
2.4 PE組與正常妊娠組不同孕期血清外泌體miR-210相對表達量比較
正常妊娠組孕晚期孕婦血清外泌體miR-210相對表達量顯著高于孕早期(P<0.05)。PE組孕中期和孕晚期孕婦血清外泌體miR-210相對表達量顯著高于孕早期(P<0.05)。PE組各孕期孕婦血清外泌體miR-210相對表達量均顯著高于正常妊娠組同孕期(P<0.05)。見表3。

表3 PE組與正常妊娠組不同孕期血清外泌體miR-210 ΔCt值比較
2.5 PLAP水平與外泌體miR-210相對表達量的相關性
Pearson相關分析結果顯示,PLAP水平與外泌體miR-210相對表達量呈正相關(r=0.668,P<0.01)。見圖2。
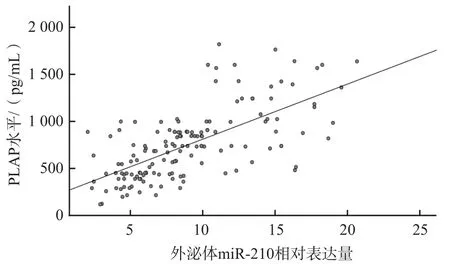
圖2 PLAP水平與外泌體miR-210的相關性
3 討論
PE是一個復雜的妊娠期綜合征,目前認為子宮螺旋動脈重塑障礙是PE病因環節中極為重要的一環。子宮螺旋動脈的重塑過程受許多細胞因子和信號轉導系統的調節,但具體機制至今尚未被完全闡明。在子宮螺旋動脈重塑過程中起重要調節作用的主要為缺氧誘導因子信號轉導系統。在妊娠早期,胚胎對血液需求量的增大與胎盤血供不足之間的矛盾使胎盤氧張力趨于降低,刺激滋養母細胞缺氧誘導因子的表達和復合體形成;而缺氧誘導因子通過誘導轉化生長因子β3的表達抑制滋養母細胞的分化和浸潤,滋養母細胞分化和浸潤的異常表達易導致螺旋動脈重塑障礙[10-11]。體外實驗結果表明,在1%的氧濃度環境中,滋養細胞分泌的外泌體數量顯著多于8%的氧濃度環境[12],提示孕期胎盤外泌體或可作為預測和診斷PE的生物標志物。
外泌體是一種由各種活細胞通過內吞-融合-外排等一系列生物學機制產生,并通過主動分泌方式排出細胞膜外的脂質雙分子層膜性囊泡,其本質是脂質雙分子層,直徑為30~100 nm,密度為1.15~1.19 g/mL[13]。外泌體膜富含膽固醇、鞘磷脂等脂質包膜成分,內含有多種蛋白、mRNA和微小RNA,包括其母細胞的特異性蛋白和外泌體相關蛋白,如CD9、CD63、Alix等[14]。因此,外泌體可能是最能反映母細胞內各種物質表達水平的標志物。外泌體的這一特征被廣泛研究,如干細胞分泌的外泌體具有促進細胞自我更新和修復的功能[15],來源于肺部腫瘤組織的外泌體具有促進M2吞噬細胞極化的作用[16],外泌體還在乳腺癌診治和消化道腫瘤轉移中發揮著重要作用[17-18]。另外,外泌體完整的囊泡結構使其能夠用于包裹靶向藥物,靶向治療腫瘤[19]。
血清中外泌體的來源復雜多樣,不僅來源于血細胞,還來源于各種組織細胞,包括胎盤來源的滋養細胞。利用外泌體表面的特異性標志物可以對外泌體的組織或細胞來源進行區分。PLAP是一種膜結合的糖基化堿性磷酸酶,主要分布在胎盤,利用PLAP水平可以表征胎盤外泌體的數量[12]。本研究不僅檢測了正常妊娠組和PE組不同孕期血清外泌體數量的變化,還檢測了胎盤來源外泌體(PLAP)數量的變化,結果與SARKER等[5]報道的結果一致。本研究結果顯示,正常妊娠組和PE組血清外泌體數量和PLAP水平均隨妊娠進展而逐漸增多,且PE組孕早期、孕中期和孕晚期血清外泌體數量和PLAP水平均高于正常妊娠組同孕期(P<0.05),提示胎盤來源的外泌體或能在PE的預測和早期診斷中發揮作用。
miR-210是一個與低氧相關的微小RNA,在PE患者胎盤和血清中的表達量高于正常孕婦(P<0.01)[7]。有研究結果顯示,PE患者血清中高水平的miR-210與高水平的IL-6相關[8]。本研究結果顯示,PE組孕早期、孕中期和孕晚期血清外泌體miR-210相對表達量均顯著高于正常妊娠組(P<0.05),且外泌體PLAP水平與外泌體miR-210相對表達量呈正相關(r=0.668,P<0.01),提示血清中升高的miR-210可能主要來源于胎盤。如能進一步分離PLAP陽性的外泌體,并進行miR-210定量檢測,應該能更直接地確定miR-210的來源。本研究結果提示外泌體miR-210,尤其是胎盤來源的外泌體miR-210或可在PE的預測和早期診斷中發揮重要作用。
綜上所述,PE患者血清外泌體數量、PLAP水平和miR-210相對表達量在孕早期已發生異常,這3項指標或可作為PE預測和早期診斷的良好的生物標志物。

