基于生物信息學分析硬皮病的發病機制
郭嘉,卞華,陳爽,單雨,卞博,
(1.河南中醫藥大學第二附屬醫院,河南省中醫院風濕病科,鄭州 450008;2.南陽理工學院張仲景國醫國藥學院,河南省張仲景方藥與免疫調節重點實驗室,河南 南陽 473004)
硬皮病也稱系統性硬化癥,其特征是廣泛的血管損傷和功能障礙,血管生成受損,免疫失調和皮膚、內臟器官的進行性纖維化[1]。纖維化的發病機制主要涉及缺血再灌注、氧化應激以及纖溶和凝血功能失衡[2]。硬皮病發病有多種免疫異常,包括T細胞、B細胞和巨噬細胞[3]共同參與。硬皮病早期纖維性病變伴有血管周圍炎癥細胞浸潤,主要由T淋巴細胞和單核細胞共同參與[2]。研究[2,4]顯示,超過90%的硬皮病患者能檢測到激活的血管、上皮和免疫細胞產生促纖維化的細胞因子、趨化因子、生長因子、脂質介質和自身抗體(抗DNA拓撲異構酶Ⅰ、抗著絲粒和抗RNA聚合酶抗體)。目前,多數研究認為硬皮病發病與基因遺傳、環境誘導、病毒感染有關。本研究基于基因表達圖譜(Gene Expression Omnibus,GEO)數據庫芯片數據,并與正常人群進行比較,探討硬皮病發病的分子機制。
1 材料與方法
1.1 GEO芯片數據及硬皮病差異表達基因(differentially expressed genes,DEGs)獲取
登錄GEO數據庫(https://www.ncbi.nlm.nih.gov/geo/ ),以“scleroderma”為關鍵詞進行檢索;獲取以GPL14951-11332為平臺文件的GSE117928芯片數據[5]。該芯片使用illumina BeadChips方法對18例硬皮病患者(硬皮病組)和19例正常對照者(正常組)進行全基因組mRNA轉錄和整體DNA甲基化分析。使用R軟件中的“limma”包進行t檢驗,過濾條件為|logFC|>1,調整P<0.05,篩選硬皮病的DEGs;并通過R軟件中“pheatmap”包繪制熱圖。
1.2 基因本體(gene ontology,GO)富集分析及蛋白質-蛋白質相互作用(protein-protein interaction,PPI)網絡核心靶點獲取
使用R軟件中的“colorspace”“stringi”“org.Hs.eg.db”“ggplot2”包對DEGs進行GO富集分析。將獲取的DEGs輸入STRING數據庫(https://www.string-db.org )進行PPI分析,物種設置為“Homo sapiens”,最低互動要求分數設置為0.9。下載相關數據,使用Cytoscape 3.8.0軟件,根據中介中心度、接近中心度、程度中心性、特征向量中心度、基于局部平均連接度的方法、信息中心度以及網絡中心性,設置過濾條件為每項皆大于中位值,階梯式過濾2次,最終獲取核心靶點。
1.3 基因集富集分析(gene set enrichment analysis,GSEA)通路分析
GSEA是用來確定一組先驗定義的基因是否在兩種生物狀態之間顯示出統計上顯著、一致的差異的計算方法。將下載的GEO矩陣文件整理并分組為硬皮病組和正常組。使用GSEA 4.1.0軟件,基因功能數據庫選擇c2.cp.kegg.v7.4.symbols.gmt[Curated],檢驗次數設置為1 000。一般認為|NES|>1,P<0.05,FDRq<0.25的通路存在顯著差異[6]。
1.4 免疫細胞浸潤(immune cell infiltration,ICI)分析
將獲取的GSE117928芯片數據進行ICI分析。采用CIBERSORT標 準,perm=1 000,P<0.05為過濾條件,獲取硬皮病組和正常組中20類免疫細胞表達的相對含量。分析2組免疫細胞的差異和硬皮病組內各免疫細胞的相關性。
2 結果
2.1 DEGs獲取結果
結果顯示,共獲取硬皮病組與正常組DEGs 722個,其中上調基因298個,下調基因424個。見圖1。
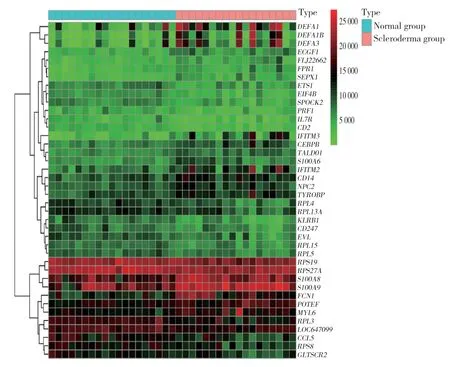
圖1 正常組與硬皮病組DEGs熱圖Fig.1 Heat map of differentially expressed genes between normal and scleroderma groups
2.2 GO富集分析及PPI核心靶點獲取結果
GO富集分析結果顯示,DEGs多富集在中性粒細胞活化參與免疫反應、嗜中性粒細胞脫顆粒、髓系細胞分化、對脂多糖反應、積極調節防御反應、對細菌源分子的反應、先天免疫反應的調節、正向調節細胞因子的產生、對生物刺激反應的調節、核糖核酸分解過程等生物功能,見表1。登錄STRING數據庫,輸入DEGs構建PPI網絡。下載相關數據,導入Cytoscape軟件,使用CytoNCA插件對其進行分析,獲取核心靶點包括RPS27A、BTRC、FBXO32、ZBTB16、FBXO21、VHL、ATG7、CBLB、ANAPC1、COMMD9、CSNK1E、RPS8、MPHOSPH10、KRR1、RPL5,見圖2。
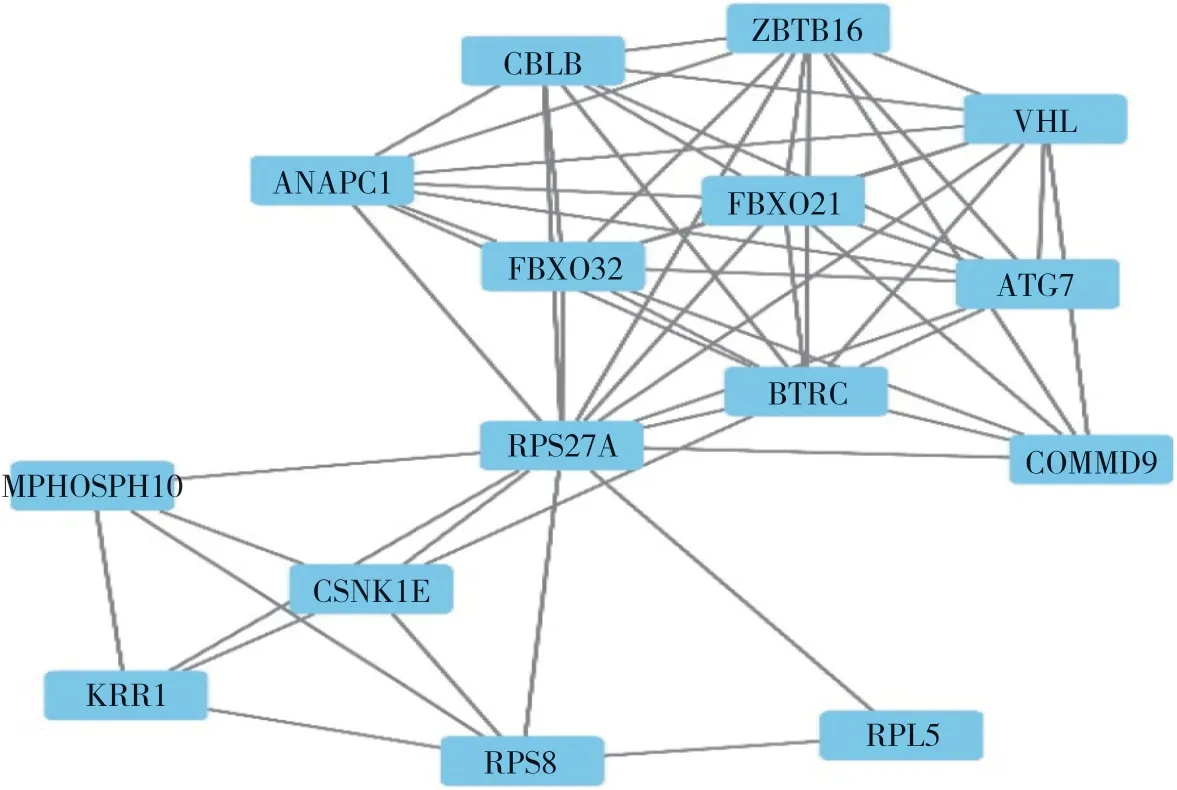
圖2 PPI網絡核心靶點Fig.2 Core targets of PPI network
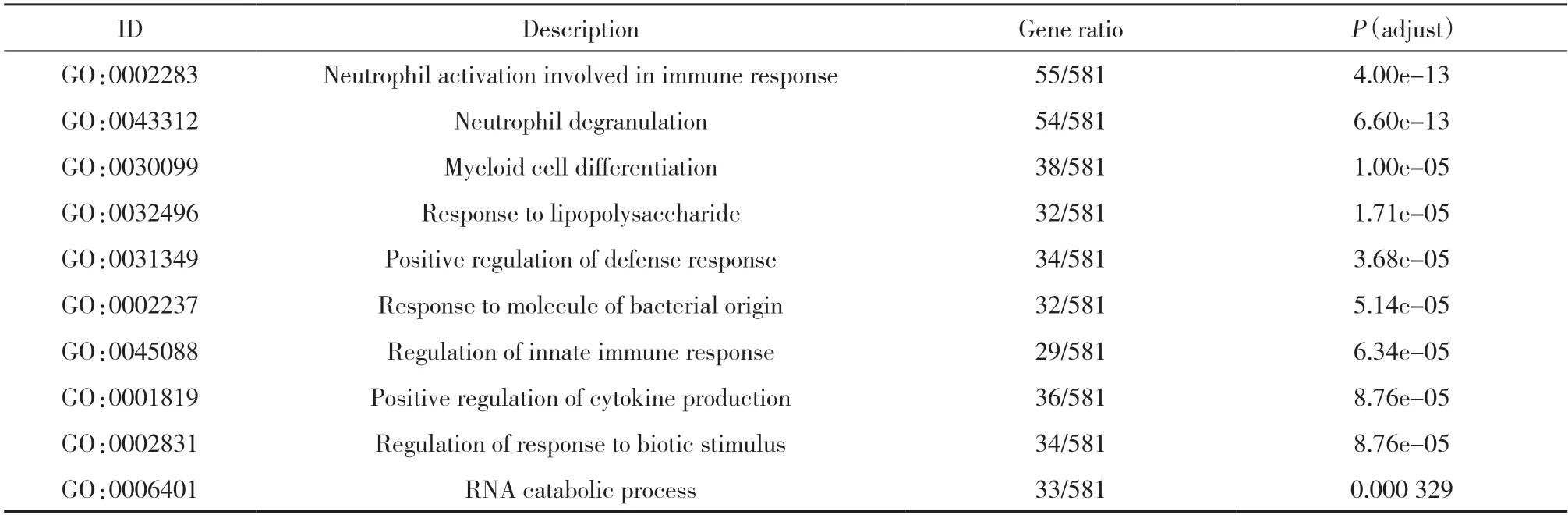
表1 GO富集分析結果(排名前十位)Tab.1 GO enrichment analysis results(top 10)
2.3 GSEA通路分析
通過GSEA通路分析,根據P值大小,篩選2組排名前五位的通路繪圖。結果顯示,硬皮病組排名前五位的通路為氨基糖和核苷酸糖代謝、溶酶體代謝、谷胱甘肽代謝、糖酵解糖異生和半乳糖代謝通路。正常組排名前五位的通路為自然殺傷細胞介質細胞毒性、剪接體、泛素介導的蛋白水解、小細胞肺癌、T細胞受體信號通路。見表2。
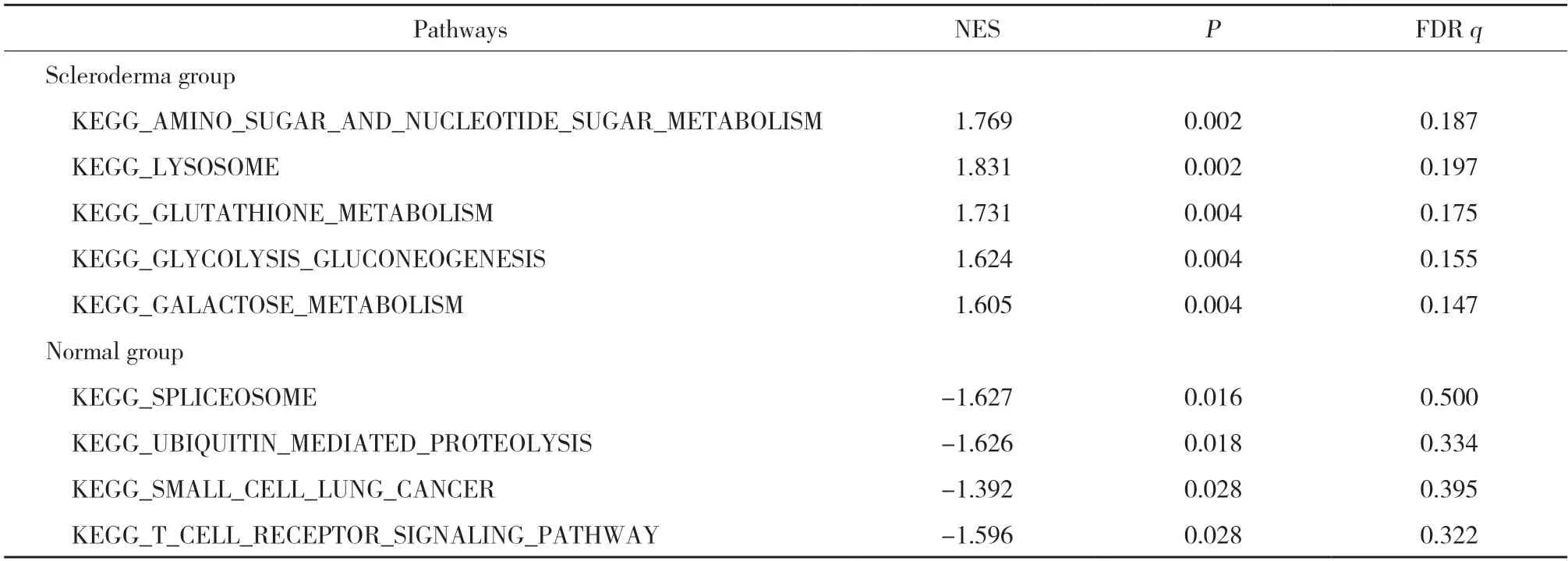
表2 GSEA富集通路分析Tab.2 GSEA enrichment pathway analysis
2.4 ICI結果
使用CIBERSORT篩選出20種免疫細胞表達的相對含量。結果顯示,正常組CD8+T細胞、幼稚CD4+T細胞表達明顯增加,而硬皮病組單核細胞表達明顯增加,見圖3。
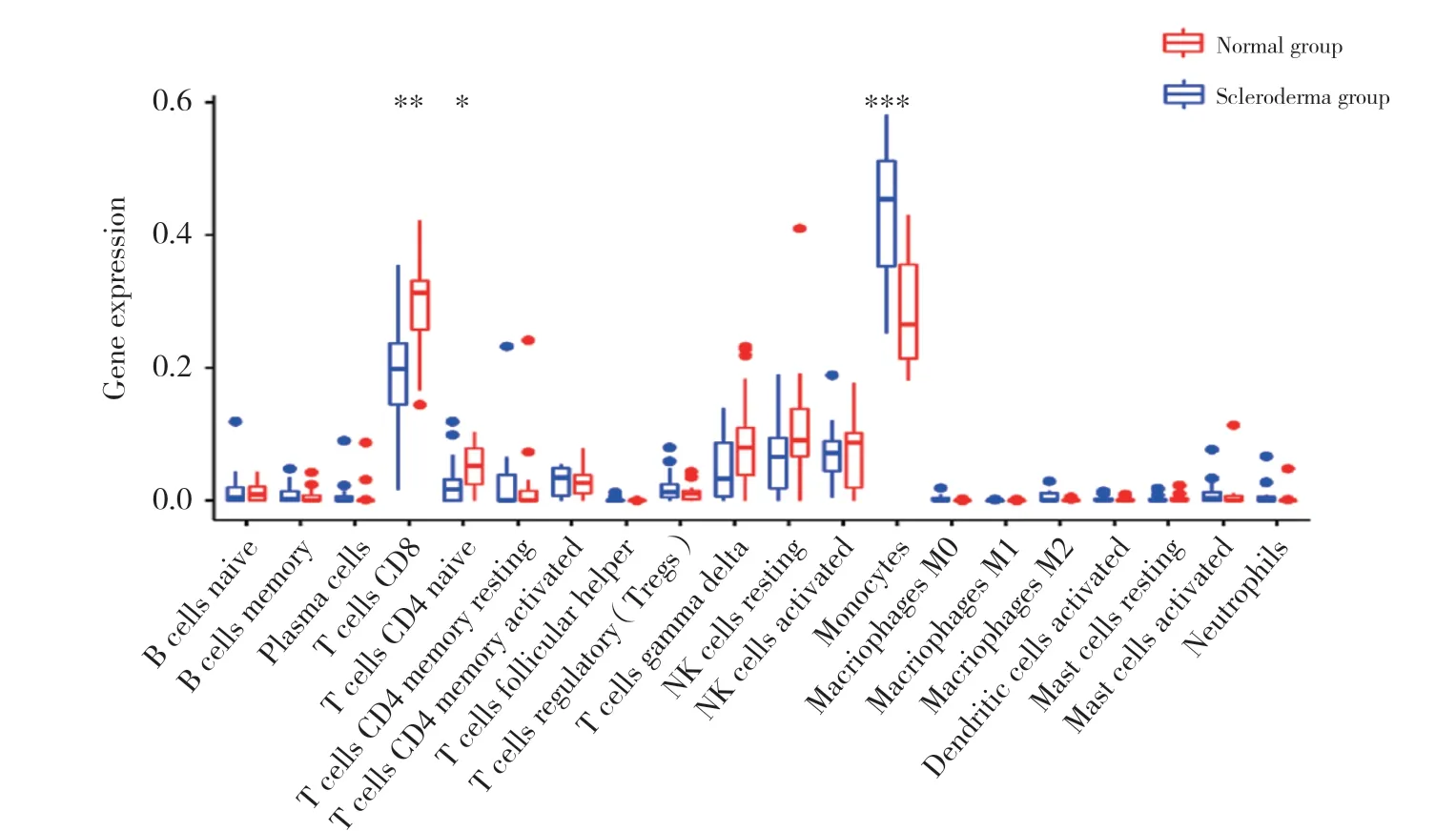
圖3 硬皮病組與正常組免疫細胞表達相對含量比較Fig.3 Comparison of immune cell expression between normal and scleroderma groups
硬皮病組各免疫細胞相關分析結果顯示,漿細胞與巨噬細胞M1、激活的肥大細胞,巨噬細胞M1與激活的肥大細胞,巨噬細胞M2與激活的樹突狀細胞,巨噬細胞M0與靜息的肥大細胞呈正相關;CD8+T細胞與靜息的CD4+T細胞、單核細胞,激活的CD4+T細胞與濾泡輔助T細胞、單核細胞,調節性T細胞與單核細胞,靜息的NK細胞與巨噬細胞M2呈負相關,見圖4。
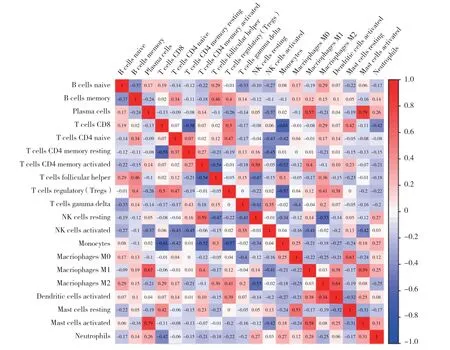
圖4 硬皮病組內免疫細胞表達相對含量相關性分析Fig.4 Correlation analysis of immune cell expression in scleroderma group
3 討論
本研究結果顯示,硬皮病組與正常組DEGs共722個,其中上調基因298個,下調基因424個。已有研究[7]顯示,氧化應激發生與硬皮病的發病機制有關,已知中性粒細胞在硬皮病的發病過程中會產生大量活性氧。在中性粒細胞激活過程中,由于氧化應激,細胞釋放被組蛋白、酶和其他抗菌蛋白覆蓋的DNA細絲。這些細絲稱為中性粒細胞外陷阱,參與細菌防御過程,但它們的形成在大多數情況下會導致中性粒細胞死亡[8]。中性粒細胞與血小板衍生的微粒相互作用,促進自噬和硬皮病患者凈副產物的產生[9]。抗中性粒細胞胞質抗體(anti-neutrophil cytoplasmic antibodies,ANCA)是在單核細胞、中性粒細胞和溶酶體初級顆粒中發現的酶自身抗體,與小血管炎癥的發病機制直接相關。研究[10]顯示ANCA與硬皮病患者肺間質肺炎、肺栓塞患病率增加有關。先天免疫在硬皮病發病過程中占據著重要地位。先天性淋巴樣細胞(innate lymphoid cells,ILCs)被發現于人類和小鼠的黏膜系統和內臟器官中,皮膚、肺和腸黏膜中含量豐富。ILCs存于胎兒肝臟和成人骨髓中,可以產生先天淋巴祖細胞以及B、T細胞系[11]。國際免疫學會聯合將ILCs分為自然殺傷細胞、ILC1、ILC2、ILC3和淋巴組織誘導物5個分型[12]。研究[13]顯示,ILC2在促纖維化的“2型”途徑中處于中心地位,能夠引發下游的一系列事件,通過這些事件使轉化生長因子-β信號上調,使膠原過度沉積而導致異常纖維化。ILCs在協調免疫反應、維持代謝穩態和調節組織炎癥方面發揮著重要作用[11]。GO富集分析顯示,DEGs多富集在中性粒細胞活化參與免疫反應、嗜中性粒細胞脫顆粒、髓系細胞分化、對脂多糖反應、積極調節防御反應、對細菌源分子的反應、先天免疫反應的調節、正向調節細胞因子的產生、對生物刺激反應的調節、核糖核酸分解過程等生物功能,與已有研究相互佐證。
本研究結果顯示,核心靶點包括RPS27A、BTRC、FBXO32、ZBTB16、FBXO21、VHL、ATG7、CBLB、ANAPC1、COMMD9、CSNK1E、RPS8、MPHOSPH10、KRR1、RPL5。現有研究[14]顯示,FBXO32、過表達的miR-26可增加骨骼肌橫截面積,降低FBXO32/atrogin-1和TRIM63/MuRF1的上調,抑制了心肌纖維化病變。ZBTB16與代謝綜合征關系密切,影響脂肪生成、心肌肥大和纖維化、血脂水平和胰島素的敏感性[15]。細胞外纖維連接蛋白和膠原網絡受VHL蛋白調節,VHL蛋白過表達會導致肺成纖維細胞增殖,促進纖維連接蛋白、膠原蛋白和細胞外纖維連接蛋白的表達。一項關于腎臟的研究[16]表明,受VHL和TGFb1調節的MXRA5蛋白具有抗炎和抗纖維化的功能。ZHOU等[17]研究發現VHL蛋白在博萊霉素誘導的肺纖維化中起著關鍵作用,可能是通過非依賴缺氧誘導因子的途徑。ATG7是傳統的大分子自噬的重要組成部分,它允許微管相關蛋白1A/1B輕鏈3B(LC3BI)通過磷脂酰乙醇胺偶聯轉化為LC3BII[18]。LC3BII在ATG12-ATG5:ATG16L1復合物的幫助下整合到吞噬體膜上,且ATG7也參與其中,導致自噬小體成熟;成熟的自噬小體與溶酶體結合,導致蛋白質和細胞器降解[19]。多項研究顯示ATG7缺陷與肺纖維化[18]、肝纖維化[20]、腸纖維化[21]、腹膜纖維化[22]關系密切。
GSEA富集分析結果顯示,硬皮病組排名前五位的通路包括氨基糖和核苷酸糖的代謝、溶酶體代謝、谷胱甘肽代謝、糖酵解糖質新生、半乳糖代謝。自噬-溶酶體是重要的細胞內自我降解系統,當自噬功能紊亂時對炎癥疾病(感染、自身免疫和癌癥、代謝紊亂、神經退行性變以及心血管和肝臟疾病[23])產生影響。研究[24]顯示自噬-溶酶體途徑與硬皮病硬化期皮膚纖維化密切相關。本研究結果顯示,正常組排名前五位的通路包括自然殺傷細胞介導的細胞毒性、剪接體、泛素介導的蛋白質水解、凱格小細胞肺癌、T細胞受體信號通路。T細胞中Th17、Treg、Th2、Th9和Th22與硬皮病的纖維化病變密切相關[25]。
ICI結果顯示,與正常組比較,硬皮病組單核細胞顯著增多,而CD8+T細胞、靜息CD4+T細胞減少,提示CD8+T細胞在硬皮病發病過程發揮重要作用。研究[26]顯示,硬皮病患者外周血CD8+T細胞和活化/記憶性CD8+T細胞計數降低,與硬皮病的臨床亞型、進展階段、器官受累以及毛細支氣管鏡評估的微血管異常有關。但是,目前關于硬皮病患者外周血中T細胞異常的證據仍是相互矛盾的,一些研究[27]顯示CD4+T和CD8+T細胞增加,另一些研究[28]則顯示CD4+T和CD8+T細胞降低,還有研究[29]顯示硬皮病患者和正常組之間沒有顯著差異,因此還需進一步論證。
綜上所述,硬皮病發病可能是通過調節RPS27A、BTRC、FBXO32、ZBTB16、FBXO21、VHL、ATG7、CBLB、ANAPC1等基因,參與中性粒細胞活化參與免疫反應、嗜中性粒細胞脫顆粒等生物過程,上調氨基糖和核苷酸糖代謝、溶酶體代謝、谷胱甘肽代謝、糖酵解糖異生和半乳糖代謝等通路來實現的。硬皮病發病與單核細胞增多密切相關。本研究從生物信息學角度對硬皮病發病機制進行探究,為今后臨床研究和基礎實驗提供了理論依據和數據支撐,但存在樣本量少,未進行細胞分子學實驗驗證等不足之處,期待今后進一步研究論證。

