靶向周細胞腫瘤血管正常化:重塑腫瘤微環境的新策略
勞深,何建行,梁文華
周細胞(pericytes,PCs)又稱壁細胞,嵌于毛細血管基底膜,可通過物理接觸和旁分泌信號通路與內皮細胞(endothelials,ECs)相互作用,進而調控血管形態及功能穩定性;同時,PCs構成的微血管和組織間隙屏障(如血-腦脊液屏障、血睪屏障)是維持內環境穩定的重要因素[1-2]。研究表明,由PCs構成的屏障缺失和功能異常會導致腫瘤血管出現扭曲、擴張、滲漏和功能失調[3],而PCs與腫瘤微環境(tumor microenvironment,TME)中各類細胞成分(如免疫細胞、基質細胞和癌細胞)均存在緊密的相互作用關系,并以此深刻地影響著腫瘤的發生、發展[4-5]。因此,探索PCs調控TME促進腫瘤發展的新機制及轉化研究具有重大的生物學意義和臨床價值。
既往研究表明,靶向ECs的抗血管治療是一種頗有前景的抗癌策略,然而耐藥性的發生在很大程度上影響了其臨床療效和深入、廣泛的應用[6-7]。有學者猜想,腫瘤可介導PCs異常增殖并覆蓋腫瘤血管以保護腫瘤ECs,進而導致耐藥性的發生[8-9],但令人遺憾的是,靶向清除PCs聯合抗血管治療相關臨床試驗并未取得成功,甚至顯示出更多的附加毒副作用[10],提示PCs存在功能異質性,其介導TME影響腫瘤進展具有復雜性。本文全面概述了PCs在TME中的潛在功能與作用,并展望了靶向PCs的腫瘤抗血管治療及腫瘤血管正常化治療在重塑TME中的潛在價值,而后者或可通過重塑免疫抑制性TME成為抗腫瘤治療的新策略。
1 文獻檢索策略
以“Pericyte”“Tumor environment”“Normalizing tumor vasculature”“Immunomodulation”“NSCLC”“Targeting pericytes inhibitor/pericytes molecularly targeted therapy”“Antiangiogenic therapy/anti-VEGF/VEGFR therapies”為關鍵詞,在PubMed、Clinical Trials檢索相關文獻及臨床試驗,納入2011—2021年公開發表的非小細胞肺癌(non-small-cell-lungcancer,NSCLC)相關研究,排除非NSCLC臨床研究,最后通過人工閱讀摘要、篩選文獻主要觀點、分析數據及圖表后選擇出目標文獻。
2 PCs在TME中的潛在功能與作用
2.1 PCs是TME的重要細胞成分 TME是腫瘤細胞賴以生存和發展的復雜環境,存在T淋巴細胞、B淋巴細胞、自然殺傷(natural killer,NK)細胞等免疫細胞,也存在PCs、ECs、腫瘤相關成纖維細胞(cancer-associated fibroblasts,CAFs)等基質細胞,還存在各類信號分子(如細胞因子、趨化因子、基質金屬蛋白酶等分泌分子)和細胞外基質(extracellular matrix,ECM)等,各細胞成分間的異常相互作用深刻地影響著腫瘤的發生、發展[11]。現階段研究證實PCs在TME中普遍存在[12],但其在腫瘤進展中的功能與作用尚不明確,有研究顯示侵襲性實體瘤周邊微血管密度明顯增加,結構紊亂,形態迂曲、膨脹、呈囊狀,PCs常出現松散覆蓋,甚至缺如,其與ECs相嵌的基底膜也多厚薄不均、不完整,提示PCs與ECs間存在相互作用障礙并形成異常腫瘤血管系統和乏氧、高酸、高間質壓的免疫抑制性TME[13],利于腫瘤細胞生存、侵襲和轉移。另有大量研究表明PCs本身就是一種具有異質性的細胞群[14-15],不僅具有組織特異性及功能多樣性,還具有成脂、成骨和成軟骨樣細胞等分化能力,是機體快速響應病理和損傷信號的儲備干細胞之一[16]。
2.2 PCs與CAFs的串擾聯系 作為腫瘤基質的重要細胞成分,CAFs在TME中具有重要作用。有研究表明CAFs不僅可通過分泌多種細胞因子或代謝產物抑制免疫細胞功能、促進腫瘤侵襲與發展,還可重塑ECM并形成滲透屏障,阻止免疫細胞或藥物向腫瘤組織滲透,進而降低腫瘤治療效果[17-18]。現有研究認為具有干細胞特性的PCs是腫瘤和纖維化疾病CAFs的主要來源之一。HOSAKA等[19]研究表明,腫瘤可通過血小板衍生生長因子BB/血小板衍生生長因子受體β(PDGF-BB/PDGFR-β)信號通路誘導PCs-CAFs轉分化(pericytes-fibroblast transition,PFT),進而增加TME中CAFs成分并促進NSCLC、腸癌及惡性膠質瘤細胞系的侵襲和轉移。
2.3 PCs與ECs的串擾聯系 在TME中,PCs與ECs之間異常的相互作用會導致腫瘤血管畸變、新生和失能,而PDGF-BB/PDGFR-β信號通路對該過程的調節及PCs的增殖、遷移均至關重要[20]。研究表明,腫瘤細胞可通過激活ECs產生PDGF-BB并招募PDGFR-β陽性PCs,而后者可通過釋放血管內皮生長因子(vascular endothelial growth factor,VEGF)-A、血管生成素(angiopoietin,Ang)-1促進ECs的出芽和腫瘤血管新生,同時ECs會分泌Ang-2、Ang-1并競爭性結合二者的受體Tie-2,繼而破壞PCs與ECs之間的附著嵌合,并通過減少PCs的腫瘤血管覆蓋促進腫瘤細胞的增殖、生長[21]。此外,腫瘤來源的PDGF-BB還可進一步誘導ECs分泌基質細胞衍生因子-1(stromal cell-derived factor-1,SDF-1),而SDF-1可持續促進TME內PCs的遷移、募集,并增加PCs對腫瘤血管的屏障覆蓋[22]。MENG等[23]研究發現,被腫瘤“馴化”的屏障覆蓋會幫助腫瘤血管構成一個“盾罩”,保護腫瘤細胞免受藥物攻擊和免疫細胞監視,同時保持腫瘤血管的“完整性”以維持必要的氧供和營養,協助腫瘤細胞生存。臨床研究證實TME中PCs的高覆蓋屏障作用與腫瘤細胞增殖和不良預后相關[24],但值得注意的是,PCs的屏障作用也降低了腫瘤侵襲風險[25]。總而言之,PCs的覆蓋屏障不同會導致不同的預后,這就意味著臨床上靶向PCs屏障表型并不是唯一且理想的治療策略。
2.4 PCs旁分泌信號通路與腫瘤進展 近年來,越來越多的研究發現PCs的旁分泌信號可獨立調節腫瘤血管及周邊細胞的生物學功能:ZHANG等[26]通過分離、培養人膠質母細胞瘤PCs證實PCs可通過旁分泌高表達細胞因子CC亞族趨化因子配體(C-C chemokine ligand,CCL)-5,激活膠質瘤細胞趨化因子C-C-基元受體(chemokine C-C-motif receptor,CCR)-5及下游絲氨酸/蘇氨酸激酶(AKT)-DNA依賴性絲氨酸/蘇氨酸蛋白激酶催化亞基(DNAPKcs)信號通路并促進DNA損傷修復,使腫瘤細胞逃避化療藥物替莫唑胺的殺傷,提示PCs可通過非屏障功能促進多形膠質母細胞瘤(glioblastoma multiforme,GBM)抵抗替莫唑胺的新作用機制。WONG等[27]研究發現,整合素β3低表達的PCs與多種腫瘤進展有關,在基因工程鼠的PCs中特異性敲除整合素β3基因可促進小鼠腸癌及肺癌細胞系的生長;相關機制研究表明,低表達整合素β3的PCs可旁分泌高表達細胞因子CCL-2、CXC趨化因子配體(CXC chemokine ligand,CXCL)-1和組織基質金屬蛋白酶抑制因子1(tissue inhibitor of metal protease 1,TIMP-1),其中CCL-2可直接作用于腫瘤細胞CCR-2并通過增強MEK1-ERK1/2-ROCK2信號通路促進腫瘤生長。LECHERTIER等[28]研究表明,黏附斑激酶(focal adhesion kinase,FAK)缺失的PCs可增強Pyk2-Gas6-Axl-Akt信號通路及其下游腫瘤血管的新生,而PCs旁分泌來源的高半胱氨酸蛋白61(cysteine rich 61,Cyr61)可促進腫瘤細胞的增殖。
2.5 PCs與免疫抑制性TME 作為TME的重要細胞成分,免疫細胞與腫瘤炎性反應和免疫反應密切相關。既往研究表明,PCs會釋放趨化因子和細胞因子以響應促炎刺激,如CCL-2、CCL-3、CXCL-1、干擾素(interferon,IFN)-γ和白介素(interleukin,IL)-8,同時PCs還會表達一些功能模式受體〔如Toll樣受體(toll-like receptor,TLR)-4、TLR-2、NOD 樣受體1(NOD-like receptor protein 1,NOD1)〕和巨噬細胞標志物〔如巨噬細胞單抗(ED-2)〕,這意味著PCs具有潛在的免疫調節作用[29]。需要指出的是,還有研究發現PCs具有細胞吞噬能力[30],并可調節不同類型的白細胞運輸,且PCs對TME中腫瘤相關巨噬細胞(tumorassociated macrophages,TAMs)有明顯影響,在小鼠異種移植模型中受PDGF-BB刺激的PCs可產生IL-33,而IL-33可大量招募TAMs并塑造免疫抑制性TME,進而促進腫瘤細胞侵襲和轉移。此外,PCs衍生的趨化因子CXCL-12/SDF-1還可激活表皮生長因子(epidermal growth factor,EGF)/巨噬細胞集落刺激因子 -1(macrophage-colony stimulating factor,CSF-1)信號通路,促進/誘導表達CXC趨化因子受體(CXC chemokine receptor,CXCR)-4的TAMs與腫瘤細胞結合,繼而促進二者共同向腫瘤血管區域募集、遷移[31]。有研究發現,膠質母細胞瘤中M2樣巨噬細胞可通過貓眼綜合征染色體區候選基因1(CECR1)-PDGF-BB/PDGFR-β信號通路上調PCs中骨膜素的沉積和表達[32],而骨膜素是ECM的重要成分,具有促腫瘤血管新生的作用。此外,還有研究者通過pdgfb(ret/ret)小鼠模型發現PCs缺失可導致細胞因子IL-6表達上調、骨髓來源的抑制細胞(myeloid derived suppressor cells,MDSCs)遷移增加,而后者大量募集可導致免疫抑制性TME,進而促進腫瘤細胞的生存和侵襲[33]。
HAMZAH等[34]通過胰腺癌自發瘤小鼠模型(RIP1-Tag5)證實PCs可調節TME中T淋巴細胞增殖活性,而在PCs中特異性敲除RGS5基因可促進PCs腫瘤血管正常化,在明顯地減少腫瘤缺氧和血管滲漏的同時增加免疫細胞浸潤并提高荷瘤小鼠存活率,相關機制研究表明,PCs可通過G蛋白信號通路調節蛋白-5(RGS5)基因和IL-6依賴性信號通路抑制CD4+T淋巴細胞增殖和活化,在體外促進CD4+T淋巴細胞失能。需要指出的是,TIAN等[35]研究證實高覆蓋具備屏障功能的PCs的惡性腫瘤周圍浸潤著更多的Th1效應免疫細胞(如CD8+T淋巴細胞),但同時可見惡性腫瘤細胞浸潤增加,其機制如下:一方面PCs可旁分泌CXCL-9和CXCL-12,招募表達受體CXCR-3和CXCR-4的CD8+T淋巴細胞;另一方面,CXCL-12分泌同時可增加依賴CXCR-4趨化、遷移的惡性腫瘤細胞的侵襲,同時CXCL-12還可增強細胞因子轉化生長因子-β(transforming growth factor-β,TGF-β)和IL-10的表達,而TGF-β和IL-10可抑制T淋巴細胞增殖活性和抗原呈遞細胞活性。TAVERNARI等[36]研究發現,在中樞神經系統淋巴瘤中PCs可通過旁分泌途徑高表達CXCL-9并趨化、增強惡性B淋巴細胞的遷移和侵襲,進一步證實了上述觀點。總而言之,PCs可通過異常旁分泌通路與腫瘤細胞/TME各類細胞成分進行串擾聯系,提示靶向PCs來源的異常旁分泌信號通路可能是腫瘤抗血管治療的新策略。
3 靶向PCs的腫瘤抗血管治療及腫瘤血管正常化治療在重塑TME中的潛在價值
抗血管治療一直是抗腫瘤治療的重要研究方向,其靶點主要分為抗血管ECs和抗血管PCs兩個方向,其藥物類型主要分為小分子酪氨酸激酶抑制劑(tyrosine kinase inhibitors,TKIs)和大分子單克隆抗體(mAb),其中前者代表性藥物包括安羅替尼(Anlotinib)、尼達尼布(Nintedanib)和舒尼替尼(Sunitinib),后者代表藥物主要為靶向血管ECs的VEGF/血管內皮生長因子受體(vascular endothelial growth factor receptor,VEGFR)單抗。需要注意的是,雖然靶向ECs的抗血管聯合治療在多個Ⅲ期臨床試驗中展示出對實體瘤患者生存期的改善,但在NSCLC患者中,其機制不明的有限獲益和耐藥性在很大程度上影響了腫瘤抗血管藥物的深入、廣泛應用。靶向PCs抗血管治療NSCLC的臨床研究詳見表1。
既往研究推測PCs的覆蓋屏障作用是腫瘤抗血管治療藥物產生耐藥性的重要機制,但近年來越來越多的臨床試驗表明,無論單藥靶向清除PCs〔即靶向血小板衍生生長因子(platelet derived growth factor,PDGF)/血小板衍生生長因子受體(platelet derived growth factor receptor,PDGFR)的TKIs〕還是聯合靶向ECs的抗血管治療均多無明顯獲益,且伴隨更多的毒副作用(表2)。相關研究也證實抗血管治療在抑制腫瘤生長的同時會增加腫瘤侵襲和轉移風險[37-38],這種經典悖論也呼應了目前臨床上腫瘤抗血管治療獲益受限的困局,提示腫瘤PCs除了屏障作用外還存在旁分泌靶點和通路異質性[39],或需重新思考以靶向清除PCs或ECs為核心的治療策略的科學性。
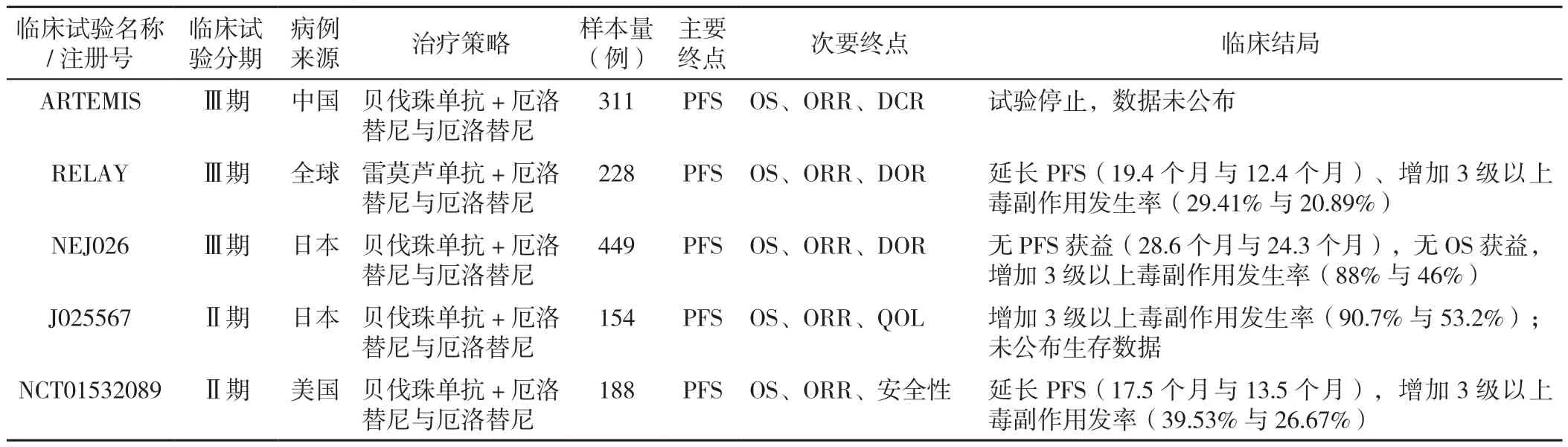
表2 靶向PCs的小分子抑制劑聯合VEGF/VEGFR單抗治療NSCLC的臨床研究匯總Table 2 Clinical studies about small molecule inhibitors molecularly targeting pericytes and anti-VEGF/VEGFR therapies for non-small cell lung cancer
JAIN[40]于2001年提出了腫瘤血管正常化概念,即通過合理運用抗血管生成藥物使腫瘤血管結構和功能在特定時間窗內趨于正常,繼而提高抗腫瘤治療效果并抑制腫瘤轉移,這一概念對研究PCs調控腫瘤血管和免疫抑制性TME具有重要指導作用,即不應以靶向清除PCs或腫瘤血管為目的,而應靶向導致PCs或腫瘤血管功能異常改變的旁分泌靶點及信號通路。MENG等[41]通過雙光子共聚焦顯像、熒光微球活體超聲造影等手段證實腫瘤血管正常化可明顯增加TME內藥物富集并有效增敏化療,且靶向PCs腫瘤血管正常化可恢復小鼠肺癌、肝癌模型中腫瘤血管結構和功能,相關機制研究表明腫瘤細胞可介導血管PCs高表達己糖激酶2(hexokinase 2,HK2),并通過增加糖酵解代謝水平及下游Rho相關蛋白激酶(ROCK)-肌球蛋白輕鏈(MLC2)信號通路增加PCs收縮性、破壞PCs及腫瘤血管功能。需要指出的是,傳統觀點認為只有破壞或清除腫瘤新生血管方可使藥物彌散并增敏化療,這也曾被認為是聯合抗血管治療后有效抑制腫瘤的作用機制之一,但目前這種破壞性的抗血管治療策略的核心正在受到挑戰[42],尤其是針對實體瘤而言。HUANG等[43]研究發現,腫瘤內CD8+T淋巴細胞浸潤與腫瘤內正常血管的分布和數量密切相關,而不是碎裂異常的腫瘤血管,這與MENG等[41]研究結論相似。此外,YONUCU 等[44]、R?HRIG 等[45]分別通過數學模型、MT6纖維肉瘤小鼠模型證實腫瘤血管正常化治療相較于傳統抗血管治療能明顯地增加實體瘤內核心區域藥物濃度及分布。
4 小結與展望
綜上所述,現階段聯合抗血管治療實體瘤的困境或可通過靶向PCs腫瘤血管正常化而有所突破,即靶向PCs異常旁分泌靶點及信號通路,促進腫瘤血管結構及功能正常化,糾正免疫抑制性TME,恢復腫瘤核心區藥物滲透,充分增敏化療、TKIs和免疫檢查點抑制劑(immune checkpoint inhibitors,ICIs)等聯合治療。因此,靶向PCs的腫瘤血管正常化治療或將成為重塑TME和臨床抗腫瘤治療的新策略。
作者貢獻:勞深進行文章的構思,文獻的收集、整理,負責撰寫論文;何建行、梁文華負責文章的質量控制,對文章及項目整體負責并進行監督管理;梁文華進行論文的審查和修訂。
全體作者聲明本文無利益沖突。

