趨化因子CXCL1在增殖期嬰幼兒血管瘤組織中表達研究及外源性CXCL1對血管瘤干細胞的影響
翟曉玥,吳 瑤,婁 寅,謝 娟,李紅紅,曹東升
嬰幼兒血管瘤(infantile hemangiomas,IH)發生在約4%~5%的嬰兒中,是兒童期最常見的良性腫瘤之一[1],發病機制不明。雖然大多數IH會發生自發性消退,但根據腫瘤生長的位置不同,部分IH仍會造成功能損害甚至危及生命[2]。對于有干預指征的患兒宜行早期治療。IH是以內皮細胞異常增生和血管結構異常為特征的病變。血管瘤干細胞(hemangioma stem cells,HemSCs)被確定為IH的細胞來源[3]。既往研究[4-5]中,通過作用于HemSCs,可減少血管生成和促進成脂分化,為IH的治療提供了新的思路。趨化因子在腫瘤的發生發展中起著重要作用。CXCL1作為趨化因子的一種,在腫瘤(包括肝癌和結腸癌)的血管生成中發揮重要作用[6-7]。Yamashita et al[8]采用人血管生成抗體陣列膜對增殖期與非增殖期IH的血液樣本研究發現兩者間CXCL1具有表達差異,然而其在增殖期IH的組織中的表達尚無報道。該研究目的是探索CXCL1在增殖期IH組織中的表達情況及其對HemSCs的影響,為IH的治療提供新思路。
1 材料與方法
1.1 材料
1.1.1血管瘤病理組織 20對瘤及瘤旁標本取自2015年1月—2021年6月在安徽醫科大學第二附屬醫院整形外科手術切取后經病理科確診為IH增殖期的患兒。其中男7例,女13例,年齡2~15個月。本研究獲得安徽醫科大學第二附屬醫院倫理委員會批準,征得患兒家屬同意并簽署知情同意書。
1.1.2主要試劑與儀器 CD133免疫磁珠試劑盒(德國Miltenyi Biotec公司),ECM培養基(美國ScienCell公司),PBS(美國Hyclone公司),胎牛血清及胰酶(美國Gibco公司),CXCL1一抗(美國Santa Cruz公司),免疫組化試劑盒(北京中杉金橋有限公司),CXCL1重組蛋白(上海生工生物工程股份有限公司),細胞培養箱和超凈臺(美國Thermo Fisher公司),倒置和正置顯微鏡(日本Olympus公司),酶標儀(上海科華生物工程股份有限公司)。
1.2 HemSCs原代細胞分選增殖期IH組織用PBS清洗去除表面血凝塊,用眼科剪和小鑷子去除較大脂肪、筋膜組織。然后將剩余組織放入5 ml離心管中,剪成1 mm3大小的組織塊,加入等體積0.25% Ⅳ膠原酶置于37 ℃水浴箱中消化2 h。消化完全后用200目的無菌濾膜過濾,獲得單細胞懸液。每1×108個細胞加入100 μl CD133免疫磁珠充分混合。將細胞懸液加入分選柱中,收集磁珠結合的CD133陽性細胞。以5×105個細胞/孔接種于500 ng/ml的纖維連接蛋白包被的6孔培養板中,置于37 ℃、5% CO2的細胞培養箱內。24 h后傳代接種。
1.3 免疫組化染片前將石蠟切片脫蠟,枸櫞酸鈉抗原修復15 min,過氧化物酶抑制劑處理15 min,洗滌后破膜10 min,再次洗滌后用10%山羊血清室溫封閉1 h,孵育一抗CXCL1后置于暗盒中4 ℃過夜。第2天洗滌后用反應增強液15 min,二抗孵育15 min后DAB顯色,蘇木精染色后酒精梯度脫水,自然風干后封片,于正置顯微鏡下觀察拍照。每例組化標本在400倍鏡下隨機取5處完整而不重復的視野進行定量分析,測定CXCL1蛋白免疫組化反應陽性面積的百分率和平均光密度,取每張切片的均值作為該例的測量值。
1.4 CCK-8增殖實驗使用CCK-8法檢測HemSCs細胞增殖能力。取對數生長期HemSCs細胞,經胰酶(含0.25% EDTA)處理后用ECM(含0、10、20、50、100 ng/ml CXCL1,濃度設置參考Cui et al[9],0 ng/ml CXCL1即為對照組)培養基重懸計數,2 000個細胞/孔接種于96孔板。培養24、48、72 h后,每孔加入CCK-8 20 μl,細胞培養箱中放置2 h后,立刻在設置為450 nm波長的酶標儀上測吸光度(optical density,OD)。每組設置5個復孔,實驗重復3次。
1.5 遷移實驗Transwell小室用于檢測CXCL1對HemSCs細胞遷移能力的影響。24孔板(Transwell下室)中每孔加入500 μl的10% FBS ECM培養基(含50 ng/ml CXCL1)。上室加入HemSCs 2.0×104個細胞/孔,每孔加入150 μl的10% FBS ECM培養基。培養24、48 h后,將24孔板從培養箱中取出。小室在4%多聚甲醛中固定20 min,棉簽擦去上層細胞,PBS洗滌2次。結晶紫染色15 min后再洗滌2次,棉簽擦干后在倒置顯微鏡下觀察拍照。每組設置3個復孔,實驗重復3次。每個遷移小室復孔在100倍鏡下隨機取3處完整而不重復的視野進行定量分析,測定遷移細胞數量,取3個復孔的均值作為該組的測量值。

2 結果
2.1 CXCL1在增殖期IH瘤內表達高于瘤旁對增殖期IH標本進行CXCL1免疫組化染色發現CXCL1在增殖期IH間質中表達,血管中無表達,見圖1。總體CXCL1表達量不高,但瘤內間質中CXCL1表達量高于瘤旁。瘤內CXCL1陽性面積率為(0.773±0.101)%,而在瘤旁僅占(0.268±0.081)%,差異有統計學意義(t=7.843,P<0.001)。瘤內CXCL1平均光密度(1.238±0.099)高于瘤旁(0.835±0.150),差異有統計學意義(t=4.487,P<0.01)。

圖1 增殖期IH免疫組化染色 ×400
2.2 HemSCs原代分離和培養經CD133免疫磁珠分選后,所得細胞形態均一,得到HemSCs原代細胞純度較高。接種4 h后貼壁,細胞呈長梭形。P3代培養24 h后光鏡下拍照,見圖2。

圖2 HemSCs原代細胞培養 ×200
2.3 CXCL1促進HemSCs增殖設置5組重組蛋白CXCL1濃度(0、10、20、50、100 ng/ml)與提取的HemSCs原代細胞進行增殖實驗,實驗發現使用外源性CXCL1刺激后,HemSCs細胞數相較于未刺激組增加,且24、48、72 h都有差異(F=14.610,P<0.001;F=14.430,P<0.001;F=5.388,P<0.01)。
比較3個時間點的50和100 ng/ml CXCL1刺激后的細胞增殖率,發現差異無統計學意義(t=0.261,P>0.05;t=0.785,P>0.05;t=0.098,P>0.05)。CXCL1促進HemSCs增殖,后續實驗使用50 ng/ml作為CXCL1的濃度。見圖3。

圖3 不同濃度CXCL1對HemSCs的增殖影響
2.4 CXCL1對HemSCs遷移無影響采用50 ng/ml CXCL1濃度對HemSCs進行遷移實驗,結果發現對照組和CXCL1處理組間細胞數差異無統計學意義。培養24 h后對小室細胞計數統計分析得:對照組細胞數(122.0±10.4)個,CXCL1處理組(127.8±14.9)個,兩者比較差異無統計學意義(t=0.634,P>0.05)。培養48 h后對小室細胞計數統計分析得:對照組細胞數(348.8±18.9)個,CXCL1處理組(356.5±16.3)個,兩者比較差異無統計學意義(t=0.622,P>0.05)。由此得出CXCL1對HemSCs遷移無影響,見圖4、5。

圖4 50 ng/ml CXCL1對HemSCs遷移影響 ×100
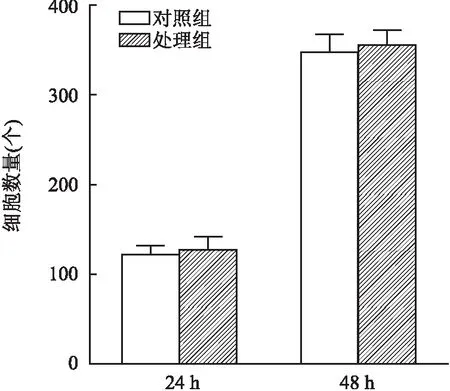
圖5 CXCL1處理組與未加CXCL1對照組間遷移細胞數比較
3 討論
在本研究中經免疫組化發現在增殖期IH組織中瘤內CXCL1蛋白陽性面積率和平均光密度高于瘤旁組織。基因在瘤內和瘤旁的差異性表達是研究疾病的重要依據。CXCL1在肝癌和乳腺癌中都具有瘤內和瘤旁的差異,研究[9-10]發現CXCL1促進乳腺癌和肝癌細胞的增殖和遷移。趨化因子CXCL1對HemSCs的作用尚無研究。通過CD133免疫磁珠法提取IH組織中的HemSCs原代細胞。當使用外源性CXCL1作用于HemSCs時,與未加CXCL1的對照組比較細胞增殖能力增強。相較于CXCL1對腫瘤的生長和轉移的影響,本研究得出外源性CXCL1對HemSCs原代細胞僅有增殖的影響。能否通過抑制CXCL1從而減弱HemSCs的增殖進而抑制增殖期IH的惡性進展有待后續進一步研究。CXCL1通過一系列下游通路促進腫瘤的惡性發展。比如通過ERK/MMP2/9通路促進乳腺癌的惡性發展[10],通過CXCL1介導的Akt磷酸化促進胰腺癌的遷移和侵襲[11]。CXCL1對于HemSCs增殖作用更詳細的機制有待進一步的研究。
綜上所述,CXCL1在增殖期IH瘤內間質中表達高于瘤旁間質,外源性CXCL1促進HemSCs增殖但對遷移無影響。CXCL1與HemSCs間的通路聯系及其對IH的治療價值有待后續深入研究。

