IgA腎病患者中人防御素5的臨床價值
李 含 費 梅 吳 輝
IgA腎病(IgA nephropathy,IgAN)是目前世界范圍內最常見的原發性腎小球疾病[1],其特征是腎小球系膜區以IgA或IgA沉積為主,伴或不伴其他免疫復合物沉積。大約20%~40%的患者在疾病診斷后的20年內進展至終末期腎臟病(end-stage renal disease,ESRD)[2]。目前IgAN發病機制仍不明確,有研究[3-4]表明,異常糖基化IgA1(galactose-deficient IgA1,Gd-IgA1)、遺傳、黏膜免疫異常等因素均參與IgAN發生和發展。據報道,在IgAN患者中腸腎軸是活躍的[5]。關于IgAN患者的大規模全基因組關聯研究(genome-wide association studies,GWAS)也表明IgAN易感位點與涉及腸道屏障功能維持、腸道黏膜對病原體的免疫反應以及某些腸道疾病有關[6]。其中DEFA基因簇編碼的α-防御素家族,參與維持腸黏膜屏障并調節黏膜免疫應答[6]。人防御素5(human defensin 5,HD5)屬于α-防御素的一種,是小腸中表達最豐富的抗菌物質[7],在腸道黏膜免疫中發揮重要作用。然而HD5在IgAN中的表達及與Gd-IgA1的關系的研究較少,本研究擬通過檢測IgAN患者血清HD5與Gd-IgA1水平,分析HD5水平與IgAN患者臨床、病理及Gd-IgA1的關系,探討HD5對IgAN患者的臨床價值。
1 資料與方法
1.1 一般資料 選取2021年1月至2021年7月在蘇州大學附屬第一醫院腎內科及中西醫結合科經腎活檢確診的原發性IgAN患者50例為研究對象,另選取同期在本院接受健康體檢者50例為正常對照組。其中IgAN組男性19例,女性31例,中位年齡31.50(28.75,39.75)歲;正常對照組男性23例,女性27例,中位年齡34.00(29.00,40.50)歲。IgAN組和正常對照組年齡、性別比較差異均無統計學意義(P均>0.05)。見表1。

表1 IgAN 患者組和正常對照組一般資料比較
納入標準:①符合IgAN診斷標準[8];②年齡>18歲;③具有完整的臨床與病理資料;④腎穿刺活檢前未使用糖皮質激素或免疫抑制劑。排除標準:①排除炎癥性腸病、慢性腹瀉等腸道疾病;②排除狼瘡性腎炎、類風濕關節炎腎損害、高血壓腎損害、糖尿病腎病、紫癜性腎炎等繼發性IgAN。本研究是根據蘇州大學附屬第一醫院機構審查委員會的原則進行的(倫理批號:2021-025)。
1.2 研究方法
1.2.1 資料收集 收集患者活檢時的臨床資料:包括年齡、性別、白細胞計數、血紅蛋白、尿紅細胞、24小時尿蛋白、血清肌酐、血尿酸、血清白蛋白、血清補體3(complement 3,C3)、血清補體4(complement 4,C4)、血清免疫球蛋白A(immunoglobulin A,IgA)、血清免疫球蛋白G(immunoglobulin G,IgG)、血清免疫球蛋白M(immunoglobulin M,IgM)、估算腎小球濾過率(estimated glomerular filtration rate,eGFR)等,eGFR采用腎臟疾病飲食改良MDRD簡化公式估算[9]。病理資料:IgAN患者腎臟病理分型采用2016年牛津腎臟病理分型(Oxford分型)[10]:MEST-C,包括:M:系膜細胞增生,其中M0<0.5,M1>0.5;E:毛細血管內皮細胞增生,其中E0無,E1有;S:節段腎小球硬化,其中S0無,S1有;T:腎小管萎縮/間質纖維化,其中T0≤25%,25%
1.2.2 血清HD5和Gd-IgA1水平測定 收集患者腎穿刺當天及正常對照者肘部靜脈血5 mL,室溫下放置2 h,離心機1 000 r/min離心20 min,離心后取上清置于-80℃冰箱中保存。采用雙抗體夾心酶聯免疫吸附法(enzyme linked immunosorbent assay,ELISA)測定血清中HD5水平(上海博凱公司,L201112020),Gd-IgA1水平(日本IBL,27600)。實驗步驟按照試劑盒說明書進行操作。
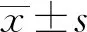
2 結果
2.1 IgAN患者和正常對照組血清HD5水平及Gd-IgA1水平比較 與正常對照組相比,IgAN患者血清HD5水平和Gd-IgA1水平均升高,差異有統計學意義(P<0.05)。見表2。

表2 IgAN患者和正常對照組HD5水平及Gd-IgA1水平比較
2.2 IgAN患者血清HD5水平與臨床指標及Gd-IgA1水平的相關性分析 將IgAN患者血清HD5水平與臨床指標及Gd-IgA1水平進行Spearman相關性分析,結果顯示,IgAN患者血清HD5水平與血清肌酐、24 h尿蛋白、血尿酸、Gd-IgA1水平呈正相關,與eGFR呈負相關(P均<0.05)。見表3。多元線性回歸分析(向前法)結果顯示,HD5與Gd-IgA1水平(β=0.479,P=0.003)呈正相關,與eGFR(β=-0.034,P<0.001)呈負相關。見表4。

表3 HD5與臨床指標及Gd-IgA1水平的相關性分析(n=50)

表4 HD5與eGFR、Gd-IgA1的回歸分析
2.3 不同牛津病理分型患者血清HD5水平的比較 根據牛津分型對IgAN患者按腎小球系膜細胞增生(M)、毛細血管內皮細胞增生(E)、節段腎小球硬化(S)、腎小管萎縮/間質纖維化(T)、細胞/纖維細胞性新月體(C)進行分組分析,結果顯示,與T0組相比,T1和T2組血清HD5水平升高(P<0.05),其余各組間差異無統計學意義(P>0.05)。見表5。

表5 不同牛津病理分型患者血清HD5水平的比較
3 討論
IgAN是世界范圍內最常見的原發性腎小球疾病,是終末期腎病的常見病因之一,其發病機制仍不明確,可能與遺傳因素、環境因素及黏膜免疫異常有關[4]。臨床研究[11]發現IgAN感染上呼吸道或胃腸道后出現反復或加重情況,并提出IgAN的發生發展可能與黏膜感染相關。有研究[12-13]顯示HD5可通過調節腸道微生物穩態,誘導炎癥因子釋放等影響腸黏膜免疫功能。當腸道黏膜免疫功能異常時,機體出現免疫耐受缺陷,腸黏膜屏障功能下降,毒素吸收入血,激活腸黏膜相關淋巴組織,使機體產生大量Gd-IgA1,形成循環免疫復合物,最終沉積于腎小球系膜區,導致IgAN[5]。本研究結果顯示,與正常對照組相比,IgAN患者血清HD5水平升高,提示HD5可能在IgAN的發生發展中發揮作用。研究進一步發現,IgAN患者血清HD5水平與血清肌酐、24小時尿蛋白、血尿酸水平呈正相關,與eGFR呈負相關,逐步多元線性回歸分析結果顯示,HD5與eGFR呈負相關,表明IgAN患者血清HD5水平越高,患者腎功能越差,這與Feng等[14]的研究結果一致,提示HD5可能通過介導腸黏膜免疫異常間接參與IgAN的病情進展。
IgAN病理表現多樣,不同病理改變與患者的預后有很大的關系。在IgAN牛津分型評估的病理標準中,研究[15]表明腎小管萎縮/間質纖維化可獨立預測IgAN患者預后。本研究結果顯示,與T0組相比,T1和T2組血清HD5水平升高(P<0.05),表明HD5水平越高,其腎小管、間質損傷可能越重,預后越差。
目前,大多數學者認為Gd-IgA1是IgAN的始動因子,IgAN患者中,Gd-IgA1產生增多,被循環中抗聚糖的自身抗體識別,Gd-IgA1分子抗原與自身抗體形成循環免疫復合物,誘導炎癥反應和系膜細胞增殖造成腎小球損傷[3]。本研究發現IgAN患者血清Gd-IgA1濃度高于正常對照組,與此前研究[16]結果一致。有研究[17]表明,IgAN患者血清Gd-IgA1水平升高與蛋白尿的排泄增加和腎功能惡化相關,并且高水平的Gd-IgA1也被認為與IgAN不良預后有關[18]。本研究發現IgAN患者血清HD5水平與Gd-IgA1水平呈正相關,目前關于IgAN患者血清HD5水平與Gd-IgA1水平的相關性研究較少,基于兩者與腸道黏膜免疫的關系,推測HD5可能通過介導腸黏膜免疫失調,使機體產生Gd-IgA1增多,促進IgAN發生發展。
本次研究存在一些不足,一、本研究納入的樣本量較少,未對患者進行長期隨訪觀察;二、本研究只檢測了IgAN患者和正常對照組血清HD5,未檢測其他慢性腎病患者血清HD5水平。后續將進一步擴大研究樣本,納入其他慢性腎病患者研究,建立長期隨訪觀察,進一步明確HD5在IgAN患者中的臨床意義。
綜上,IgAN患者血清HD5水平升高,其與患者腎功能、Gd-IgA1及腎小管萎縮/間質纖維化密切相關,提示HD5可能參與IgAN疾病進展。

