甲鈷胺聯合紅外線照射對奧沙利鉑相關周圍神經毒性的治療效果
孫永俠 錢和生
化療作為全球抗腫瘤治療的一線方案,其在抗腫瘤細胞生長的同時,也會影響健康細胞,誘發各種副作用。其中,化療誘導性周圍神經病變 (chemotherapy-induced peripheralneuropathy, CIPN)是指化療藥物所致的周圍神經系統損害,主要表現為感覺神經病變,可同時伴隨運動和自主神經改變[1],患者可表現為神經病理性疼痛,嚴重者需要減少化療劑量或停止化療,影響患者的生存期和生活質量[2-3]。奧沙利鉑是廣泛用于治療結直腸癌的一線藥物[4],可引起神經癥狀,早期急性癥狀主要特征為急性觸發性肢端感覺異常,慢性則以遠端感覺神經病變為主,多由奧沙利鉑的累積劑量所致[5]。使用鉑類藥物治療的腫瘤患者發生感覺改變和疼痛癥狀者高達40%[6]。
CIPN的發生機制仍不清楚,各種預防措施或藥物治療尚未達到令人滿意的臨床效果[7]。甲鈷胺可修復受損神經,加速神經傳導速度,被普遍用于治療化療引起的周圍神經病變[8]。紅外線照射治療作為一種非侵入性的局部治療方法,利用紅外線照射產生溫熱效應進而消除無菌性炎癥達到消炎鎮痛的效果。近年來,紅外線照射療法在中樞神經系統疾病方面得到廣泛應用[9]。然而,甲鈷胺聯合紅外線照射治療對奧沙利鉑引起的周圍神經病變是否具有協同效果仍不清楚。本研究通過分析甲鈷胺聯合紅外線照射對比甲鈷胺單藥對奧沙利鉑相關周圍神經病變、患者功能狀態和疼痛評分的作用效果,為臨床奧沙利鉑所致周圍神經病變等相關臨床結局的治療提供參考。
1 資料與方法
1.1 一般資料 選取2019年1月至 2021年6月于阜陽市腫瘤醫院腫瘤內科進行治療的80例惡性胃腸腫瘤患者,其中男性53例,女性27例;年齡35~77歲;胃癌患者29例,結直腸癌患者51例。根據隨機數字表法分為試驗組(口服甲鈷胺聯合紅外線照射,n=40)和對照組(口服甲鈷胺,n=40)。兩組患者性別、年齡、卡氏功能狀態(Karnofsky performance status, KPS)評分、治療前周圍神經病變等級、奧沙利鉑累積劑量、治療前數字疼痛評分(numeric rating scale,NRS)等基線資料比較,差異均無統計學意義(P>0.05)。見表1。本項目通過阜陽市腫瘤醫院醫學研究倫理委員會審查批準(倫理批準號2022-02)。

表1 兩組患者一般情況比較
1.1.1 納入與排除標準 納入標準:①通過組織病理學檢查確診為晚期惡性胃腸腫瘤,且使用含有奧沙利鉑的方案進行治療的患者;②既往未使用其他可能影響神經毒性的藥物;③年齡18~80歲,具有良好認知能力,自愿參加并簽署知情同意書;④KPS評分≥70分,預計患者總生存期>3個月;⑤完成2個周期化療后出現不同程度的周圍神經病變;⑥試驗前1個月未進行其他周圍神經病變治療。排除標準:①因精神障礙無法進行自我評估者;②患者的依從性差,不配合資料收集和/或導致收集資料錯誤等影響最終療效判定;③妊娠或哺乳期婦女,過敏體質者;④具有嚴重的心血管、肝臟及腎臟病變,伴有其他嚴重性疾病或者狀況,包括未控制的活動性感染、嚴重腹瀉、嚴重的電解質紊亂、活動性播散性血管內凝血以及有明顯出血傾向的患者。
1.1.2 治療方案 對照組:口服甲鈷胺片(江蘇迪賽諾制藥有限公司,H20052564,0.5 mg×20片),每次0.5 mg, 每天3次,連續服用14 d。試驗組:在對照組基礎上聯合紅外線照射治療,使用紅外線治療儀(北京澳爾華泰科技有限公司,HW-100,京械注20182260194)照射患者病患部位,燈距30 cm,每次照射20 min,每天1次,連續治療1周,21 d為一個療程,2個療程后進行干預效果評價。在治療過程中,注意觀察患者皮膚情況,如患者自感皮膚灼熱,且自訴不能耐受,則立即停止照射。
1.2 觀察指標及方法
1.2.1 周圍神經病變分級 采用世界衛生組織20世紀70年代制定的周圍神經病變分級標準[10],評估內容包括感覺神經、運動神經和深部腱反射受損程度。根據受損嚴重程度分為5級(0~4級):正常為0級,輕度運動、感覺異常和腱反射變弱為1級;中度運動減弱傾向以及嚴重感覺異常為2級;運動顯著減弱以及難以忍受的感覺異常為3級;癱瘓為4級。
1.2.2 疼痛評分 采用NRS[11],記錄患者治療前后疼痛評分。NRS評分:0為無疼痛感;1~3為輕度疼痛,但不影響工作和生活;4~6為中度疼痛;7~9為重度疼痛,無法入睡;10為劇烈疼痛,無法耐受。
1.2.3 身體功能狀態 采用KPS評估患者的身體功能狀態[12],KPS主要用于評價患者日常活動能力、自我照顧能力及依賴醫療照護程度,是目前最常用的評估癌癥患者功能狀態的量表,采用0~100分計分法,每10分為一個等級,得分高代表功能狀態越好。
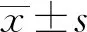
2 結果
2.1 兩組患者治療前后周圍神經病變比較 組內比較,對照組和試驗組治療后的神經病變等級均改善,差異有統計學意義(P<0.05), 對照組治療后有4例患者轉為0級,試驗組有8例,轉為0級。組間比較,對照組和試驗組治療后的神經病變等級分布差異無統計學意義(Z=-1.165,P=0.244)。見表2。

表2 兩組患者神經病變等級比較[例(%)]
2.2 兩組患者治療前后KPS評分比較 對照組組內治療前后KPS評分之間的差異無統計學意義(Z=-1.732,P=0.083)。試驗組治療后KPS評分改善,差異有統計學意義(Z=-5.099,P<0.001)。組間比較,對照組和試驗組治療后KPS評分差值之間的差異有統計學意義(Z=-5.316,P<0.001)。見表3。

表3 兩組患者KPS評分的組內比較[M(P25,P75),分]
2.3 治療前后兩組患者NRS評分比較 對照組及試驗組治療后患者NRS評分均降低,差異均有統計學意義(Z=-4.472、-5.327,P均<0.001)。組間比較,對照組和試驗組治療后NRS評分差值的差異有統計學意義(Z=-3.989,P<0.001)。見表4。

表4 兩組患者NRS疼痛評分的組內比較[M(P25,P75),分]
3 討論
周圍神經病變是腫瘤患者化療過程中嚴重的不良反應,約30%使用鉑類化合物、紫杉醇以及蛋白酶體抑制劑的患者在完成化療后1年或更長時間內仍會出現[13]。奧沙利鉑作為廣泛用于胃腸道腫瘤及其他惡性腫瘤的化療藥物,其誘導的CIPN對患者的生活質量造成了嚴重影響[14]。隨著周圍神經病變的發生,患者的治療計劃通常也需要做出改變,如通過減少奧沙利鉑的使用劑量,或暫停治療來防止神經病變癥狀的進一步進展[15],對患者的治療效果產生不良影響。
甲鈷胺是維生素B12的一種內源性輔酶,對神經組織具有特殊的親和力,可加快神經傳導速度,有效改善肢體疼痛等作用[15]。本研究結果顯示,甲鈷胺單藥使用能夠改善患者周圍神經病變等級,并降低疼痛評分,但單藥使用后的KPS評分并未顯著改善。紅外線照射療法作為簡便易操作的非藥物方法,能夠改善糖尿病性周圍神經病變[16-19],其治療原理是通過溫熱效應,在紅外線燈照射下,局部組織的溫度升高,毛細血管擴張,血液流動速度加快,細胞組織的再生能力提高,從而能夠促使神經功能恢復[16]。試驗組在甲鈷胺治療基礎上,加用紅外線照射治療,聯合使用的效果顯示,治療后患者周圍神經病變等級、疼痛評分以及KPS評分均有明顯改善。同時,紅外線照射可以提高患者的舒適度,改善疼痛及身體功能狀態,且治療過程中安全性較好,未見不良反應。從兩種方法治療效果來看,均可改善由奧沙利鉑所致的周圍神經病變、緩解疼痛程度,但甲鈷胺聯合紅外線照射治療還可同時提升患者身體功能狀態,值得臨床進一步關注。
本研究尚存在一定的局限性,研究結果尚未顯示兩種治療方法對奧沙利鉑所致周圍神經病變等級分布的差異效應,分析原因可能與結局指標的評價時間有關。本研究評價的是治療后相關臨床結局指標的即時效應,在將來的研究中可以適當延長隨訪時間以評價兩種方案的長期臨床治療效果。另外,還可采用多中心臨床隨機對照試驗研究,以進一步驗證甲鈷胺聯合紅外線照射治療對奧沙利鉑所致周圍神經病變的臨床使用價值。

