煙草腺毛優勢表達基因NtMYB108b的克隆及分析
余 婧,趙會納,閆筱筱,郭玉雙,王召軍,余世洲,王 兵,雷 波*
1.貴州省煙草科學研究院 煙草行業煙草分子遺傳重點實驗室,貴陽市觀山湖區龍灘壩路29號 550081 2.河南農業大學煙草學院,鄭州市文化路95號 450002
表皮毛為植物表皮細胞突起的特殊結構,通常分為分泌型和非分泌型。分泌型表皮毛(腺毛)能特異合成和儲存多種類型的次生代謝物,在防御食草動物和病原體等生物脅迫以及應對紫外線照射、強光或干旱等非生物脅迫中發揮著重要的作用[1-3]。此外,腺毛還是特殊次生代謝物合成的“細胞工廠”[3-4],薄荷(Mentha spicata)、薰衣草(Lavandula angustifolia)、青蒿(Artemisia annua L.)等植物的腺毛分泌物是生產香精香料或有效藥物成分的原料[5-8]。煙草(Nicotiana tabacum L.)的腺毛占總表皮毛數量的85%左右[9],其特異合成的類西柏烷二萜、蔗糖酯等分泌物是煙葉香味和香氣的前體物質,對煙葉的香氣品質有積極影響[10-11]。
轉錄因子(Transcription factors,TFs)是一類結合在啟動子上的特異蛋白,可激活(或抑制)靶基因在特定的時間或空間表達[12]。研究表明,MYB、MYC和WRKY等一些在植物腺毛中優勢(或特異)表達的轉錄因子可調控腺毛的發生、發育或次生代謝物的合成與分泌。Xu等[13]研究發現,番茄(Solanum lycopersicum)SlMYC1基因參與了VI型腺毛形成和萜烯的生物合成;Wang等[14]的研究表明,MsYABBY5基因在薄荷腺毛中特異表達并負向調控萜烯類物質的合成;Qin等[6]研究發現,在青蒿中AaMYB17基因的過表達可增加分泌型腺毛的密度并增加青蒿的青蒿素含量。其中,MYB轉錄因子是植物中最大的轉錄因子家族之一,根據MYB保守結構域重復的數量可分為1R-MYB、R2R3-MYB、3R-MYB(R1R2R3-MYB)和4R-MYB 4個類型[15-16]。R2R3-MYB是MYB轉錄因子最大的亞家族,通常分為22個亞組,每個亞組成員功能相似[15,17]。目前,R2R3-MYBs在煙草中的生物學功能已有報道,如NtMYB44b基因能響應ABA等激素誘導并對干旱脅迫產生應答[18];NtMYB4基因是調節煙草類黃酮生物合成的關鍵基因,并且在鹽脅迫響應中發揮著重要作用[19];NtMYB12基因通過正向調控NtCHS等黃酮醇生物合成途徑中結構基因的表達,增加黃酮醇的含量并增強煙草對低磷脅迫的耐受性[20]。然而,MYB108-like基因在植物腺毛中相關功能的研究還鮮見報道。
本實驗室前期以煙草K326葉片、去腺毛葉片和腺毛為材料,獲得了3者的比較轉錄組數據,發現18個注釋為MYB的基因在腺毛中上調表達明顯,其中5個注釋為MYB108,然而這些MYB108基因在煙草中的生物學功能仍未知。為此,從栽培煙草K326腺毛的cDNA中克隆NtMYB108b基因,對其進行生物信息學分析并檢測NtMYB108b基因在煙草不同組織中的相對表達量,同時分析葉片中NtMYB108b基因在響應SA等激素處理和干旱脅迫后的表達情況,旨在為揭示NtMYB108b基因的功能奠定基礎。
1 材料與方法
1.1 實驗材料及樣品采集
實驗材料為煙草(Nicotiana tabacum L.)K326。苗期培養條件為:16 h光照/8 h黑暗,溫度(25±2)℃,相對濕度60%。煙苗在5月上旬移栽大田,按當地栽培措施進行管理。使用Harada等[21]的凍刷法,用液氮速凍煙草葉片,然后用毛刷輕輕刮下腺毛備用,去除腺毛的葉片即為去腺毛葉片。采集苗期、團棵期、旺長期、現蕾期和成熟期植株葉片用于檢測NtMYB108b基因在不同生育期的相對表達量;采集現蕾期植株的頂葉、上二棚葉、腰葉、下二棚葉和腳葉用于檢測NtMYB108b基因在不同葉位中的相對表達量;采集苗期植株的根、莖及盛花期植株的花、葉和腺毛組織用于檢測NtMYB108b基因在不同組織中的相對表達量。分別向苗期植株葉片噴灑乙烯利(ET,5 mmol/L)、茉莉酸甲酯(MeJA,100 μmol/L)、水楊酸(SA,50 mg/L)、赤霉素(GA,100 mg/L)和脫落酸(ABA,10 μmol/L),并分別在噴灑后第0、6、12、24和48 h采集樣品用于檢測NtMYB108b基因的激素處理響應;使用濃度為100 g/L的聚乙二醇(PEG-6000)澆灌根部模擬干旱脅迫,分別于處理后第0、2、4、8和16 d采 集 葉 片 組 織 用 于 檢 測NtMYB108b基因的干旱脅迫響應。每組試驗設置3次生物學重復。上述材料采集后用液氮速凍,保存于-80℃冰箱中備用。
1.2 實驗方法
1.2.1 NtMYB108b基因克隆
根據K326腺毛轉錄組測序數據,初步獲得NtMYB108b基因的全長CDS序列。分別采用EasyPure?Plant RNA Kit、TransScript?One-Step gDNA Removal and cDNA Synthesis SuperMix Kit(北京全式金生物技術有限公司),從煙草腺毛中提取總RNA并反轉錄成cDNA。使用2×TransStart?KD Plus PCR SuperMix Kit(北京全式金生物技術有限公司)從cDNA中擴增目的基因,引物序列見表1。PCR反應條件:94℃預變性5 min;94℃變性30 s,55℃退火30 s,68℃延伸50 s,共35個循環;68℃延伸10 min。反應產物于1%瓊脂糖凝膠電泳后將目的條帶回收,連接至中間克隆載體pEASY-Blunt Zero(北京全式金生物技術有限公司)并轉化大腸桿菌DH5α感受態細胞,挑選陽性克隆送生工生物工程(上海)股份有限公司測序。
1.2.2 生物信息學分析
使用ProtParam(http://web.expasy.org/protparam/)分析蛋白質分子量、等電點等理化性質;采用Protscale(https://web.expasy.org/protscale/)預測蛋白的親/疏水性;使用TMHMM(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)預測蛋白跨膜結構;分別 使 用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)預測蛋白的二、三級結構;SMART(http://smart.embl-heidelberg.de/)用于預測蛋白結構域;Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plantmulti/)用于預測蛋白的亞細胞定位;使用DNAMAN軟件比對分析氨基酸序列;使用MEGA 6.0軟件,在p-distance模型下,采用Neighbor-Joining(NJ)算法構建系統進化樹,bootstrap設置為1 000次重復。
1.2.3 實時熒光定量PCR實驗
使用ViiA7熒光定量PCR儀(美國ABI公司)檢測NtMYB108b基因在煙草中的相對表達情況。β-Actin為內參基因,qRT-PCR試劑盒為日本TAKARA公司生產的TB Green?Premix DimerEraserTM(Perfect Real Time),反應程序為:95℃預變性30 s;95℃變性5 s,60℃退火30 s,72℃延伸34 s,40個循環。用于qRT-PCR的引物信息見表1。反應結束后用公式2-ΔΔCT計算基因的相對表達量[22]。

表1 PCR擴增引物序列Tab.1 Primer sequences for PCR amplification
2 結果與分析
2.1 NtMYB108b基因的CDS序列擴增及分析

M.DL2 000 DNA Marker;1.NtMYB108b基因PCR擴增片段圖1 NtMYB108b全長CDS序列的PCR產物Fig.1 PCR production of NtMYB108b full-length CDS
以栽培煙草K326的腺毛cDNA為模板進行PCR擴增,獲得NtMYB108b(LOC107809713)長度為828 bp的CDS序列(圖1、圖2),編碼蛋白長度為275個氨基酸(圖2)。Protparam分析結果顯示,NtMYB108b蛋白的分子式為C1365H2113N417O443S11,相對分子質量31.81 kDa,理論等電點PI 5.82,不穩定系數為(Ⅱ)53.24,屬于不穩定蛋白,總平均親水性系數為-0.903。采用ProtScale在線工具進一步分析NtMYB108b蛋白的親/疏水性,發現其親水區域(負值)多于疏水區域(正值),表明NtMYB108b是一種親水性蛋白(圖3A)。TMHMM跨膜結構預測表明,NtMYB108b蛋白不存在跨膜區域(圖3B);Plant-mPLoc預測NtMYB108b蛋白定位于細胞核。利用SOMPA分析NtMYB108b蛋白的二級結構(圖4),發現其無規則卷曲含量最高,占50.91%,其次是α-螺旋(38.55%)、延伸鏈(6.54%)和β-轉角(4.00%)。三維結構預測結果如圖5所示,NtMYB108b蛋白具有螺旋-轉角-螺旋的結構特征,這與二級結構預測結果(其富含無規則卷曲及α-螺旋)一致。蛋白結構域分析發現,NtMYB108b的N端有兩個SANT保守結構域,分別由51個(第13~第63位)和49個(第66~第114位)氨基酸組成,其C端第146~第182位氨基酸處有一個低復合物區域(圖6),推測NtMYB108b屬于R2R3型MYB轉錄因子。

圖2 NtMYB108b全長CDS序列及其編碼氨基酸序列Fig.2 Sequences of full-length CDS and amino acids of NtMYB108b

圖3 NtMYB108b蛋白親/疏水性及跨膜結構分析Fig.3 Hydrophilic/Hydrophobicity and transmembrane structure analyses of NtMYB108b protein
2.2 多重序列比對及進化樹分析
根據2.1中蛋白結構域的預測結果,NtMYB108b屬于R2R3型MYB轉錄因子(圖6),從在線網站https://www.arabidopsis.org/上下載擬南芥(Arabidopsis thaliana)126個R2R3-MYB的氨基酸序列并與NtMYB108b共同構建系統進化樹,根據Stracke等[23]的報道進行分組,結果如圖7所示,NtMYB108b與擬南芥S20亞組成員AtMYB108、AtMYB78、AtMYB112等聚為一支。從進化樹分析結果可以預測,NtMYB108b與S20亞組成員的生物學功能相似。將NtMYB108b的氨基酸序列在NCBI中進行Blastp比對分析,結果顯示,NtMYB108b與其他茄科煙草屬的MYB108、馬鈴薯StMYB108以及番茄SlMYB78等的氨基酸序列相似度較高,其中,與絨毛狀煙草NtomMYB108的相似度最高,為100.00%。選擇與NtMYB108b相似度較高的物種及其氨基酸序列與擬南芥S20亞組成員一起進行多序列比對并構建系統樹化樹,多重序列比對結果如圖8所示,這些MYB108-like蛋白在N端含有高度保守的R2R3-SANT結構域,而C端的差異較大,這符合R2R3型MYB轉錄因子的典型特征。將圖8中的氨基酸構建進化樹,發現NtMYB108b與絨毛狀煙草NtomMYB108在同一分支(圖9)且它們的序列相似性為100.00%,說明NtMYB108b很可能來源于其祖先種絨毛狀煙草。
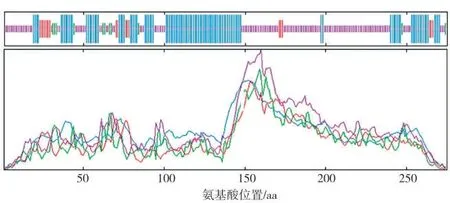
圖4 NtMYB108b蛋白二級結構預測Fig.4 Prediction on secondary structure of NtMYB108b protein
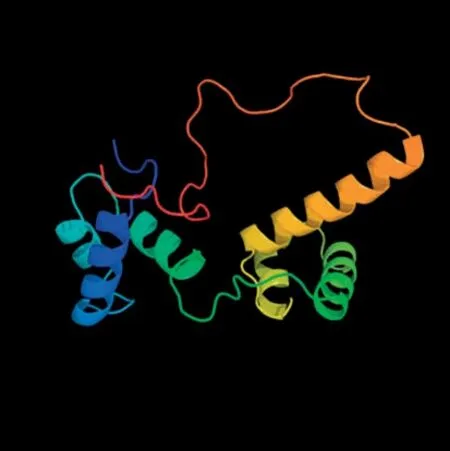
圖5 NtMYB108b蛋白三級結構預測Fig.5 Prediction on tertiary structure of NtMYB108b protein
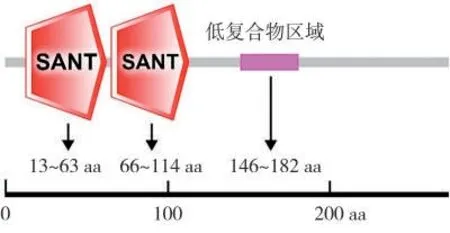
圖6 NtMYB108b蛋白結構域分析Fig.6 Domains of NtMYB108b protein

圖7 NtMYB108b與擬南芥R2R3-MYB蛋白的系統進化樹Fig.7 Phylogenetic tree for NtMYB108b and Arabidopsis R2R3-MYB proteins

圖8 不同物種MYB108-like氨基酸序列比對分析Fig.8 Multi-sequence alignment of MYB108-like amino acids of different species
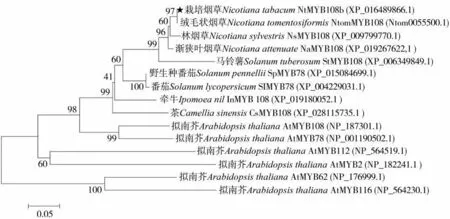
圖9 不同物種MYB108-like氨基酸序列進化樹分析Fig.9 Phylogenetic tree for MYB108-like amino acids of different species
2.3 NtMYB108b基因在不同組織中的表達分析
使用qRT-PCR方法調查NtMYB108b基因在煙草不同生育期及不同葉位葉片中的表達情況,發現NtMYB108b基因在團棵期葉片中的相對表達量較高,在旺長期時表達量較低(圖10A);現蕾期時,NtMYB108b基因在頂葉、上二棚葉、腰葉、下二棚葉和腳葉5個葉位葉片中的表達量沒有顯著差異(圖10B)。在煙草根、莖、花、葉和腺毛中均檢測到NtMYB108b基因的表達(圖10C),但不同組織的表達量不同,其中NtMYB108b基因在腺毛中的相對表達量最高,達94.39,而在葉片中的相對表達量為1,這與本實驗室前期獲得的轉錄組數據結果一致,即NtMYB108b基因在葉片的腺毛中優勢表達;NtMYB108b基因在根、莖和花中的相對表達量分別為17.42、5.79和66.49,在花中的表達量較高,僅次于腺毛。
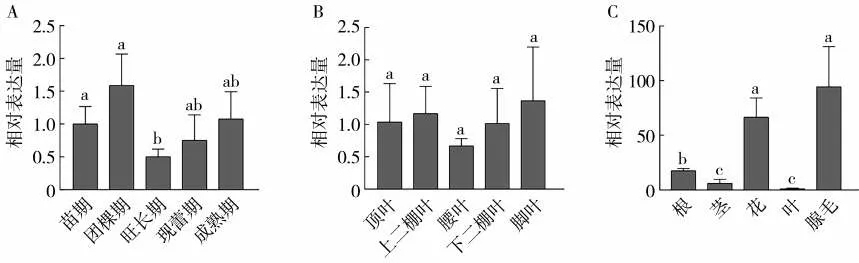
圖10 NtMYB108b基因的組織表達分析Fig.10 Relative expression level of NtMYB108b gene in different tissues
2.4 NtMYB108b對激素處理及干旱脅迫的響應
NtMYB108b基因在ET處理后第6、12、24和48 h均能被強烈誘導,在第12 h時相對表達量最高,為18.28(圖11A);SA處理后第6 h,NtMYB108b基因表達上調,在第12 h時達到峰值,相對表達量為14.16,在第24 h時顯著下調(圖11C)。當采用PEG-6000模擬干旱脅迫時,NtMYB108b基因的表達量在處理后第2 d時顯著升高,此時其相對表達量為15.12,在處理后第4和8 d時有所下降(圖11F)。而經MeJA、GA和ABA處理后,NtMYB108b基因的表達量較未處理時(0 h)相比并無顯著差異(圖11B、圖11D、圖11E)。上述結果說明,NtMYB108b基因能被ET、SA及干旱脅迫所誘導,而對MeJA、GA和ABA的處理則無響應。

圖11 NtMYB108b基因在不同激素處理及干旱脅迫后的表達分析Fig.11 Relative expression level of NtMYB108b gene under different hormone or drought stress treatments
3 討論
從煙草品種K326的腺毛cDNA中克隆了NtMYB108b基因的CDS序列,經生物信息分析,NtMYB108b基因編碼蛋白屬于R2R3-MYB型轉錄因子(圖6、圖8),來源于其祖先種絨毛狀煙草。相同R2R3-MYB亞組成員的基因功能具有一定相似性[15,17],如AtMYB11、NtMYB12、GhMYB1a等S7亞組成員調控類黃酮的生物合成[15,20,24],S9亞組成員MIXTA-like轉錄因子參與植物表皮細胞的生長發育[1,7],S1亞組成員是蠟質生物合成的調控因子[25-26]。本研究中發現NtMYB108b屬于S20亞組成員(圖7),從系統進化樹分析結果可初步推測NtMYB108b基因的功能與S20亞組成員相似,該組成員主要參與植物器官衰老、萜類物質合成、脅迫響應等過程[27-30]。Li等[28]對丹參(Salvia miltiorrhiza)的110個R2R3-MYB轉錄因子進行了全基因組分析,預測S20亞組成員是萜類物質生物合成的調控因子,因此,NtMYB108b可能是煙草中參與萜類物質合成的潛在調控基因。
本研究中發現NtMYB108b基因在煙草腺毛中優勢表達,在花中的表達量略低,說明NtMYB108b在煙草腺毛及花中可能有更重要的生物學功能。此外,根據Zhang等[30]的研究,月季(Rosa hybrida)RhMYB108基因在衰老的花瓣中高水平表達,同時通過ET和JA信號通路可靶向調節衰老相關基因并調節花瓣的衰老。本研究中發現NtMYB108b基因在ET誘導后表達上調(圖11A),且在花中的表達量也較高(圖10C),初步推測NtMYB108b基因通過ET信號途徑,參與了花瓣的衰老。在激素處理及干旱脅迫的實驗中觀察到了NtMYB108b基因在ET、SA及干旱脅迫處理后均顯著上調表達(圖11A、圖11C、圖11F),這些結果暗示NtMYB108b基因在生物及非生物脅迫的調控中起著重要作用,并且可能與ET和SA信號途徑有關。此外,NtMYB108b基因對腺毛發育調控激素MeJA[1,5,31]和GA[32]的處理無響應(圖11B、圖11D),推測該基因可能不參與調控煙草腺毛起始或伸長。
4 結論
從煙草K326的腺毛中克隆了NtMYB108b基因的全長CDS序列,其開放閱讀框為828 bp,編碼275個氨基酸。NtMYB108b蛋白定位于細胞核,屬于R2R3-MYB轉錄因子S20亞組成員,來源于其祖先種絨毛狀煙草。NtMYB108b基因在葉片中的相對表達量為1,在腺毛及花中的相對表達量分別為94.39和66.49,表明NtMYB108b在煙草腺毛及花中發揮著重要的生物學功能。激素及干旱脅迫實驗進一步說明NtMYB108b的功能可能涉及ET、SA信號轉導及干旱脅迫。

