慢性腎衰竭對大鼠腸黏膜屏障及自噬相關蛋白表達的影響
張紫媛,方敬愛,李蘇芬,胡雅玲,張曉東,劉文媛,劉學軍
(山西醫科大學第一醫院 1.腎內科; 2.婦科; 3.老年科, 山西 太原 030001;4.山西醫科大學, 山西 太原 030001)
慢性腎衰竭(chronic renal failure,CRF)是指各種慢性腎臟病引起的腎小球濾過率下降及與此相關的代謝紊亂和臨床癥狀組成的綜合征,已經成為嚴重威脅人類健康的公共問題。
有研究表明,CRF時腸道緊密連接蛋白表達下降,腸道菌群紊亂,細菌移位率升高,提示存在腸道屏障損傷[1],其機制可能與微炎性反應狀態和氧化應激有關[2]。自噬是在自噬相關基因和蛋白的調控下,利用溶酶體降解細胞內物質成分的過程,對維持細胞內環境穩態等方面起著重要作用。近年的研究發現,自噬可通過多種方式調控腸黏膜屏障損傷[3-4],但在CRF腸道屏障損傷中的作用機制目前尚未有研究。因此,本研究擬在此方面進行探討。
1 材料與方法
1.1 材料
1.1.1 動物:SPF雄性SD大鼠30只,體質量(200±20)g[山西醫科大學實驗動物中心,動物合格證號:SCXK(晉)2015-0001]。
1.1.2 試劑:兔抗Beclin-1抗體(Cell Signaling Technology 公司);兔抗LC3、claudin-1抗體(Abcam公司);兔抗ZO-1抗體(Proteintech Group公司);辣根過氧化物酶標記的羊抗兔IgG(Immunoway公司);肌酐、尿素氮試劑盒(南京建成生物工程研究所);TNF-α、內毒素試劑盒(武漢博士德生物有限公司)。
1.2 方法
1.2.1 大鼠的分組及模型的建立:大鼠實驗全程均給予普通飼料喂養,自由進水。適應性飼養1周后,隨機分為假手術組10只和模型組20只,行左腎切除術,經1周恢復后,灌胃給予腺嘌呤200 mg/(kg·d)4周。隨后觀察實驗動物行為活動、體質量等一般狀態。于造模后4和8周留取各組大鼠血清、腎臟及結腸組織標本。
1.2.2 ELISA檢測腎功能及炎性因子:用ELISA檢測各組血清肌酐、尿素氮、TNF-α、IL-6、LPS。
1.2.3 HE染色觀察腎臟及結腸組織病理改變:留取腎臟及結腸組織,浸泡于4%多聚甲醛中固定,雙蒸水清洗。梯度乙醇脫水,二甲苯溶液透明,石蠟包埋、切片。HE染色,光鏡下觀察腎臟及結腸組織病理改變。
1.2.4 Western blot檢測LC3、beclin-1、ZO-1、claudin-1蛋白表達:提取結腸組織總蛋白,測定蛋白濃度,上樣后電泳分離蛋白質。將凝膠中的蛋白質移至PVDF膜上,于5%脫脂牛奶封閉液中室溫封閉1 h。加入5%脫脂牛奶稀釋的一抗(1∶1 000)4 ℃孵育過夜,次日 TBS-T 洗膜3次,每次5 min。辣根過氧化物酶標記的二抗(1∶500)室溫孵育1 h,TBS-T洗膜3次,每次5 min,加入ECL化學發光試劑,成像。
1.3 統計學分析
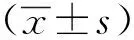
2 結果
2.1 各組大鼠一般情況
模型組左腎切除術后傷口無出血,術后5 d死亡1只,考慮與感染有關,其余大鼠均無異常。給予腺嘌呤灌胃4周后,模型組大鼠逐漸出現對外界刺激反應遲鈍,行動緩慢,毛色枯黃,無光澤,眼結膜蒼白,體質量增加緩慢。假手術組大鼠行動、反應、毛色無異常。觀察至4周、8周時模型組各死亡1只。
2.2 大鼠腎功能及炎性因子變化
模型組大鼠血肌酐、尿素氮、TNF-α、IL-6、LPS水平較假手術組升高(P<0.05),并且這些指標在8周時較4周時升高(P<0.05)(表1)。
2.3 大鼠腎臟、結腸組織病理變化
模型組腎臟逐漸出現腎小管擴張,間質炎性細胞浸潤,間質纖維化,8周時模型組腎臟組織可見腎小球硬化,間質纖維化加重(圖1)。模型組腸絨毛萎縮、倒塌,黏膜層炎性細胞浸潤,并且在8周時組織損傷加重(圖2)。
2.4 大鼠結腸上皮細胞緊密連接蛋白、自噬相關蛋白表達變化
CRF模型組大鼠結腸黏膜上皮細胞緊密連接蛋白ZO-1、claudin-1和自噬蛋白beclin-1、LC3Ⅱ/Ⅰ的表達較假手術組下降,并且隨著時間推移,在8周時表達較4周下降更多(P<0.05)(圖3~4)。

表1 各組血肌酐、尿素氮、TNF-α、IL-6和LPS水平Table 1 The level of creatinine, urea nitrogen, TNF-α, IL-6 and

圖1 各組大鼠腎臟組織病理HE染色Fig 1 HE staining of rat kidney(×100)

圖2 各組大鼠結腸組織病理HE染色Fig 2 HE staining of rat colon(×200)

*P<0.05 compared with control group; #P<0.05 compared with CRF 4 weeks group圖3 各組結腸組織腸上皮細胞緊密連接蛋白表達Fig 3 Expression of tight junction protein in colon

*P<0.05 compared with control group; #P<0.05 compared with CRF 4 weeks group圖4 各組結腸組織腸上皮細胞自噬相關蛋白表達Fig 4 Expression of autophagy related protein in colon
3 討論
CRF可導致全身多個系統器官的損傷,其中消化系統最常見,表現為惡心、嘔吐、腹瀉或便秘等癥狀。結腸是產生尿毒癥毒素的重要器官,近年的研究顯示,CRF時尿毒癥毒素的蓄積可引起腸黏膜屏障的損傷,而腸黏膜屏障損傷會導致全身炎性反應狀態,進而加重腎臟損傷,甚至引起全身并發癥[5],形成惡性循環。
腸黏膜屏障主要包括機械屏障、免疫屏障、生物屏障及化學屏障等。研究表明[6],CRF患者體內LPS和D-乳酸水平升高,提示腸道細菌代謝產物經受損的腸道屏障進入血液循環。隨后的研究則發現[7],CRF大鼠腸道組織表現出黏膜損傷,通透性增加,上皮細胞間緊密連接蛋白表達下降。同時尿毒癥引起腸道菌群的結構發生改變,主要表現為益生菌的減少和致病菌的大量繁殖等[8],進而導致全身微炎性反應狀態。
本研究采用左腎切除聯合腺嘌呤灌胃的方法成功制作CRF的大鼠模型,模型組血肌酐、尿素氮、炎性因子及LPS水平較對照組升高,并且隨著觀察時間延長,腎小球硬化和間質纖維化的病理損害加重。跨膜緊密連接蛋白claudin家族和ZO蛋白是組成細胞間緊密連接的重要成分,本研究發現,模型組結腸組織出現腸絨毛萎縮、倒塌、炎細胞浸潤,claudin-1和ZO-1的表達下降,提示CRF時存在腸黏膜屏障損傷,與報道[9-10]的研究結果相似。
自噬在維持腸黏膜屏障正常功能中具有重要作用。近年來的研究發現,腸上皮細胞自噬是腸道防御細菌入侵和調節黏膜炎性反應的重要機制[11]。雷帕霉素誘導自噬可改善IL-10敲除小鼠結腸連接蛋白的表達下降,降低促炎細胞因子(TNF-α、IFN-γ和IL-17)、趨化因子(CXCL-1和CXCL-2)表達及結腸的通透性,改善腸道屏障功能[12]。抗生素引起的腸上皮緊密連接屏障功能障礙與小鼠腸道微生物群失調、NLRP3炎性小體激活和自噬有關[13]。Beclin-1在自噬小體形成的早期,與Ⅲ型磷酸肌醇3 激酶(PI3KC3) 形成復合體,調節其他自噬相關基因表達蛋白在自噬前體中的結構定位,從而促進自噬體的形成[14]。LC3 是自噬的標志物,當自噬被激活,胞質中的 LC3-Ⅰ通過與脂質分子磷脂酰乙醇胺結合轉化為 LC3-Ⅱ,介導自噬溶酶體的形成[15]。本研究發現,CRF大鼠結腸組織中存在大量炎性細胞的浸潤,體內炎性因子水平升高,LC3Ⅱ/Ⅰ、beclin-1表達下降,提示CRF時機體存在炎性反應狀態,結腸上皮細胞存在自噬異常。
綜上,腸黏膜屏障損傷參與CRF的進展過程,自噬障礙可能是CRF腸黏膜屏障損傷的重要機制和值得探索的治療靶點。

