淫羊藿苷減輕七氟醚誘導的小鼠認知功能障礙
雷 劍,張昌盛,吳 寶
(1.中國中醫科學院廣安門醫院南區 麻醉科,北京 102618;2.中國人民解放軍總醫院 麻醉科,北京 100853)
術后認知功能障礙(postoperative cognitive dysfunction,POCD)為圍手術期常見的并發癥,表現為學習記憶能力下降、認知社交能力受損[1]。目前研究發現,臨床上常用吸入性麻醉劑七氟醚(sevoflurane)是誘發老年POCD發生率升高的關鍵誘因之一[2]。已有研究證實,七氟醚會造成患者腦組織結構損傷及神經元炎性損傷及凋亡[3]。小膠質細胞是腦內的巨噬細胞,可由M1型促炎活性向M2型抗炎活性發展,并介導神經元免疫炎性反應[4]。近來研究發現,磷脂酰肌醇(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,Akt)通路活化除介導細胞增殖、分化及凋亡作用外,還參與機體免疫應答和炎性因子釋放過程[5],預示PI3K/Akt通路可能是參與POCD患者海馬神經元免疫炎性反應及凋亡的關鍵通路。淫羊藿苷(icariin)為淫羊藿中提取的黃酮類活性成分,具有免疫調節、抗感染、抗凋亡等多種藥理作用,且具有較好的神經保護作用,并能夠改善阿爾茨海默病動物的學習記憶能力[6]。但淫羊藿苷是否能減輕七氟醚誘導的小鼠認知障礙,還未見報道。本研究用七氟醚誘導建立POCD模型小鼠,并以PI3K/Akt通路為切入點進行探究驗證,以期為淫羊藿苷的研究應用提供理論依據。
1 材料與方法
1.1 實驗材料
C57BL/6小鼠,體質量20~22 g,清潔級,雄性[北京百奧賽圖基因生物技術有限公司,SCXK(京)2020-0007]。試驗符合3R(實驗動物減少、優化和替代)原則,并經廣安門醫院倫理委員會批準IACUC-01(202001111)。
淫羊藿苷(滁州仕諾達生物科技有限公司);PI3K抑制劑(LY294002)(上海一研生物科技有限公司,規格:10 mg);PI3K激活劑(rh IGF-1)(北京百奧萊博科技有限公司);腫瘤壞死因子-α(TNF-α)ELISA試劑盒、白細胞介素-1β(IL-1β)ELISA試劑盒、神經營養因子(brain-derived neurotrophic factor,BDNF)ELISA試劑盒(上海瓦蘭生物科技有限公司);尼氏及TUNEL染色液(北京伊塔生物科技有限公司及無錫菩禾生物醫藥技術有限公司);M1型激活小膠質細胞標記抗體(CD11b)、M2型激活小膠質細胞標記抗體(CD206)、小膠質細胞標記抗體(ionized calcium bindingadaptor molecule-1,Iba-1)、TNF-α、IL-1β、IL-10、PI3K、磷酸化PI3K(p-PI3K)、Akt、磷酸化Akt(p-Akt)、糖原合成酶激酶3β(GSK-3β)、磷酸化GSK-3β(p-GSK-3β)、抗凋亡蛋白-Bcl-2等兔抗小鼠抗體(Abcam公司)。
1.2 方法
1.2.1 小鼠的分組及處理:將小鼠分為:對照組、模型組、淫羊藿苷組、PI3K抑制劑組、淫羊藿苷+抑制劑組、PI3K激活劑組,每組12只。除對照組外,其余各組小鼠參照文獻[7]將小鼠放置于3%七氟醚+100%氧氣預充透明半封閉麻醉箱中持續麻醉30 min后,取出經腹正中線約1.5 cm切口行腹腔探查術,手術約持續10 min后,用無菌絲線縫合肌肉筋膜及皮膚,建立POCD模型。對照組小鼠持續給予100%氧氣30 min外,不進行任何處理,作為對照組。
各組均于術前3 d開始給藥,淫羊藿苷組參照文獻[8]設置劑量20 mg/kg,用0.9%氯化鈉溶液溶解成濃度為2 mg/mL的混懸液,按10 mL/kg的劑量灌胃給藥,1次/d;PI3K抑制劑組于麻醉前30 min參照文獻[9]經腹腔注射PI3K/Akt抑制劑-LY294002(30 mg/kg);PI3K激活劑組于麻醉前30 min參照文獻[10]經腹腔注射PI3K激活劑-rh IGF-1,50 μg/kg;淫羊藿苷+抑制劑組腹腔注射PI3K/Akt抑制劑-LY294002的同時,灌胃給予淫羊藿苷進行干預處理。各組小鼠均于術后24 h進行后續實驗。
1.2.2 小鼠認知功能障礙檢測:條件恐懼實驗:各組小鼠于造模后24 h,參照文獻[11]將動物置于相同訓練期的恐懼箱中進行訓練,實驗重復6次。以此評價其對恐懼事件認知能力。
Y迷宮空間探索實驗:參照文獻[11]設置Y迷宮空間探索實驗,以此評價小鼠的空間識別記憶能力。
1.2.3 ELISA檢測小鼠血清TNF-α、IL-1β及BDNF水平:各組小鼠測完認知功能后,取血約3 mL,ELISA檢測血清TNF-α、IL-1β及BDNF水平。
1.2.4 尼氏及TUNEL染色觀察海馬神經元損傷及凋亡:解剖剝離,取完整海馬組織,分成兩部分,一部分置于-80 ℃冰箱保存備用;另一部分制備新鮮冰凍切片(20 μm)。取新鮮冰凍切片按尼氏及TUNEL染液說明書方法染色處理后,于光鏡下觀察拍照。TUNEL染色切片,隨機取5個視野,用Image-Pro Plus 6.0軟件記錄分析每視野下凋亡細胞比例(%)=陽性染色為棕色細胞/每視野下總細胞×100%。
1.2.5 免疫熒光染色法檢測小膠質細胞極化分型:CD11b標記M1型激活小膠質細胞,CD206標記M2型激活小膠質細胞,Iba-1標記小膠質細胞。取相同部位新鮮冰凍切片,晾干、0.3%曲拉通破膜、羊血清封閉處理后,加入1∶200的CD206、Iba-1一抗4 ℃孵育過夜,用1∶1 000的二抗(FITC,TRITC)室溫避光孵育1 h,磷酸化緩沖液洗脫、DAPI核染及封片處理后,于熒光顯微鏡下觀察。用Image-Pro Plus 6.0圖像分析系統計算每視野下CD11b、CD206、Iba-1陽性染色區域面積。以CD11b/Iba-1×100%及CD206/Iba-1×100%表示M1型與M2型極化分型。
1.2.6 Western blot檢測海馬組織蛋白表達:取冰凍海馬組織,4℃解凍,粉碎及勻漿處理后,提取胞質蛋白,BCA法測蛋白濃度,取100 μg蛋白樣品行電泳、轉膜反應,4 ℃孵育盒中滴加1∶800的PI3K、p-PI3K、Akt、Akt、GSK-3β、p-GSK-3β、NF-κB、p-NF-κB、TNF-α、IL-1β、IL-10、S100A8、TLR4、Bcl-2一抗及1∶1 000的β-actin內參抗體孵育過夜,次日滴加HRP山羊抗兔二抗(1∶1 400)繼續孵育30 min,增強化學發光法顯影曝光后,用Image-J軟件分析計算條帶相對吸光度(A)值。
1.3 統計學分析
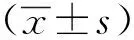
2 結果
2.1 淫羊藿苷對小鼠認知功能的影響
與對照組相比,模型組小鼠5 min內的僵直時間、N臂停留時間縮短(P<0.05)。與模型組相比,淫羊藿苷組及PI3K激活劑組小鼠5 min內的僵直時間、N臂停留時間延長(P<0.05);PI3K抑制劑組5 min內的僵直時間、N臂停留時間進一步縮短(P<0.05)。與淫羊藿苷組相比,淫羊藿苷+抑制劑組小鼠5 min內的僵直時間、N臂停留時間縮短(P<0.05)(表1)。

表1 小鼠5 min內的僵直時間、N臂停留時間比較
2.2 淫羊藿苷對小鼠血清TNF-α、IL-1β、BDNF水平的影響
與對照組相比,模型組小鼠血清TNF-α、IL-1β水平升高(P<0.05),BDNF水平降低(P<0.05)。與與模型組相比,淫羊藿苷組及PI3K激活劑組小鼠血清TNF-α、IL-1β水平降低(P<0.05),BDNF水平升高(P<0.05);PI3K抑制劑組血清TNF-α、IL-1β水平進一步升高(P<0.05),BDNF水平進一步降低(P<0.05)。與淫羊藿苷組相比,淫羊藿苷+抑制劑組小鼠血清TNF-α、IL-1β水平升高(P<0.05),BDNF水平降低(P<0.05,P<0.05)(表2)。

表2 小鼠血清TNF-α、IL-1β、BDNF水平比較
2.3 淫羊藿苷對小鼠海馬神經元損傷、凋亡的影響
對照組小鼠海馬神經元形態正常、排列緊密、核仁清晰;模型組小鼠海馬神經元體積變小、核固縮甚至消失、排列疏松、尼氏體模糊。TUNEL染色可見模型組凋亡細胞染色呈棕色。與對照組相比,模型組小鼠海馬神經元核固縮、排列疏松等損傷嚴重,凋亡率升高(P<0.05)。與模型組相比,淫羊藿苷組及PI3K激活劑組小鼠神經元形態逐漸趨于正常,凋亡率降低(P<0.05);PI3K抑制劑組小鼠神經元丟失及核固縮現象進一步加重, 凋亡率進一步升高(P<0.05)。與淫羊藿苷組比較,淫羊藿苷+抑制劑組小鼠神經元損傷嚴重,凋亡率升高(P<0.05)(圖1,表3)。

表3 小鼠海馬神經元凋亡率比較
2.4 淫羊藿苷對小鼠小膠質細胞分型的影響
CD11b、CD206標記的M1型及M2型激活小膠質細胞為紅色熒光;Iba-1標記的小膠質細胞為綠色熒光。與對照組相比,模型組小鼠海馬組織M1型(CD11b/Iba-1)、M2型(CD206/Iba-1)陽性表達面積升高(P<0.05)。與模型組相比,淫羊藿苷組及PI3K激活劑組小鼠M1型(CD11b/Iba-1)陽性表達面積降低(P<0.05),M2型(CD206/Iba-1)陽性表達面積升高(P<0.05);PI3K抑制劑組小鼠M1型(CD11b/Iba-1)陽性表達面積進一步升高(P<0.05),M2型(CD206/Iba-1)陽性表達面積進一步降低(P<0.05)。與淫羊藿苷組比較,淫羊藿苷+抑制劑組小鼠M1型(CD11b/Iba-1)陽性表達面積升高(P<0.05),M2型(CD206/Iba-1)陽性表達面積降低(P<0.05)(圖2,表4)。

圖1 小鼠海馬組織尼氏及TUNEL染色Fig 1 Nissl and TUNEL staining of mouse hippocampus
2.5 淫羊藿苷對小鼠海馬組織M1、M2型極化相關因子表達的影響
與對照組相比,模型組小鼠海馬組織M1極化相關因子TNF-α、IL-1β蛋白表達升高(P<0.05)、M2型極化相關因子IL-10蛋白表達降低(P<0.05)。與模型組相比,淫羊藿苷組及PI3K激活劑組小鼠海馬組織TNF-α、IL-1β蛋白表達降低(P<0.05)、IL-10蛋白表達升高(P<0.05);PI3K抑制劑組小鼠TNF-α、IL-1β蛋白表達進一步升高(P<0.05),IL-10蛋白表達進一步降低(P<0.05)。與淫羊藿苷組比較,淫羊藿苷+抑制劑組小鼠TNF-α、IL-1β蛋白表達升高(P<0.05),IL-10蛋白表達降低(P<0.05)(圖3,表5)。

red fluorescence for CD11b or CD206; green fluorescence for Iba-1圖2 小鼠海馬組織CD11b、CD206和Iba-1免疫熒光染色Fig 2 Immunorescence staining of CD11b, CD206 and Iba-1 in mouse hippocampus

表4 小鼠海馬神經元CD11b/Iba-1和CD206/Iba-1陽性染色面積比較
2.6 淫羊藿苷對小鼠海馬組織PI3K/Akt下游抗感染及抗凋亡蛋白表達的影響
與對照組相比,模型組小鼠海馬組織p-PI3K/PI3K、p-Akt/Akt、p-GSK-3β/GSK-3β、Bcl-2蛋白表達降低(P<0.05)。與模型組相比,淫羊藿苷組及PI3K激活劑組小鼠p-PI3K/PI3K、p-Akt/Akt、p-GSK-3β/GSK-3β、Bcl-2蛋白表達升高(P<0.05);PI3K抑制劑組小鼠p-PI3K/PI3K、 p-Akt/Akt、p-GSK-3β/GSK-3β、 Bcl-2蛋白表達進一步降低(P<0.05)。

A.control; B.model; C.icariin; D.PI3K activator; E.PI3K inhibitor; F.icariin + inhibitor圖3 小鼠海馬組織中TNF-α、IL-1β和IL-10蛋白表達FIg 3 Expression of TNF-α, IL-1β and IL-10 proteins in mouse hippocampus

表5 小鼠海馬組織TNF-α、IL-1β、IL-10蛋白表達比較
與淫羊藿苷組比較,淫羊藿苷+抑制劑組小鼠p-PI3K/PI3K、p-Akt/Akt、p-GSK-3β/GSK-3β、Bcl-2蛋白表達降低(P<0.05)(圖4,表6)。

A.control; B.model; C.icariin; D.PI3K activator; E.PI3K inhibitor; F.icariin + inhibitor圖4 小鼠海馬組織p-PI3K/PI3K、p-Akt/Akt、p-GSK-3β/GSK-3β和Bcl-2蛋白表達Fig 4 Protein expression of p-PI3K/PI3K,p-Akt/ Akt, p-GSK-3β/GSK-3β and Bcl-2 in mouse hippocampus
3 討論
本研究用七氟醚麻醉+剖腹探查術建立POCD動物模型后發現,在恐懼實驗及Y型迷宮試驗中,小鼠5 min內僵直時間及N臂停留時間縮短,預示出現認知能力及空間記憶能力降低現象,光鏡下可見海馬神經元核固縮、空泡化、丟失等損傷凋亡現象嚴重, 提示POCD模型造模成功。淫羊藿苷具有抗感染及神經保護作用,可通過上調BDNF改善精神分裂癥大鼠認知功能障礙[12]。本研究發現,POCD小鼠經淫羊藿苷干預治療后,血清炎性因子TNF-α、IL-1β降低而BDNF升高,海馬神經元損傷及凋亡緩解,認知能力及空間記憶能力均得到改善,提示淫羊藿苷可明顯改善POCD小鼠海馬神經元損傷、凋亡及認知功能損傷。
POCD海馬神經元損傷凋亡機制復雜,有研究發現,在麻醉及手術過程中,前炎性因子-鈣結合蛋白salgranulin A(S100A8)表達的持續增加,使免疫受體Toll受體(TLR4)激活并刺激中樞神經系統的巨噬細胞-小膠質細胞活化,誘發神經炎性損傷及POCD的發生[13]。本研究在POCD小鼠海馬組織中檢測到TNF-α、IL-1β表達升高及IL-10表達降低,小膠質細胞M1型活化高于M2型活化,提示小膠質細胞M1型極化介導的促炎反應激活,可能是POCD神經元損傷及認知功能受損的關鍵機制之一。
PI3K/Akt在細胞存活及固有免疫細胞極化反應中起重要作用。PI3K活化后可通過多種途徑調節下游靶蛋白表達來發揮抗凋亡作用。七氟醚處理小鼠后,海馬組織PI3K/Akt通路磷酸化水平降低,海馬神經元損傷、凋亡及認知功能損傷加重,并認為七氟醚對PI3K/Akt促細胞生存通路的抑制可能是誘發POCD發生的原因之一[14]。PI3K/Akt通路激活可促進巨噬細胞向M2型抗感染方向極化,緩解缺血再灌注肺損傷的發展[15]。本研究結果提示促進PI3K/Akt-GSK-3β通路磷酸化活化可能是提高小膠質細胞M2型極化介導的抗感染反應激活,改善POCD小鼠海馬神經元損傷凋亡及認知功能損傷的關鍵機制。

表6 小鼠海馬組織p-PI3K/PI3K、p-Akt/Akt、p-GSK-3β/GSK-3β、Bcl-2蛋白表達比較
淫羊藿苷組小鼠PI3K/Akt-GSK-3β通路處于磷酸化活性狀態,M2型極化介導的抗感染反應明顯高于M1型極化介導的促感染反應,小鼠海馬神經元損傷凋亡及認知功能損傷作用得到明顯改善,提示淫羊藿苷改善POCD小鼠海馬神經元損傷凋亡及認知功能損傷作用。淫羊藿苷與PI3K抑制劑聯用后,PI3K/Akt-GSK-3β通路活性降低,POCD小鼠海馬神經元損傷凋亡及認知功能損傷較淫羊藿苷加重,提示PI3K抑制劑可削弱淫羊藿苷的促進PI3K/Akt-GSK-3β通路活化,改善POCD小鼠海馬神經元損傷凋亡及認知功能損傷作用。
綜上所述,淫羊藿苷改善POCD小鼠海馬神經元損傷凋亡及認知功能損傷作用,可能與促進PI3K/Akt-GSK-3β磷酸化活化、提高M2型極化介導的抗感染反應激活有關。這為闡明淫羊藿苷抗認知功能損傷的分子生物學機制提供一定參考,并為淫羊藿苷在POCD領域的研究應用提供一定依據。

