EPAS1 siRNA抑制人腎透明細胞癌細胞系HiMet-ccRCC的增殖、遷移及侵襲
陳海濱,趙建軍,譚 超
(河北工程大學附屬醫(yī)院 泌尿外二科, 河北 邯鄲 056004)
腎細胞癌是常見泌尿系統(tǒng)惡性腫瘤之一,具有高發(fā)病率、高致死率特點,其中70%左右患者為腎透明細胞癌(renal clear cell carcinoma)。腎透明細胞癌惡性程度較高,多數(shù)患者對放射治療和化學藥物治療(簡稱放化療)、激素治療等不敏感,預后效果不佳[1-2]。故而,探究腎透明細胞癌發(fā)病機制并發(fā)現(xiàn)其生物治療靶標,對于改善患者預后意義重大。內(nèi)皮PAS區(qū)域蛋白1(endothelial PAS domain-containing protein 1,EPAS1)作為轉(zhuǎn)錄因子,在細胞應對缺氧時發(fā)揮關鍵作用,與腫瘤發(fā)生發(fā)展有關[3-4]。目前有關EPAS1 siRNA對腎透明細胞癌細胞增殖、遷移及侵襲能力的影響鮮有報道,因此本研究以人腎透明細胞癌HiMet-ccRCC為研究對象,采用RNA干擾技術觀察EPAS1對腎透明細胞癌HiMet-ccRCC細胞生物學行為的影響。
1 材料及方法
1.1 材料與試劑
人腎透明細胞癌細胞系HiMet-ccRCC(北京北納創(chuàng)聯(lián)生物技術研究院);MEM-EBSS培養(yǎng)基(Hyclone公司);LipofectamineTM3000試劑盒(上海吉雅生物科技有限公司);EPAS1 siRNA、non-target siRNA及引物序列(上海生工公司),其中EPAS1 siRNA序列為:正義鏈:5′-AATTCCACTTGATGCC ATAGGCCTGTCTC-3′和反義鏈:5′-AACCTATGGC ATCAAGTGGAACCTGTCTC-3′,non-target siRNA序列為:正義鏈:5′-AAATACAGGGTGGTGTTCCAGC CTGTCTC-3′和反義鏈:5′-AACTGGAACACCACCCT GTATCCTGTCTC-3′,序列帶有FITC標記,以便鑒定轉(zhuǎn)染效率;Matrigel基質(zhì)膠(北京澤平科技有限公司);3-2(4,5-二甲基噻唑-2)-2-四甲基偶氮噻唑藍(MTT)(Sigma-Aldrich公司);兔源E-cadherin、N-cadherin、MMP-9、PCNA、GAPDH一抗及對應二抗(北京索萊寶科技有限公司)。
1.2 方法
1.2.1 細胞的分組及處理:取HiMet-ccRCC細胞并將其復蘇,培養(yǎng)于含10%滅活FBS+MEM-EBSS培養(yǎng)基中,于37 ℃、5% CO2培養(yǎng)箱中培養(yǎng),待細胞增長良好且達對數(shù)增長期時進行后續(xù)實驗。
將HiMet-ccRCC細胞重懸后接種于24孔板(2.5×105個/孔);對細胞進行轉(zhuǎn)染,細胞分組:1)對照(control,Con)組;2)陰性對照(negative control,NC)組:加入5 μL Lipofectamine3000和50 pmol/μL國際通用的與所有基因均無同源性序列的non-target siRNA[5];3)沉默EPAS1表達組(EPAS1 siRNA組):加入5 μL Lipofectamine3000和50 pmol/μL EPAS1 siRNA,每組6個復孔。轉(zhuǎn)染24 h后進行后續(xù)實驗。
1.2.2 RT-qPCR檢測各組細胞EPAS1 mRNA表達[6]:各組HiMet-ccRCC細胞使用Trizol試劑進行總RNA提取,測定RNA質(zhì)量及濃度后將其反轉(zhuǎn)錄合成cDNA,然后將2.0 μL cDNA、各2.0 μL上下游引物(表1)、10 μL ULtraSYBR mixture與4.0 μL ddH2O混勻制備反應體系,隨后置于熒光定量PCR儀上擴增[設定程序為93 ℃ 30 s,(93 ℃ 5 s、65 ℃ 30 s)×40個循環(huán)]。以GAPDH為內(nèi)參,以2-△△Ct法計算EPAS1 mRNA含量。

表1 引物序列Table 1 Primer sequence
1.2.3 MTT法檢測HiMet-ccRCC細胞增殖能力:將轉(zhuǎn)染24 h后的各組HiMet-ccRCC細胞接種于96孔板(5×103個/孔,100 μL),分別于培養(yǎng)0、24、48 h后向各孔中加入20 μL MTT溶液(5 ng/mL),繼續(xù)培養(yǎng)4 h后棄去上清,添加150 μL DMSO溶解結(jié)晶。用FC酶標儀測定各孔細胞在490 nm處的吸光度值(A490 nm),并計算細胞增殖抑制率(%)=(1-實驗組A490 nm/對照組A490 nm)×100%。
1.2.4 Transwell小室法測定細胞侵襲、遷移能力:1)細胞侵襲:以不含胎牛血清的MEM-EBSS培養(yǎng)基重懸細胞,按3×103個/孔(200 μL)加入到Transwell小室上層(Transwell小室上層經(jīng)50 μL 2.0 mg/mL液態(tài)Matrigel基質(zhì)膠預包被),500 μL含10%胎牛血清的MEM-EBSS培養(yǎng)基加入下層,24 h后取出小室,輕輕擦去Matrigel基質(zhì)膠及上層殘留細胞,沖洗后甲醛固定、結(jié)晶紫染色。封片后顯微鏡下觀察染色細胞并拍照,隨機選6個視野,統(tǒng)計各組細胞侵襲數(shù)(Image J軟件),取均值。2)細胞遷移:不需要鋪膠,其余操作步驟同細胞侵襲實驗。
1.2.5 免疫印跡法檢測增殖、侵襲、遷移相關蛋白表達:收集并裂解轉(zhuǎn)染24 h后的各組HiMet-ccRCC細胞以提取總蛋白,并參照BCA蛋白定量試劑盒說明書檢測蛋白濃度,各樣品取30 μg變性的蛋白進行12% SDS-PAGE電泳并轉(zhuǎn)至PVDF膜,封閉(5%脫脂奶粉)2 h后加入一抗(E-cadherin、N-cadherin、MMP-9、PCNA、GAPDH,1∶500稀釋),4 ℃孵育過夜,加入二抗(HRP標記山羊抗兔,1∶1 000稀釋),室溫孵育2 h。顯色、曝光,采用Image J軟件定量蛋白。
1.3 統(tǒng)計學分析
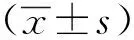
2 結(jié)果
2.1 穩(wěn)定轉(zhuǎn)染細胞系鑒定
EPAS1 siRNA組細胞轉(zhuǎn)染效果,在鏡下均可見綠色熒光,HiMet-ccRCC細胞成功轉(zhuǎn)染non-target siRNA、EPAS1(圖1)。

left.cell morphology in bright field; right.cell fluorescence (green fluorescence)圖1 熒光顯微鏡檢測NC組、EPAS1 siRNA組轉(zhuǎn)染情況Fig 1 Detection of siRNA transfection in NC group and EPAS1 group by fluorescence microscope(×200)
2.2 RT-qPCR檢測HiMet-ccRCC細胞EPAS1 mRNA表達
EPAS1 siRNA組細胞EPAS1 mRNA表達水平明顯低于對照組、陰性對照組(P<0.05)(表2)。

表2 HiMet-ccRCC細胞EPAS1 mRNA表達水平
2.3 MTT法檢測HiMet-ccRCC細胞增殖
與對照組、陰性對照組比較,24或48 h后EPAS1 siRNA組HiMet-ccRCC細胞增殖抑制率均顯著升高(P<0.05),由于48 h細胞增殖抑制率升高更為明顯,因此后續(xù)實驗選擇48 h進行后續(xù)實驗(表3)。

表3 HiMet-ccRCC細胞增殖情況比較
2.4 各組HiMet-ccRCC細胞侵襲及遷移情況比較
與對照組、陰性對照組比較,EPAS1 siRNA組HiMet-ccRCC細胞遷移數(shù)、侵襲數(shù)均顯著減少(P<0.05)(圖2~3,表4)。
2.5 蛋白質(zhì)印跡法檢測增殖、遷移、侵襲相關蛋白表達
與對照組、陰性對照組比較,EPAS1 siRNA組HiMet-ccRCC細胞中E-cadherin蛋白表達上調(diào)(P<0.05),N-cadherin、MMP-9、PCNA蛋白表達下調(diào)(P<0.05)(圖4,表5)。

圖2 HiMet-ccRCC細胞遷移情況比較Fig 2 Comparison of migration of HiMet-ccRCC cells (×200)

圖3 各組HiMet-ccRCC細胞侵襲情況比較Fig 3 Comparison of invasion of HiMet-ccRCC cells in each group (×200)

表4 各組HiMet-ccRCC細胞遷移及侵襲情況比較

圖4 Western blot檢測各組HiMet-ccRCC細胞增殖、遷移、侵襲相關蛋白Fig 4 Western blot diagram of proliferation, migration and invasion related proteins of HiMet-ccRCC cells in each group
3 討論
EPAS1是細胞應對低氧環(huán)境的關鍵轉(zhuǎn)錄因子,與血管生成及腫瘤發(fā)生關系密切[7]。研究顯示,EPAS1rs11894252位點基因多態(tài)性與腎透明細胞癌發(fā)生有關,且可作為腎透明細胞癌預后標志物[8]。既往研究顯示,在原發(fā)性和轉(zhuǎn)移性腎透明細胞癌小鼠模型中注射新型EPAS1抑制劑PT2399可導致腫瘤消退[9]。抑制胰腺癌細胞中EPAS1基因表達,能夠誘導胰腺癌細胞凋亡及抑制細胞增殖[10]。與正常對照組比較,腎透明細胞癌患者血清EPAS1水平升高,且與淋巴結(jié)轉(zhuǎn)移有關,提示EPAS1異常高表達可能參與腎透明細胞癌發(fā)生發(fā)展過程[11]。非小細胞肺癌細胞PC14HM中敲低EPAS1可抑制體外細胞增殖和體內(nèi)腫瘤生長,并抑制體內(nèi)PC14HM細胞腹膜轉(zhuǎn)移[12]。推測抑制EPAS1表達可明顯抑制腎癌細胞活力,并促進細胞凋亡、降低腎癌細胞遷移、侵襲能力。本研究中隨著培養(yǎng)時間的延長,EPAS1 siRNA組HiMet-ccRCC細胞增殖抑制率明顯升高,且在不同時間點EPAS1 siRNA組HiMet-ccRCC細胞增殖抑制率高于對照組、陰性對照組;進一步實驗發(fā)現(xiàn),EPAS1 siRNA組HiMet-ccRCC細胞遷移、侵襲數(shù)高于對照組、陰性對照組,提示抑制EPAS1基因表達使腎透明細胞癌HiMet-ccRCC細胞增殖、遷移及侵襲等惡性行為得到一定控制。
PCNA可通過調(diào)節(jié)DNA復制、DNA修復等途徑參與癌變過程,是一個促細胞增殖因子[13]。MMP-9作為基質(zhì)金屬蛋白酶家族分子質(zhì)量最大的成員,通過降解、破壞細胞外基質(zhì)成分在腫瘤轉(zhuǎn)移過程中發(fā)揮重要作用[14]。以細胞黏附分子(如E-cadherin)表達減少、具有間質(zhì)源性的N-cadherin等表達升高為主要特征的EMT是上皮細胞來源惡性腫瘤細胞獲得轉(zhuǎn)移能力的重要生物學過程,調(diào)控著癌細胞遷移、侵襲行為[15]。過表達冷誘導RNA結(jié)合蛋白可抑制腎癌細胞增殖及遷移,且腎癌細胞中N-cadherin表達明顯降低,E-cadherin表達增高[16]。本結(jié)果顯示,轉(zhuǎn)染EPAS1 siRNA后,HiMet-ccRCC細胞中E-cadherin顯著上調(diào),N-cadherin、MMP-9、PCNA顯著下調(diào),表明沉默EPAS1抑制HiMet-ccRCC細胞增殖、遷移及侵襲可能與調(diào)控E-cadherin、N-cadherin、MMP-9、PCNA表達有關。

表5 各組HiMet-ccRCC細胞增殖、遷移、侵襲相關蛋白表達比較
綜上所述,沉默EPAS1可調(diào)控E-cadherin、N-cadherin、MMP-9、PCNA表達,抑制HiMet-ccRCC細胞增殖、遷移及侵襲,提示EPAS1在腎透明細胞癌發(fā)生和進展中可能為腫瘤促進因子,有望成為腎透明細胞癌的潛在生物靶標。

