大蒜素減輕OSAHS模型大鼠學習能力下降及海馬神經元凋亡
王 超,耿彩虹,趙昆朋,嵇 朋
(1.新鄉醫學院第二附屬醫院 睡眠醫學科,河南 新鄉 453002; 2.鄭州市第三人民醫院 神經內科,河南 鄭州 450000)
阻塞性睡眠呼吸暫停低通氣綜合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)主要表現為阻塞性呼吸暫停、呼吸不足或由睡眠期間上呼吸道反復、部分阻塞引起的氧飽和度下降和睡眠覺醒[1]。大腦對缺氧極為敏感,OSAHS腦部認知損傷主要原因可能為間歇性低氧(intermittent hypoxia,IH)對腦組織的影響,容易誘導某些特定部位(如海馬和皮質)神經元細胞凋亡[2]。大蒜素(allicin)是大蒜主要活性成分,具有抑菌、抗腫瘤和病毒、降血糖、預防心血管疾病等多種藥理活性,無明顯不良反應,安全性高[3]。研究顯示,大蒜素可對高糖/缺氧誘導的主動脈內皮細胞具有保護作用[4]。另有一項研究表明,大蒜素可通過突出可塑性調節活性減輕衣霉素誘導的大鼠認知功能缺陷[5]。鑒于以上研究,推測大蒜素或可在OSAHS中發揮改善作用。晚期糖基化終末產物(advanced glycation endproducts,AGEs)是蛋白質和脂類非糖基化后生成物質的統稱,炎性反應、氧化應激等可促進AGEs形成[6]。AGEs-糖基化終末產物受體(RAGE)-核轉錄因子κB(NF-κB)通路是RAGE與AGEs相互作用后具有代表性的一種信號傳導途徑,OSAHS可激活該通路,損害臟器[7]。大蒜素對缺氧損傷及認知功能的改善作用已有報道,但其是否可通過AGEs/RAGE/NF-κB通路在OSAHS中發揮作用尚不十分明確。基于此,本研究通過建立OSAHS模型,觀察大蒜素對OSAHS模型大鼠的影響及可能作用機制,為臨床治療提供參考。
1 材料與方法
1.1 材料
1.1.1 實驗動物:SD大鼠,雄性,SPF級,體質量180~220 g,8周齡,100只[廈門萬泰滄海生物技術有限公司,許可證號:SCXK(閩)2018-0002]。購入后適應性飼養1周,保持環境通風,溫度21~25 ℃,濕度50%~70%,光暗循環12 h/12 h。
1.1.2 試劑:大鼠腫瘤壞死因子(TNF-α)、白細胞介素-6(IL-6)和TUNEL凋亡染色試劑盒(北京索萊寶生物科技有限公司);大鼠AGEs ELISA試劑盒(上海恪敏生物科技有限公司);兔抗大鼠RAGE、B淋巴細胞瘤-2基因(Bcl-2)、Bcl-2相關X蛋白(Bax)、NF-κB p65、p-NF-κB p65一抗及羊抗兔二抗-HRP(Abcam公司)。大蒜素(≥97%,批號A50961)(上海吉至生化科技有限公司);莫達非尼(200 mg/片,批號050618)(湖北威爾曼制藥股份有限公司)
1.2 方法
1.2.1 分組和干預方法:大鼠分為對照組、模型組(參照文獻[8]使用低氧/復氧模擬艙建立OSAHS模型)、大蒜素低劑量(10 mg/kg)、高劑量(40 mg/kg)組、陽性藥物組(莫達非尼,20 mg/kg)。參照文獻[9-10]設置劑量,大蒜素使用0.9%氯化鈉溶液稀釋,低、高劑量組分別按照體質量灌胃給藥10 mg/kg和40 mg/kg,陽性藥物組給予20 mg/kg莫達非尼。各組均每天給藥1次,持續4周。
1.2.2 Morris水迷宮實驗檢測大鼠學習能力:定位導航實驗:記錄大鼠搜索并爬上平臺的運動軌跡和時間,爬上平臺所需時間為逃逸潛伏期。空間探索實驗:拆除平臺,將大鼠面向池壁放入水中,記錄120 s內穿越平臺的次數,重復3次,取均值。
1.2.3 樣品采集:分離大鼠海馬組織,各組取6只大鼠海馬組織,置于4%多聚甲醛固定,余下置于-80 ℃存儲。
1.2.4 ELISA檢測炎性因子水平:取-80 ℃存儲的6只海馬組織,勻漿、離心,取上清。使用ELISA試劑盒,按照說明書操作步驟檢測海馬組織TNF-α、IL-6、AGEs含量。
1.2.5 HE染色觀察海馬組織病理學變化:左側海馬組織(4%多聚甲醛固定)經石蠟包埋,切片、脫蠟、常規HE染色,脫水、透明、中性樹脂封固,光學顯微鏡觀察。
1.2.6 TUNEL法觀察海馬組織神經元凋亡:取海馬組織切片,按照TUNEL試劑盒說明書操作步驟對切片染色,顯微鏡觀察海馬組織神經元凋亡情況。取5個不同區域視野(10×20),顯微鏡下觀察,并計算凋亡細胞指數(AI),AI(%)=凋亡細胞數/總細胞數×100%。
1.2.7 RT-qPCR檢測RAGE、NF-κB p65、Bcl-2、Bax mRNA表達:Trizol法提取左側海馬組織總RNA,檢測純度及濃度,將RNA反轉錄為cDNA后,并以其為模板進行PCR擴增。擴增條件:95 ℃ 30 s、95 ℃ 5 s、59 ℃ 30 s,40個循環。以β-actin為內參,采用2-△△Ct法定量分析。引物序列見表1。

表1 引物序列Table 1 Sequence of primers
1.2.8 Western blot檢測蛋白表達:取右側海馬組織,加RIPA裂解緩沖液離心,取上清液,BCA法確定蛋白濃度。通過SDS-PAGE分離蛋白(100 V、90 min),并轉移至PVDF膜(250 mA恒流),5%脫脂牛奶封閉2 h,分別加入1∶500稀釋的RAGE、NF-κB p65、p-NF-κB p65、Bcl-2、Bax和β-actin一抗進行孵育(4 ℃,24 h),TBST洗膜后,再加1∶1 000稀釋的二抗孵育(25 ℃,2 h),反復洗膜、曝光、顯影。Image J軟件測定樣品各蛋白條帶吸光度值。
1.3 統計學分析
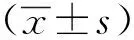
2 結果
2.1 Morris水迷宮檢測的學習能力
與對照組比較,模型組逃逸潛伏期延長、目標象限行駛時間縮短、跨平臺次數減少(P<0.05);與模型組比較,大蒜素低、高劑量組、陽性藥物組逃逸潛伏期縮短、目標象限行駛時間延長、跨平臺次數增加(P<0.05)(表2)。

表2 各組大鼠學習能力
2.2 TNF-α、IL-6、AGEs水平的比較
與對照組比較,模型組TNF-α、IL-6、AGEs水平升高(P<0.05);與模型組比較,大蒜素低、高劑量組、陽性藥物組TNF-α、IL-6、AGEs水平降低(P<0.05);與大蒜素低劑量組比較,大蒜素高劑量組、陽性藥物組TNF-α、IL-6、AGEs水平降低,且陽性藥物組TNF-α、IL-6、AGEs水平低于大蒜素高劑量組(P<0.05)(圖1)。
2.3 海馬組織病理學的觀察
對照組的海馬神經元排列整齊、結構完整,無明顯異常變化;模型組的神經元細胞組織間隙擴大、排列紊亂、細胞質稀少且核仁不明顯;大蒜素低、高劑量組、陽性藥物組的神經元排列較整齊、結構層次較完整、細胞質較均勻且與細胞核邊界逐漸清晰、略有少量神經元細胞結構形態出現異常,其中大蒜素高劑量組、陽性藥物組接近于對照組(圖2)。
2.4 TUNEL法觀察海馬組織神經元凋亡
與對照組比較,模型組AI升高(P<0.05);與模型組比較,大蒜素低、高劑量組、陽性藥物組AI降低(P<0.05);與大蒜素低劑量組比較, 大蒜素高劑量組、陽性藥物組AI降低,且陽性藥物組低于大蒜素高劑量組(P<0.05)(圖3)。

*P<0.05 compared with the control; △P<0.05 compared with model; #P<0.05 compared with low-dose allicin group圖1 海馬組織TNF-α、IL-6、AGEs水平Fig 1 TNF-α, IL-6 and AGEs levels in hippocampus

圖2 海馬神經元的病理學變化Fig 2 Pathological changes of hippocampal neurons(HE×200,scale bar=50 μm)

*P<0.05 compared with the control; △P<0.05 compared with model; #P<0.05 compared with low-dose allicin group; ▲P<0.05 compared with high-dose allicin group
2.5 RAGE、NF-κB p65、Bcl-2和Bax mRNA水平比較
與對照組比較,模型組RAGE、Bax mRNA水平升高,Bcl-2 mRNA水平降低(P<0.05);與模型組比較, 大蒜素低、 高劑量組、 陽性藥物組Bcl-2 mRNA水平升高,RAGE、Bax mRNA水平降低(P<0.05);與大蒜素低劑量組比較,大蒜素高劑量組、陽性藥物組Bcl-2 mRNA水平升高,RAGE、Bax mRNA水平降低(P<0.05);與大蒜素高劑量組比較,陽性藥物組Bcl-2 mRNA水平升高,RAGE、Bax mRNA水平降低(P<0.05)(圖4)。
2.6 RAGE、NF-κB p65、p-NF-κB p65、Bcl-2、Bax蛋白水平比較
與對照組比較,模型組RAGE、p-NF-κB p65、Bax蛋白水平升高、Bcl-2蛋白水平降低(P<0.05);與模型組比較,大蒜素低、高劑量組、陽性藥物組Bcl-2蛋白水平升高,RAGE、p-NF-κB p65、Bax蛋白水平降低(P<0.05);與大蒜素低劑量組比較,大蒜素高劑量組、陽性藥物組Bcl-2蛋白水平升高,RAGE、p-NF-κB p65、Bax蛋白水平降低(P<0.05);與大蒜素高劑量組比較,陽性藥物組Bcl-2蛋白水平升高,RAGE、p-NF-κB p65、Bax蛋白水平降低(P<0.05)(圖5)。
3 討論
OSAHS患病率高,可出現情緒障礙,甚至會影響認知能力并增加代謝疾病的風險。OSAHS可能是由睡眠期間反復低氧、再充氧引起的氧化應激反應誘導炎性反應相關易感基因表達及生物活性物質的蛋白質合成,從而引起炎性反應和代謝紊亂,增加心血管疾病與代謝疾病風險。
OSAHS中反復低氧-復氧,產生大量活性氧自由基,使得機體受到損害,其中神經損傷尤為明顯,甚至導致腦部神經元丟失;而大腦內海馬體在空間記憶、情景記憶和空間導航中起著至關重要的作用。臨床研究表明[11],OSAHS出現長期、 反復低氧血癥可導致神經和心理缺陷,包括神經認知功能如注意力、記憶力、執行能力和警覺性下降。此外,IH是刺激細胞凋亡常見因素,OSAHS還會導致海馬萎縮且體積縮小,與認知功能下降呈正相關[12]。本研究結果發現,大蒜素可有效改善OSAHS大鼠學習認知能力;且經大蒜素干預后,TNF-α、IL-6、AGEs水平和AI較模型組降低,炎性反應得以有效改善,神經元凋亡減少,表明大蒜素可能通過減輕炎性反應減少腦部神經元丟失,進而提高學習認知能力。此外,HE結果也顯示,大蒜素各組海馬神經元損傷較模型組均出現不同程度改善,與陽性藥物組效果相當,進一步證實大蒜素對OSAHS大鼠的改善作用。

*P<0.05 compared with the control; △P<0.05 compared with model; #P<0.05 compared with low-dose allicin group; ▲P<0.05 compared with high-dose allicin group

A.representative result of Western blot; B.statistical analysis of protein expression level; *P<0.05 compared with the control; △P<0.05 compared with model; #P<0.05 compared with low-dose allicin group; ▲P<0.05 compared with high-dose allicin group
AGEs/RAGE信號加強導致NF-κB活性增加,從而引起細胞因子水平升高,NF-κB活性增加又可反過來上調RAGE表達,在細胞凋亡過程中發揮重要作用[13]。Bcl-2家族在線粒體介導的細胞凋亡途徑中起重要作用,Bcl-2/Bax表達水平與細胞凋亡過程密切相關。研究顯示,抑制AGEs-RAGE/NF-κB通路可減輕D-半乳糖誘導的神經炎性反應,恢復小鼠記憶功能[14]。此外,小檗堿緩解糖尿病小鼠認知功能障礙與調節AGEs-RAGE/NF-κB通路有關[15]。以上研究均提示AGEs-RAGE/NF-κB通路與神經功能有關。本研究結果顯示,大蒜素能顯著降低大鼠海馬組織RAGE、Bax mRNA和RAGE、p-NF-κB p65、Bax蛋白表達,提示大蒜素可降低OSAHS對機體的損害,可能與抑制AGEs-RAGE/NF-κB通路關鍵分子表達從而減輕炎性反應和神經元凋亡有關。
綜上所述,大蒜素能有效改善OSAHS大鼠學習認知能力,其機制可能通過調節AGEs-RAGE/NF-κB軸相關mRNA和蛋白表達及下游炎性因子發揮作用,本研究結果為臨床治療提供參考。

