阿爾泰金蓮花總黃酮通過miR-23b-3p抑制RSV感染支氣管上皮細胞凋亡和炎癥反應的分子機制研究
尚耀民,邢寶春?,胡旭,周曉蕾,梁瑞霞,張一
(1.河南省胸科醫院,河南 鄭州 450000;2.河南中醫藥大學第一附屬醫院,河南 鄭州 450000)
呼吸道合胞病毒(RSV)是引起下呼吸道感染的主要病原體,可引起病毒性肺炎,其中支氣管上皮細胞是RSV感染的主要場所。RSV感染呼吸道上皮細胞后誘導細胞產生大量細胞因子,引起上皮細胞損傷,誘導氣道上皮屏障功能出現障礙,從而導致支氣管炎、肺炎、哮喘等呼吸道疾病的發生[1-4]。目前針對RSV感染尚無安全有效的特異性防治措施及特效藥物,而研究表明中醫藥對呼吸道病毒的抑制作用明顯,可減輕炎癥反應,改善肺功能[5-6]。阿爾泰金蓮花是毛茛科金蓮花屬多年生草本植物,金蓮花與其是同屬植物,其所含的黃酮類成分有抗氧化、抗炎、抗病毒的活性[7-8]。研究發現,阿爾泰金蓮花總黃酮提取物可能通過抑制炎癥反應、抗氧化損傷對大氣細顆粒物(PM2.5)誘導的BEAS-2B 細胞急性損傷具有一定的保護作用[9]。阿爾泰金蓮花總黃酮對PM2.5 致大鼠肺纖維化也有一定的防治作用[10]。但阿爾泰金蓮花總黃酮對RSV 感染支氣管上皮細胞分子機制尚不清楚。研究發現,重癥肺炎患兒中miR-23b-3p 低表達[11],miR-23b-3p 靶向PALM3 抑制肺炎鏈球菌誘導的A549 細胞損傷[12],說明miR-23b-3p 與肺部炎癥反應有關。本實驗旨在研究阿爾泰金蓮花總黃酮對RSV 感染支氣管上皮細胞凋亡和炎癥反應的影響及是否與miR-23b-3p 有關,現將研究結果報道如下。
1 材料與方法
1.1 材料
人支氣管上皮細胞16-HBE、呼吸道合胞病毒(RSV)(深圳市豪地華拓生物科技有限公司);DMEM培養基(江蘇齊氏生物科技有限公司,批號:CB3955688);CCK-8 試劑盒(批號:CA1210)、凋亡檢測試劑盒(批號:G1120)(北京索萊寶科技有限公司);蛋白裂解液(上海貝博生物科技有限公司,批號:BB-3201);TNF-α ELISA 試劑盒(批號:E-EL-H0109c)、IL-6 ELISA 試劑盒(批號:E-EL-H6156)、IL-1α ELISA 試劑盒(批號:E-EL-H0088c)(武漢伊萊瑞特生物科技股份有限公司);熒光定量PCR試劑盒[天根生化科技(北京)有限公司,批號:FP402-02]。
1.2 阿爾泰金蓮花總黃酮的制備
阿爾泰金蓮花藥材購自新疆藥材市場。取適量干燥阿爾泰金蓮花藥材,加30倍體積70%乙醇,加熱、回流2 次,1.5 h/次,收集2 次濾液,蒸干后用培養基定容,配置成實驗所需濃度備用。
1.3 細胞處理與分組
16-HBE 細胞用DMEM 培養基常規培養,用呼吸道合胞病毒(RSV)感染16-HBE細胞作為RSV組,正常培養的細胞作為NC 組;分別用8.0、16.0、32.0 μg/mL的阿爾泰金蓮花總黃酮處理RSV 感染的16-HBE 細胞,記為RSV+低、中、高劑量組;將miR-23b-3p 模擬物及陰性對照轉染至RSV 感染的16-HBE 細胞,記為RSV+miR-23b-3p 組、RSV+miR-NC 組;將miR-23b-3p 抑制劑及陰性對照轉染至RSV 感染的16-HBE 細胞后用32.0 μg/mL 的阿爾泰金蓮花總黃酮處理,記為anti-miR-23b-3p+RSV+高劑量組、anti-miR-NC+RSV+高劑量組。
1.4 CCK-8檢測細胞活性
各組培養48 h 細胞,加10 μL CCK-8 試劑,孵育2 h,酶標儀檢測各組細胞450 nm吸光度值(A)。
1.5 流式細胞術檢測細胞凋亡
各組細胞培養48 h,預冷PBS漂洗,與500μL的結合緩沖液混勻;先加10μL Annexin V-FITC,再加5μL PI,避光孵育10 min;流式細胞儀檢測細胞凋亡率。
1.6 Western blot法檢測蛋白表達
提取細胞總蛋白,定量后進行SDS-PAGE,轉移至PVDF,封閉后加CyclinD1、Cleaved Caspase-3、Bax一抗,4 ℃孵育過夜,加二抗室溫孵育2 h,曝光顯影,定影,測定蛋白條帶的灰度值。
1.7 ELISA法檢測TNF-α、IL-6、IL-1α水平
各組細胞培養48 h后取上清測定TNF-α、IL-6、IL-1α水平,具體按照試劑盒操作進行檢測。
1.8 RT-qPCR法檢測miR-23b-3p表達水平
提取細胞總RNA,反轉錄成cDNA,進行PCR 擴增,每個樣品重復3次,相對表達量采用2-△△Ct法計算。miR-23b-3p 上游引物:5'-CAGGCAAGATGCTGTT GCA-3',下游引物:5'-GCGAGCACAGAATTAATACGA CTC-3'。
1.9 統計學分析
采用SPSS 20.0 軟件進行統計學分析,計量資料用±s表示,兩組比較行t檢驗,多組間比較采用單因素方差分析。P<0.05為差異有統計學意義。
2 結果
2.1 各組細胞活性和凋亡情況比較
RSV 組細胞活性較NC 組降低,凋亡率較NC 組升高(P<0.01);RSV+低、中、高劑量組細胞活性較RSV組升高,凋亡率較RSV組降低(P<0.01)。見圖1,表1。
表1 各組細胞活性和凋亡情況的比較(±s)
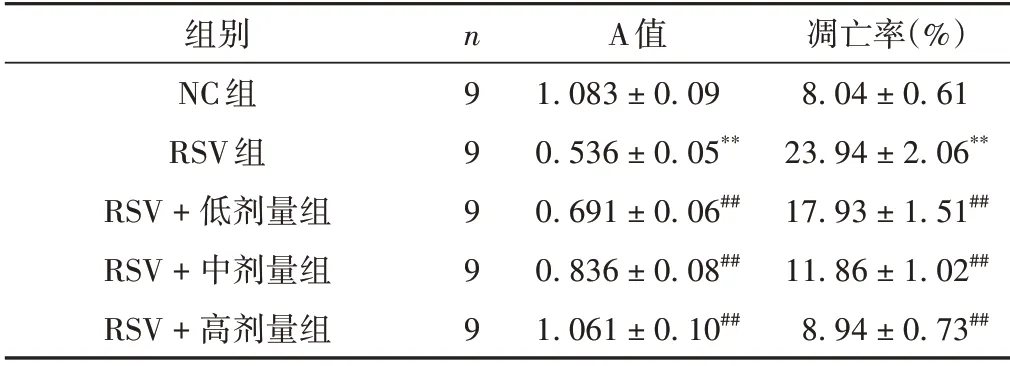
表1 各組細胞活性和凋亡情況的比較(±s)
注:與NC組比較,*P <0.01;與RSV組比較,#P <0.01。
凋亡率(%)8.04±0.61 23.94±2.06**17.93±1.51##11.86±1.02##8.94±0.73##組別NC組RSV組RSV+低劑量組RSV+中劑量組RSV+高劑量組n 9 9 9 9 9 A值1.083±0.09 0.536±0.05**0.691±0.06##0.836±0.08##1.061±0.10##
2.2 各組細胞相關蛋白表達情況比較
RSV 組CyclinD1 表達水平較NC 組降低,Cleaved Caspase-3、Bax 表達水平較NC 組升高(P<0.01);RSV+低、中、高劑量組CyclinD1 表達水平較RSV 組升高,Cleaved Caspase-3、Bax 表達水平較RSV 組降低(P<0.01)。見圖2,表2。
表2 各組細胞相關蛋白表達的比較(±s)
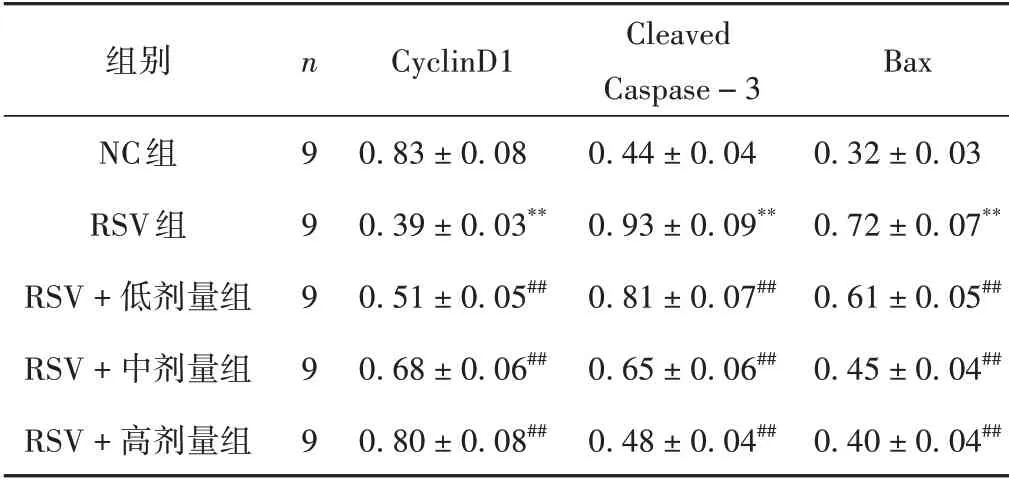
表2 各組細胞相關蛋白表達的比較(±s)
注:與NC組比較,**P <0.01;與RSV組比較,##P <0.01。
組別CyclinD1 Bax NC組RSV組RSV+低劑量組RSV+中劑量組RSV+高劑量組n 9 9 9 9 9 0.32±0.03 0.72±0.07**0.61±0.05##0.45±0.04##0.40±0.04##0.83±0.08 0.39±0.03**0.51±0.05##0.68±0.06##0.80±0.08##Cleaved Caspase-3 0.44±0.04 0.93±0.09**0.81±0.07##0.65±0.06##0.48±0.04##
2.3 各組細胞炎癥因子表達情況比較
RSV 組TNF-α、IL-6、IL-1α 水平較NC 組升高(P<0.01);RSV+低、中、高劑量組TNF-α、IL-6、IL-1α水平較RSV組降低(P<0.01)。見表3。
表3 各組細胞炎癥因子表達的比較(±s)
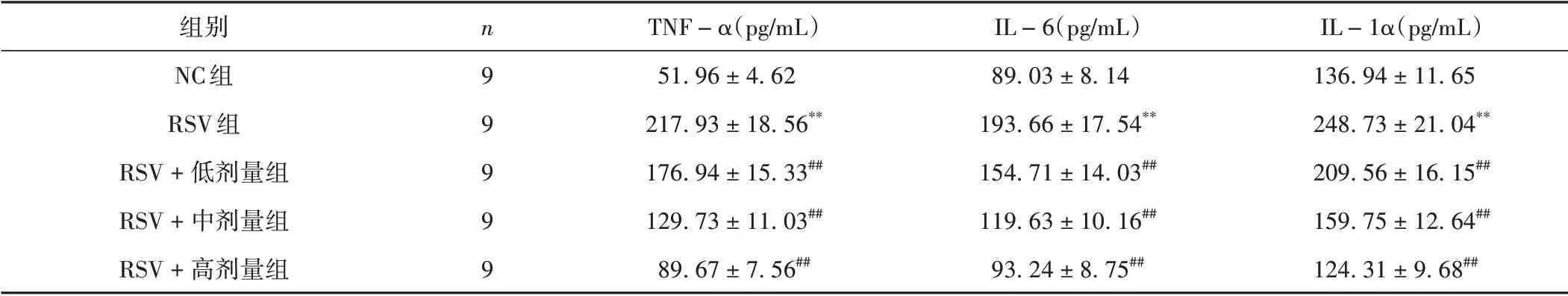
表3 各組細胞炎癥因子表達的比較(±s)
注:與NC組比較,**P <0.01;與RSV組比較,##P <0.01。
IL-1α(pg/mL)136.94±11.65 248.73±21.04**209.56±16.15##159.75±12.64##124.31±9.68##組別NC組RSV組RSV+低劑量組RSV+中劑量組RSV+高劑量組n 9 9 9 9 9 TNF-α(pg/mL)51.96±4.62 217.93±18.56**176.94±15.33##129.73±11.03##89.67±7.56##IL-6(pg/mL)89.03±8.14 193.66±17.54**154.71±14.03##119.63±10.16##93.24±8.75##
2.4 各組細胞miR-23b-3p表達情況比較
RSV 組miR-23b-3p 表達水平較NC 組降低(P<0.01);RSV+低、中、高劑量組miR-23b-3p 表達水平較RSV組升高(P<0.01)。見表4。
表4 各組細胞miR-23b-3p表達情況比較(±s)
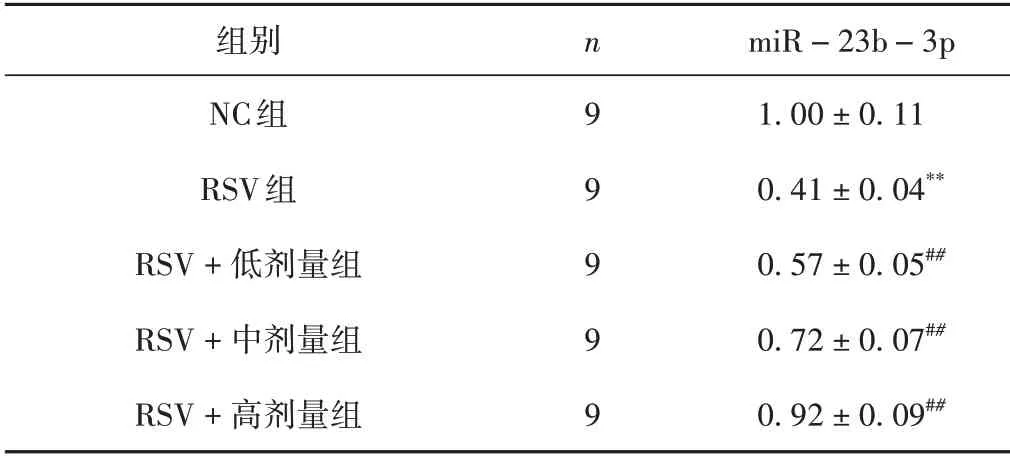
表4 各組細胞miR-23b-3p表達情況比較(±s)
注:與NC組比較,**P <0.01;與RSV組比較,##P <0.01。
miR-23b-3p 1.00±0.11 0.41±0.04**0.57±0.05##0.72±0.07##0.92±0.09##組別NC組RSV組RSV+低劑量組RSV+中劑量組RSV+高劑量組n 9 9 9 9 9
2.5 miR-23b-3p 對RSV 感染的支氣管上皮細胞16-HBE活性,凋亡,蛋白表達和炎癥因子水平的影響
RSV+miR-23b-3p 組miR-23b-3p 表達水平、細胞活性和CyclinD1 表達水平較RSV+miR-NC組高,凋亡率、Cleaved Caspase-3、Bax 表達水平、TNF-α、IL-6、IL-1α 水平較RSV+miR-NC 組低(P<0.05)。見圖3,表5和表6。
表5 miR-23b-3p對RSV感染的支氣管上皮細胞(16-HBE)活性、凋亡影響(±s)

表5 miR-23b-3p對RSV感染的支氣管上皮細胞(16-HBE)活性、凋亡影響(±s)
注:與RSV+miR-NC組比較,**P <0.01。
組別RSV+miR-NC組RSV+miR-23b-3p組Bax 0.73±0.07 0.35±0.03**n 9 9 miR-23b-3p 1.00±0.10 2.69±0.24**A值0.54±0.05 1.03±0.09**凋亡率(%)23.89±2.11 9.21±0.85**CyclinD1 0.41±0.04 0.79±0.07**Cleaved Caspase-3 0.94±0.09 0.48±0.03**
表6 miR-23b-3p對RSV感染的支氣管上皮細胞(16-HBE)炎癥因子水平的影響(±s)

表6 miR-23b-3p對RSV感染的支氣管上皮細胞(16-HBE)炎癥因子水平的影響(±s)
注:與RSV+miR-NC組比較,**P <0.01。
組別RSV+miR-NC組RSV+miR-23b-3p組IL-1α(pg/mL)247.91±22.53 119.14±9.68**n 9 9 TNF-α(pg/mL)218.16±17.59 73.94±6.85**IL-6(pg/mL)194.08±16.91 72.11±7.04**
2.6 anti-miR-23b-3p 對阿爾泰金蓮花總黃酮作用的RSV 感染的支氣管上皮細胞16-HBE 活性、凋亡和炎癥因子水平的影響
anti-miR-23b-3p+RSV+高劑量組miR-23b-3p 表達水平、細胞活性和CyclinD1 表達水平較anti-miR-NC+RSV+高劑量組降低(P<0.01),凋亡率、Cleaved Caspase-3、Bax 表達水平、TNF-α、IL-6、IL-1α 水平較anti-miR-NC+RSV+高劑量組升高(P<0.01)。見圖4,表7和表8。
表7 anti-miR-23b-3p對阿爾泰金蓮花總黃酮作用的RSV感染的支氣管上皮細胞(16-HBE)活性、凋亡影響(±s)

表7 anti-miR-23b-3p對阿爾泰金蓮花總黃酮作用的RSV感染的支氣管上皮細胞(16-HBE)活性、凋亡影響(±s)
注:與anti-miR-NC+RSV+高劑量組比較,**P <0.01。
組別anti-miR-NC+RSV+高劑量組anti-miR-23b-3p+RSV+高劑量組Bax 0.39±0.04 0.76±0.07**n 9 9 miR-23b-3p 1.00±0.11 0.45±0.04**A值1.06±0.09 0.53±0.05**凋亡率(%)8.91±0.81 22.04±1.96**CyclinD1 0.81±0.08 0.41±0.04**Cleaved Caspase-3 0.47±0.04 0.89±0.08**
表8 anti-miR-23b-3p對阿爾泰金蓮花總黃酮作用的RSV感染的支氣管上皮細胞(16-HBE)炎癥因子水平的影響(±s)

表8 anti-miR-23b-3p對阿爾泰金蓮花總黃酮作用的RSV感染的支氣管上皮細胞(16-HBE)炎癥因子水平的影響(±s)
注:與anti-miR-NC+RSV+高劑量組比較,**P <0.01。
組別anti-miR-NC+RSV+高劑量組anti-miR-23b-3p+RSV+高劑量組IL-1α(pg/mL)125.03±10.06 233.19±20.01**n 9 9 TNF-α(pg/mL)89.57±8.46 177.36±14.02**IL-6(pg/mL)93.31±8.97 206.03±16.34**
3 討論
呼吸系統疾病是嚴重威脅人類生命的常見病、多發病,支氣管上皮細胞是機體對外保護的第一道屏障,可以對抗潛在病原體和外來顆粒性引起的損傷,是氣道的物理保護壁,支氣管上皮細胞損傷可誘導氣道炎癥,而炎癥又可引起氣道上皮反復損傷,進而造成呼吸系統疾病的發生[13-15]。中藥及其活性成分在一系列肺相關疾病中可抑制感染、炎癥[16-17]。研究發現阿爾泰金蓮花浸膏粉對PM2.5 致大鼠急性肺損傷有保護作用[18]。金蓮花總黃酮提取物對LPS致大鼠急性肺損傷具有保護作用,其機制可能與其抗氧化作用和減少炎癥因子的釋放有關[19]。本實驗結果顯示,不同劑量阿爾泰金蓮花總黃酮處理后,能增加細胞活性和CyclinD1 表達水平,降低凋亡率、Cleaved Caspase-3、Bax 表達水平,表明阿爾泰金蓮花總黃酮可抑制RSV感染的16-HBE 細胞凋亡,促進細胞存活。TNF-α、IL-6、IL-1α 是促炎細胞因子,其水平升高可促進炎癥反應的發生[20-21]。經阿爾泰金蓮花總黃酮處理,可降低16-HBE 細胞TNF-α、IL-6、IL-1α 水平,表明阿爾泰金蓮花總黃酮可抑制RSV 感染的16-HBE 細胞炎癥反應。提示,阿爾泰金蓮花總黃酮對RSV 感染的16-HBE細胞損傷具有一定的保護作用。
研究表明miRNA 可參與調控RSV 引起的支氣管上皮細胞炎癥反應[22]。研究發現皮肌炎患者血清中miR-23b-3p 下調表達,參與皮肌炎的發病過程[23]。過表達miR-23b-3p 可降低類固醇引起的股骨頭壞死大鼠促炎細胞因子水平[24]。表明miR-23b-3p 參與炎癥反應的發生和發展。本實驗結果顯示,RSV 感染的16-HBE 細胞中miR-23b-3p 表達水平降低;過表達miR-23b-3p 可升高16-HBE 細胞活性、CyclinD1 表達水平,降低凋亡率、Cleaved Caspase-3、Bax 表達水平、TNF-α、IL-6、IL-1α 水平,表明過表達miR-23b-3p 抑制RSV 感染的16-HBE 細胞損傷。本實驗還發現,阿爾泰金蓮花總黃酮可增加miR-23b-3p 水平,而抑制miR-23b-3p 表達可逆轉阿爾泰金蓮花總黃酮對RSV 感染的16-HBE 細胞活性,凋亡和炎癥因子水平的影響。
綜上所述,阿爾泰金蓮花總黃酮可能通過上調miR-23b-3p 表達抑制RSV 感染的支氣管上皮細胞凋亡和炎癥反應。

