LncRNA PVT1 通過調節miR-214/STAT6 軸減輕哮喘模型小鼠氣道炎性反應
黃 華,周 龍,姚 迪,許 詣
(1.湖北省恩施土家族苗族自治州中心醫院 呼吸與危重癥醫學科, 湖北 恩施 445000;2.湖北文理學院附屬醫院 襄陽市中心醫院 兒科, 湖北 襄陽 441021)
支氣管哮喘(bronchial asthma)是一種涉及多種細胞和細胞因子的慢性炎性呼吸道疾病,臨床癥狀包括胸悶、氣短、喘息和干咳。哮喘的特征是氣道炎性反應和重塑,導致氣道高反應性和不可逆性氣流阻塞[1]。慢性炎性損傷是哮喘的主要病理改變,也是哮喘發作的主要特征,因此抑制炎性反應是緩解哮喘癥狀的重要靶點[2]。已有研究發現,長非編碼RNA PVT1(long non-coding RNA PVT1,lncRNA PVT1)與炎性疾病的發生發展密切相關。哮喘患者的原代氣道平滑肌細胞中lncRNA PVT1的表達高于健康人,lncRNA PVT1的表達可能影響氣道平滑肌細胞的增殖和炎性因子的釋放[3]。這一發現表明,lncRNA PVT1在支氣管哮喘中起關鍵作用,但需要進一步研究以闡明其下游分子及其相應機制。同樣,先前的研究表明microRNAs(miRNAs)的異常表達也可以調節炎性因子的水平。例如,上調miR-214的表達可能降低信號轉導子和轉錄激活子6(signal transducers and activators of transcription 6,STAT6)的水平,減輕潰瘍性結腸炎的炎性反應[4]。因此,本研究擬通過構建哮喘小鼠模型,以探究抑制lncRNA PVT1表達對支氣管哮喘的影響,以及對miR-214/STAT6軸的作用機制。
1 材料與方法
1.1 材料
1.1.1 動物:SPF級雄性Balb/c小鼠,體質量18~22 g[河北醫科大學,許可證號:SYXK(冀)2020-002]。實驗動物在房間通風良好、溫度(24±2)℃、相對濕度為60%±10%和12∶12明暗周期的條件下飼養。動物自由采食飲水,經過一周適應性飼養后用于實驗。本研究經本院倫理委員會批準。
1.1.2 細胞與試劑:人小氣道上皮細胞系(human small airway epithelial cells,HSAECs)(中國科學院上海生物化學與細胞生物學研究所)。LncRNA PVT1抑制物及其陰性對照序列、miR-214模擬物及其陰性對照序列(廣州銳博生物科技有限公司合成)。白介素-4(Interleukin-4,IL-4)測試盒、IL-5試劑盒、IL-13試劑盒和卵清蛋白特異性IgE(ovalbumin specific IgE,OVA-sIgE)試劑盒(南京建成生物工程研究所)。RNA提取試劑盒(北京天根生化科技有限公司)。熒光定量PCR試劑盒[寶日醫生物技術(北京)有限公司]。Anti-STAT6抗體及Anti-STAT6(phospho Y641)抗體(Abcam公司)。雙熒光素酶報告基因檢測試劑盒(北京索萊寶生物有限公司)。Lipofectamine 3000試劑盒(Thermo Fisher Scientific公司)。引物由上海生工生物工程有限公司合成。
1.2 方法
1.2.1 動物的分組及處理:將小鼠隨機分成對照組、模型組(于第1、8、15天腹腔注射100 μg OVA+1 mg氫氧化鋁致敏。最后次致敏后,用1% OVA霧化吸入,每天30 min,連續7 d[5])、lncRNA PVT1抑制組和lncRNA PVT1 NC組(在OVA霧化吸入前,每天尾靜脈注射lncRNA PVT1抑制物或其陰性對照,持續7 d),每組12只。
1.2.2 支氣管肺泡灌洗液(BALF)的分析:末次干擾24 h后,腹腔注射麻醉處死小鼠,然后暴露氣管切開,注入PBS 3 mL后抽出2 mL支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),4 ℃下400×g離心10 min,上清液保存在-80 ℃中備用。使用血細胞計數儀計數BALF中炎性細胞總數、巨噬細胞數、中性粒細胞數和淋巴細胞數。采用ELISA試劑盒對BALF上清液中白介素-4(IL-4)、白介素-5(IL-5)、白介素-13(IL-13)濃度進行檢測。
1.2.3 OVA特異性免疫球蛋白E(IgE)的測定:使用OVA特異性IgE試劑盒對各組小鼠血清中IgE含量進行檢測,具體操作根據試劑盒說明書進行。
1.2.4 肺組織病理學檢測:取各組小鼠的右肺組織常規制片染色后,于光學顯微鏡下觀察炎性細胞浸潤情況,并對肺組織的炎性細胞浸潤情況進行評分。評分標準為;0分(無)為肺組織無明顯炎性細胞浸潤;1分(輕度)為輕度炎性細胞浸潤;2分(中度)為中度炎性細胞浸潤;3分(重度)為重度炎性細胞浸潤[6]。
1.2.5 RT-qPCR檢測肺組織中miR-214和STAT6 mRNA水平:采用Trizol試劑從左肺組織勻漿中提取總RNA。使用PrimeScript RT試劑盒進行反轉錄合成cDNA。使用Bio-Rad CFX96 Touch q-PCR系統進行RT-qPCR檢測。反應混合物包括引物,Taq DNA聚合酶,PCR緩沖液,cDNA模板溶液和DEPC水。擴增過程為:95 ℃預變性60 s;95 ℃變性5 s,65 ℃退火30 s,72 ℃延伸120s,共40個循環。以U6或Gapdh為內參基因,用2-△△Ct法計算miR-214和STAT6 mRNA的相對表達量。本研究中使用的引物序列(表1)。

表1 RT-qPCR引物序列Table 1 Primers of RT-qPCR
1.2.6 Western blot檢測肺組織中STAT6和p-STAT6蛋白表達:將肺組織用含蛋白酶和磷酸酶抑制劑的冰冷RIPA裂解緩沖液勻漿化,提取肺組織中總蛋白并檢測含量。使用10%十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(SDS-PAGE)分離總蛋白,然后轉移到聚偏二氟乙烯(PVDF)膜上。在含有5%牛血清白蛋白的緩沖液中封閉1.5 h,然后在4 ℃下與抗STAT6(1∶1 000)和p-STAT6(1∶500)的一抗過夜孵育。用辣根過氧化物酶標記的抗兔IgG二抗在室溫下孵育1.5 h后洗膜。膜經增強型化學發光系統試劑處理后,用全自動化學發光圖像分析系統顯示特異性抗體的結合情況,并用Image J軟件分析蛋白的相對表達水平。
1.2.7 雙熒光素酶報告基因的檢測:構建PVT1野生型和PVT1突變型的目標片段,并將其克隆到pGL3載體中,分別構建了pGL3-PVT1野生型(PVT1-wt)和pGL3-PVT1突變型(PVT1-mut)報告基因。將PVT1-wt或PVT1-mut與miR-214模擬物或其陰性對照共轉染到HSAEC細胞中。轉染48 h后,用雙熒光素酶報告基因系統檢測熒光素酶活性。
1.3 統計學分析
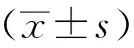
2 結果
2.1 小鼠BALF中炎性細胞分析
與對照組相比,模型組BALF中炎性細胞總數、巨噬細胞數、中性粒細胞數和淋巴細胞數顯著增加(P<0.05);與模型組和lncRNA PVT1 NC組相比,lncRNA PVT1抑制組BALF中炎性細胞總數、巨噬細胞數、中性粒細胞數和淋巴細胞數顯著回降(P<0.05)(表2)。

表2 小鼠BALF中炎性細胞分析比較Table 2 Comparison of inflammatory cells in BALF of cells/mL,n=12)
2.2 小鼠BALF中炎性因子水平變化
與對照組相比,模型組小鼠BALF中IL-4、IL-5、IL-13水平顯著升高(P<0.05);與模型組和lncRNA PVT1 NC組相比,lncRNA PVT1抑制組小鼠BALF中IL-4、IL-5、IL-13水平顯著降低(P<0.05)(表3)。

表3 小鼠BALF中IL-4、IL-5、IL-13水平的比較Table 3 Comparison of IL-4, IL-5 and IL-13 levels in BALF of mice
2.3 小鼠血清中IgE水平變化
與對照組相比,模型組小鼠血清中IgE水平顯著升高(P<0.05);與模型組和lncRNA PVT1 NC組相比,lncRNA PVT1抑制組小鼠血清中IgE水平顯著降低(P<0.05)(表4)。

表4 小鼠血清中IgE水平的比較
2.4 小鼠肺組織形態學變化
對照組小鼠肺組織結構清晰,氣道周圍或血管周圍無明顯炎性細胞浸潤。模型組和lncRNA PVT1 NC組小鼠肺組織結構不規則,氣道上皮不完整,氣道黏膜水腫,黏膜下層和血管組織周圍可見炎性細胞浸潤。與對照組相比,模型組小鼠肺組織中炎性細胞浸潤程度評分顯著升高(P<0.05);與模型組和lncRNA PVT1 NC組相比,lncRNA PVT1抑制組小鼠肺組織中炎性細胞浸潤程度評分顯著降低(P<0.05)(圖1,表5)。

圖1 小鼠肺組織形態學變化Fig 1 Morphological changes of mouse lung tissue(×200)

表5 小鼠肺組織炎性細胞浸潤程度評分的比較
2.5 小鼠肺組織中miR-214水平變化
與對照組相比,模型組小鼠肺組織中miR-214水平顯著降低(P<0.05);與模型組和lncRNA PVT1 NC組相比,lncRNA PVT1抑制組小鼠肺組織中miR-214水平顯著升高(P<0.05)(表6)。

表6 小鼠肺組織中miR-214水平的比較
2.6 小鼠肺組織中STAT6的mRNA和蛋白表達水平變化
與對照組相比,模型組小鼠肺組織中STAT6 mRNA和蛋白磷酸化水平顯著升高(P<0.05);與模型組和lncRNA PVT1 NC組相比,lncRNA PVT1抑制組小鼠肺組織中STAT6 mRNA和蛋白磷酸化水平顯著降低(P<0.05)(圖2,表7)。

圖2 小鼠肺組織STAT6與p-STAT6蛋白條帶Fig 2 Protein bands of STAT6 and P-STAT6 in lung tissues of mice

表7 小鼠肺組織中STAT6的mRNA和蛋白表達 水平的比較
2.7 miR-214與lncRNA PVT1靶向關系的預測與驗證
通過Starbase數據庫的預測,發現miR-214與lncRNA PVT1 3′ UTR存在連續結合位點。miR-214模擬物的轉染顯著抑制了PVT1-wt載體的熒光素酶活性(P<0.05),但對PVT1-mut載體的熒光素酶活性沒有顯著影響(P<0.05)(圖3,表8)。

圖3 生物信息學預測miR-214與lncRNA PVT1 3′ UTR結合位點Fig 3 Bioinformatics prediction of miR-214 and lncRNA PVT1 3′UTR binding site

表8 熒光素酶報告基因實驗檢測miR-214與lncRNA PVT1的靶向關系
3 討論
支氣管哮喘是一種慢性炎性氣道疾病,主要表現為氣道炎性、氣道高反應性和氣道重塑。以肥大細胞、中性粒細胞和嗜酸粒細胞浸潤為主要特征的氣道炎性反應是哮喘最關鍵的病理過程[7]。減輕氣道炎性反應和減輕氣道上皮損傷是哮喘治療不可缺少的。從輔助性T細胞分泌的IL-4、IL-5和IL-13等細胞因子參與哮喘的發生發展,并可促進IgE的產生[8]。在本研究中,OVA誘導哮喘小鼠后發現,小鼠炎性反應明顯,肺組織損傷嚴重,揭示小鼠哮喘模型構建成功。
LncRNAs是指長度超過200個核苷酸的非編碼RNA,越來越多的研究表明,lncRNAs在調節呼吸道炎性反應和氣道重塑中具有重要作用[9]。哮喘的發病機制涉及炎性因子的釋放和氣道細胞屏障的損傷,lncRNA也可能參與調節哮喘的發生和發展。作為免疫調節因子的lncRNA MALAT1可以調節氣道樹突狀細胞的成熟以及促炎細胞因子的分泌,從而促進炎性免疫的特定氣道微環境的形成,并加劇氣道炎性反應[10]。有研究發現[11],lncRNA PVT1的過表達可以增加炎性細胞因子IL-1β,IL-6和TNF-α的分泌,并促進氣道上皮細胞的凋亡。在本研究中,lncRNA PVT1抑制物干擾哮喘小鼠后發現,炎性因子及IgE水平降低,肺組織中氣道炎性反應減輕,表明lncRNA PVT1調節哮喘的炎性反應。
據報道,miRNAs與哮喘的發病機制有關。miR-146b、miR-206和miR-720可能參與NF-κB和GSK3/AKT信號通路的激活,并作為預測兒童哮喘惡化的生物標志物[12]。根據之前的實驗,lncRNAs可以與miRNAs相互作用來調控其表達和功能。LncRNA PVT1與miR-214存在連續結合位點[13]。因此,本研究推測PVT1可能通過調節miR-214的表達影響哮喘進展。已有研究表明,Stat6是miR-214的一個潛在的靶基因。作為在體內外誘導巨噬細胞組織蛋白酶活性的關鍵因子,STAT6在過敏性氣道疾病動物模型的黏液生成和氣道炎性反應的進展過程中具有重要意義[14]。研究結果發現,哮喘小鼠在lncRNA PVT1抑制物干擾后,miR-214水平升高,STAT6磷酸化降低。LncRNA PVT1可能通過調節miR-214/STAT6軸減輕哮喘小鼠的炎性反應。
綜上所述,抑制lncRNA PVT1表達可減輕哮喘小鼠的氣道炎性反應,其作用機制可能是通過miR-214/STAT6軸發揮作用。本研究有助于闡明哮喘的發病機制,為哮喘的治療提供新的靶點,但其作用機制仍需進一步研究。

