TNF-α對大鼠海馬神經元ERK/CREB蛋白表達的影響*
鄔薇薇 程 高 王純輝
安徽醫科大學第四附屬醫院麻醉科,安徽省合肥市 230000
急慢性疼痛對認知功能特別是對學習記憶的影響日益受到重視,并成為疼痛及認知領域研究中的重要內容。海馬在學習記憶中起著關鍵作用,1957年Scoville和MiMer在切除癲癇患者雙側海馬時導致了患者順行性遺忘,患者表現為很難形成新的記憶。此后海馬在學習記憶中的作用得到了大量的研究,目前認為短期記憶的發生與長期記憶的發生與存儲可能都與海馬有關。如果學習時海馬的蛋白質合成受到抑制,盡管動物仍能正常學習,但數天后再測試卻表現為記憶的缺失。目前多項研究證實腫瘤壞死因子(TNF-α)在慢性神經疼痛的發生發展中發揮著重要的作用。 Hogg等報道TNF-α可使海馬神經元之間的突觸傳遞效率持續性減弱,從而影響學習記憶[1]。但TNF-α影響學習記憶的具體機制不詳。細胞外調節蛋白激酶 (Extracellular regulated protein kinase,ERK)和環磷腺苷效應元件結合蛋白 (cAMP-response element binding protein,CREB)參與的信號系統在學習、記憶和神經可塑性以及調節細胞生長、凋亡、分化和細胞對應激反應中發揮重要作用[2-3]。本研究觀察TNF-α對大鼠海馬神經元ERK/CREB蛋白表達的影響,探討TNF-α在疼痛和學習記憶中的可能作用機制。
1 材料與方法
1.1 大鼠原代海馬神經元培養 取出生24h的SD胎鼠海馬組織,用小剪刀剪碎,加入 5倍體積的37℃、0.125%的胰酶消化后,反復吹打,中止胰酶,用 2 000細胞篩過濾,形成單細胞懸液。取5ml單細胞懸液,1 000r/min離心15min后培養液重懸,選擇細胞密度為1.0×106ml/L,于24孔細胞培養板進行培養,培養液為Neurobasal+2%B27,3d換液1次,首次半量換液。
1.2 免疫熒光鑒定 取培養1周的海馬神經元進行免疫熒光檢測,用預冷的40g/L多聚甲醛常溫固定15min,PBS洗滌(3min×3次),再用含0.3% Triton-x-100和5%山羊血清的PBS濕盒內室溫封閉通透1h,加入一抗神經元標志物β-tubulinⅢ(1∶200),4℃濕盒孵育過夜。次日用PBS洗滌(3min×3次),加入熒光二抗(Alexa-Fluor 488,1∶500)避光孵育1h。PBS洗滌(3min×3次),共聚焦顯微鏡下觀察。
1.3 實驗分組 神經元細胞分為兩組培養:正常培養組和TNF-α組。TNF-α組神經元培養液中加入50μg/L TNF-α,正常組加入相同體積的培養液。培養48h后行免疫熒光檢測神經元形態;使用RT-PCR和WB檢測ERK/CREB mRNA和蛋白表達情況。
1.4 RNA提取和RT-PCR檢測 按照RT-PCR的方法進行實驗,用Trizol 溶解細胞,收集胞內的總 RNA。使用SYBR Green Premix Ex Tap試劑盒進行qPCR實驗,并在ABI7500qPCR儀進行檢測。使用GAPDH作為內參,ERK的正向引物為5’-CCAGGAAAGCATTACCTTGACC-3’,反向引物5’-CCAGAGCCTGTTCAACTTCAATC-3’;CREB的正向引5’-TGGCTAACAATGGTACGGATGG-3’,反向引物5’-GTGCTGTGCGGATCTGGTATGT-3’,GAPDH的正向引物5’-CCTCGTCCCGTAGACAAAATG-3’,反向引物5’-TGAGbenGTCAATGAAGAAGGGGTCGT-3’,參考GAPDH的表達結果標準化ERK和CREB的表達結果。用DA相對拷貝數和相對表達量(2-ΔΔCt)表示ERK和CREB基因的相對表達量。
1.5 Western blot檢測 Western blot檢測兩組細胞中ERK/CREB蛋白表達情況。兩組神經元培養48h后,用PBS洗滌,lysis buffer裂解細胞。收集細胞裂解液,在4℃,10 000r/min離心20min,收集上清液,并用BCA試劑盒檢測蛋白水平。10%的SDS-PAGE溶解40mg蛋白后轉移到PVDF膜上,再用TBTS配制的5%的脫脂牛奶封閉PVDF膜1h,一抗兔抗ERK多克隆抗體(1∶2 000)和兔抗CREB多克隆抗體(1∶1 000)4℃孵育過夜,TBTS液洗滌3次后,二抗(1∶500)室溫孵育1h,使用ECL法顯影。
2 結果
2.1 大鼠海馬神經元形態學觀察和免疫鑒定 培養48h后大鼠海馬神經元貼壁,胞體透亮,飽滿,透光性強,部分細胞發出突起,長短不等,隨著培養時間的延長,突起長度逐漸增加,部分形成神經網絡(見圖1)。取培養5d的海馬神經元細胞進行免疫熒光檢測,可見神經元細胞表達特異性標志物 β-tubulinⅢ(見圖2)。
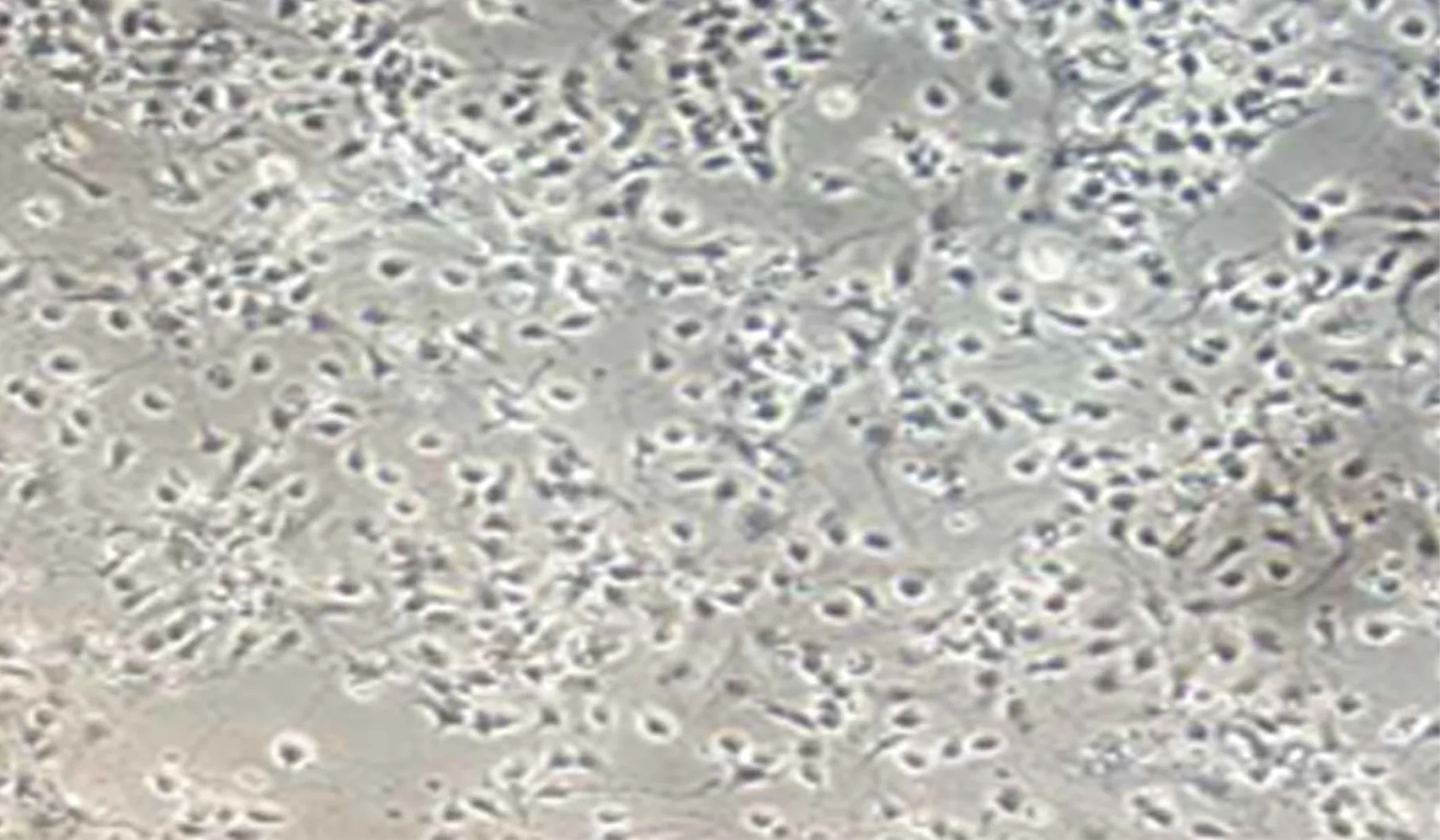
圖1 海馬神經元培養48h后光鏡圖(×200)
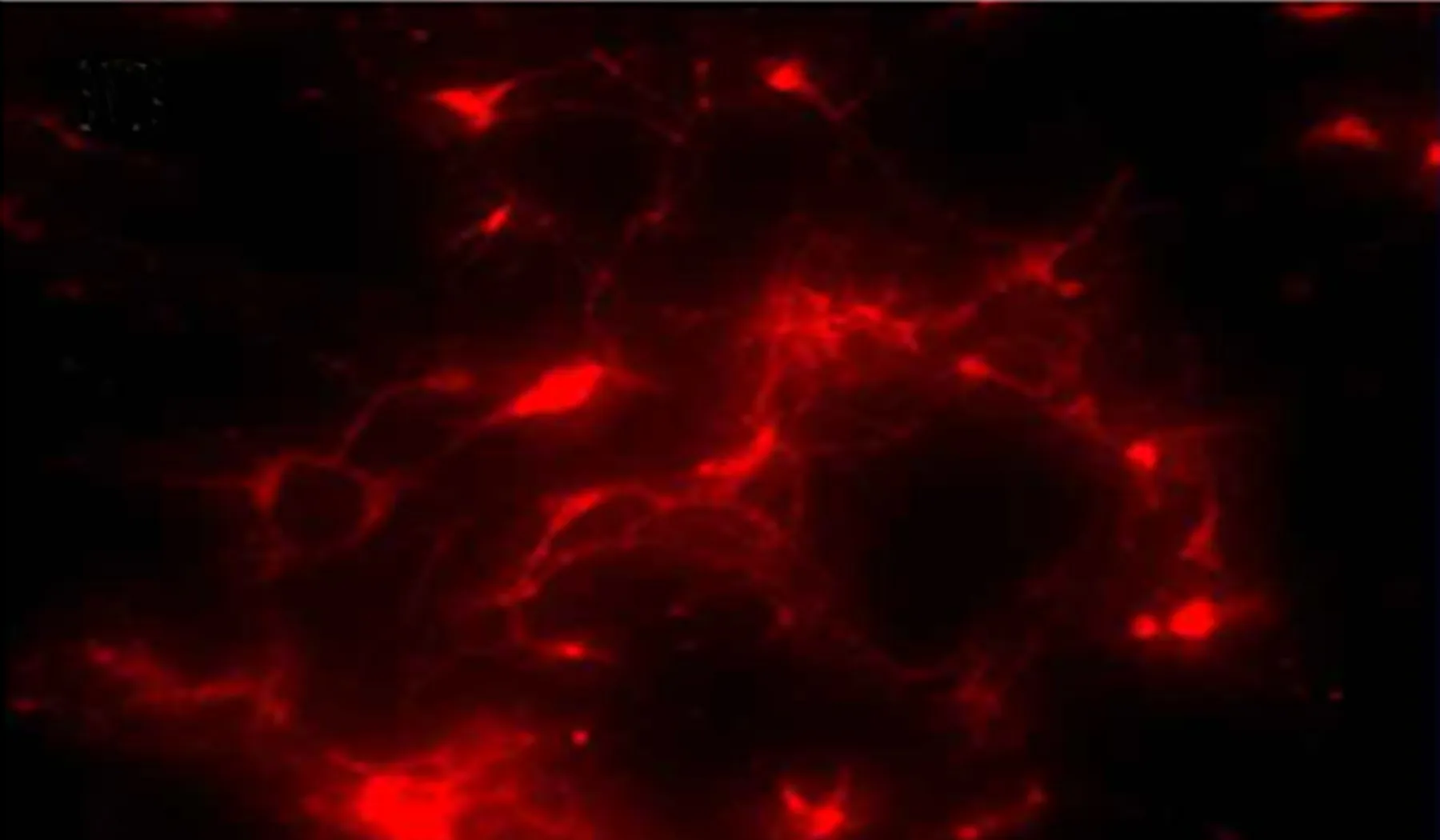
圖2 海馬神經元表達特異性標志物β-tubulinⅢ(×200)
2.2 不同實驗組神經干細胞培養情況 神經元分為TNF-α組和正常組,培養48h后行免疫熒光檢測,顯示TNF-α組神經元神經突起長度(57.2±6.4)μm明顯短于正常生長組(86.6±7.2)μm,差異有統計學意義(P<0.01)。見圖3。
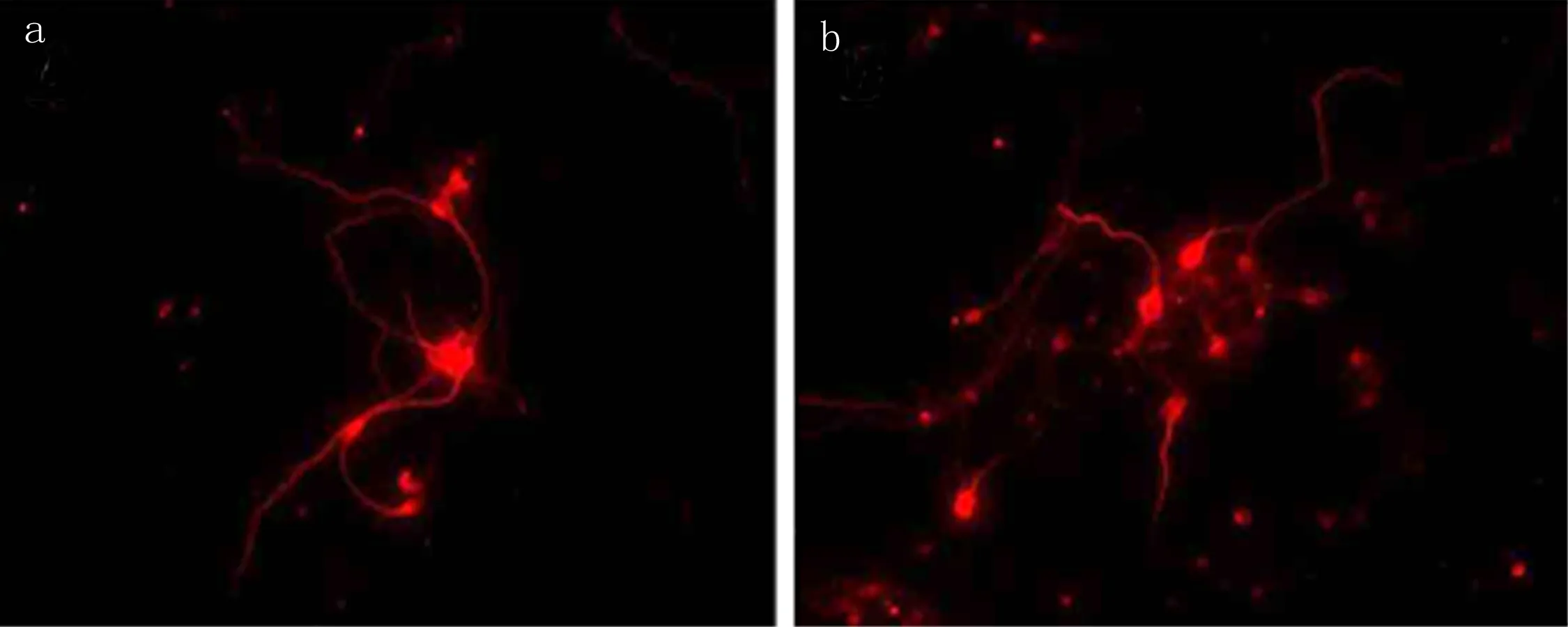
圖3 海馬神經元培養48h后免疫熒光
2.3 各組ERK和CREB mRNA水平 與正常培養組神經元相比,TNF-α組神經元細胞中ERK 和CREB mRNA水平明顯降低,差異有統計學意義(P<0.01)。見圖4。
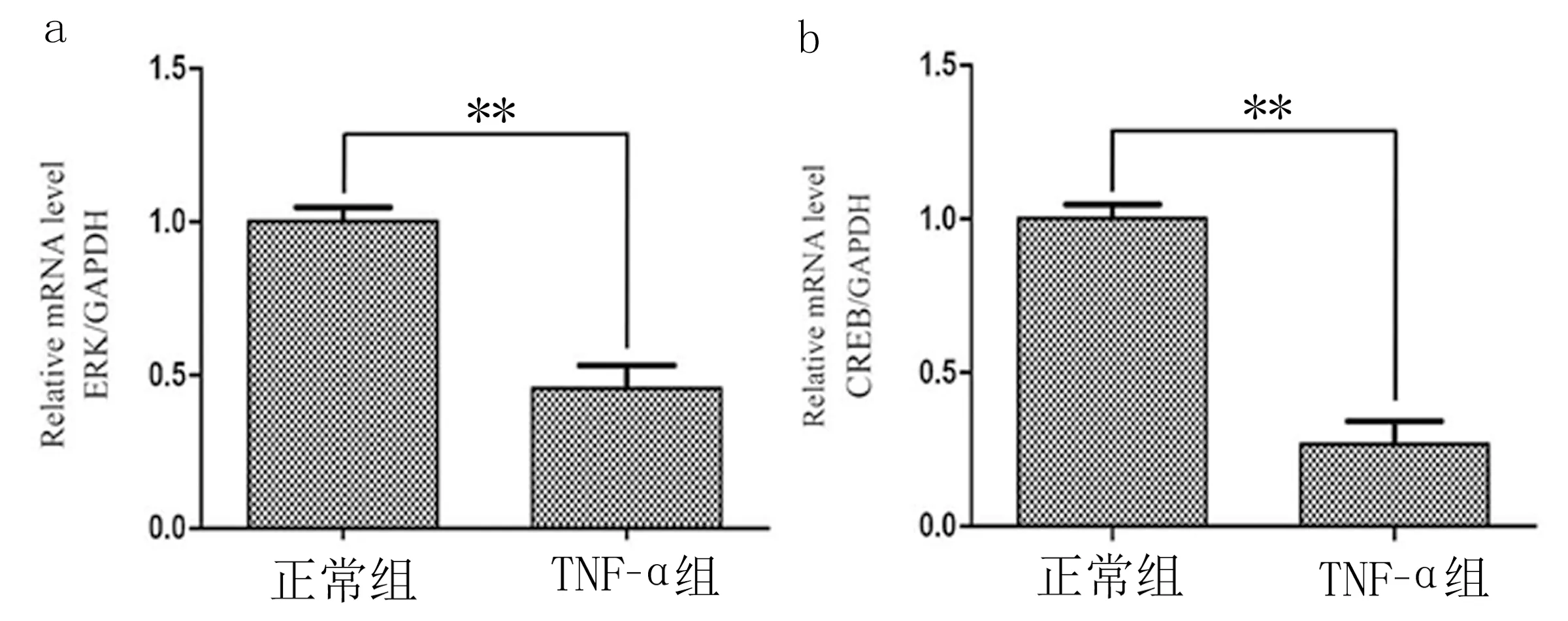
圖4 正常組和TNF-α組神經元ERK mRNA、CREB mRNA表達水平比較
2.4 各組ERK和CREB 蛋白表達情況 與正常組相比,TNF-α組ERK和CREB 蛋白表達水平明顯下降,差異有統計學意義(P<0.01)。見圖5。
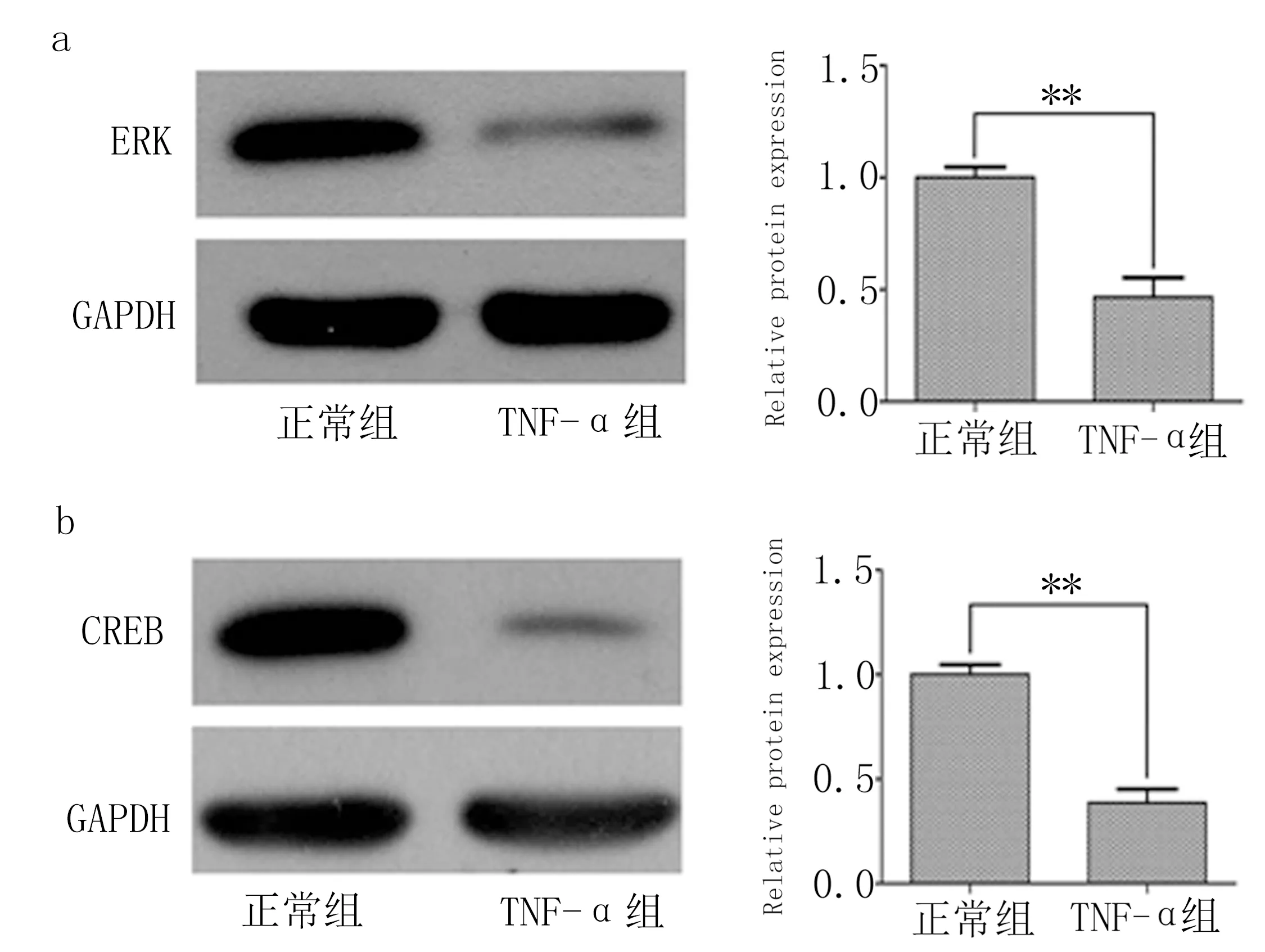
圖5 正常組和TNF-α組ERK、CREB蛋白表達水平比較
3 討論
疼痛是一種注意力依賴性的感覺刺激,在個體學習或回憶時疼痛的出現可能對學習與記憶提取時的注意力起到分散作用;而學習記憶不僅需要大腦運行信息整合,也需要認知時注意力的參與。目前臨床研究發現疼痛可以導致學習記憶能力下降,炎性痛與神經病理性疼痛能夠產生明顯的遺忘效應。動物實驗表明急慢疼痛時通常伴隨認知功能障礙。疼痛的發生發展機制十分復雜,涉及眾多的分子和信號通路[4-5]。
目前認為感染和阿爾茨海默病等多種炎癥疾病導致的遺忘效應在分子水平的作用靶點主要是皮層與海馬的TNF-α[6],2014年Liu等就研究發現慢性神經病理性疼痛時,脊髓背角與海馬的TNF-α升高,并且疼痛時升高的TNF-α對脊髓和海馬神經元的長時程增強作用(LTP)相反,外周神經損傷后的TNF-α表達升高并減弱海馬神經元的LTP,降低突觸可塑性[7]。ERK 通過激活胞質中底物而對細胞生長、發育、凋亡起調控作用,或轉移至細胞核內,促進基因的轉錄。CREB作為ERK的下游靶標,對神經可塑性和神經元結構、功能的恢復有重要作用,盡管ERK/CREB信號轉導通路在學習記憶過程中具有重要作用[8-9],但ERK、CREB作為關鍵信號分子,其蛋白的表達與活性調節是否參與TNF-α受體調控的疼痛遺忘效應仍研究較少。當學習事件發生時,海馬與皮層的興奮性突觸末端的樹突棘會表現與學習事件相關的突觸可塑性的結構改變,當突觸可塑性改變時,會發生CREB所介導的突觸活性依賴性變化。CREB作為一個“記憶蛋白”,在新記憶的發生與鞏固過程中都具有這種重要作用。CREB有磷酸化和非磷酸化兩種狀態,靜息狀態的CREB保持非磷酸化狀態,活性低。在接受外界學習過程中,外界學習信號刺激使ERK信號通路激活,磷酸化ERK使CREB磷酸化增加,磷酸化的CREB活性增加后會使得胞漿內大量具有轉錄活性的CREB轉移進入核內從而調節記憶相關的基因表達,啟動基因轉錄及蛋白質合成,參與海馬神經元突觸可塑性調節,增強記憶的編碼與形成[10]。
本研究中取大鼠海馬神經元進行原代培養并鑒定,結果證實培養的神經元形態良好,表達神經元特異性標志物。給予TNF-α刺激后,神經元突起長度明顯短于正常組,同時ERK和CREB mRNA和蛋白表達較正常組下降。這也與部分研究結果相吻合,Sun等報道TNF-α和TNF-α受體結合可后通過調節海馬的ERK活性與LTP介導劇烈運動后的認知功能障礙[11]。因此筆者推測TNF-α可以通過抑制軸突生成和通過調控ERK/CREB信號通路參與這一過程。
綜上所述,TNF-α可以下調大鼠海馬神經元中ERK/CREB蛋白表達,并可能通過這一信號通路參與疼痛導致的學習記憶下降。

