CPAP對重度OSAHS合并冠心病患者血脂代謝及HIF-1α的影響觀察
謝其華 林永平 廖建豐
三明市第二醫院呼吸與危重癥醫學科,福建省永安市 366000
研究認為,阻塞性睡眠呼吸暫停低通氣綜合征(Obstructive sleep apnea hypopnea syndrome,OSAHS)造成的反復缺氧、復氧可引起冠狀動脈中層平滑肌發生病變,進而推動動脈粥樣硬化的病理過程,增加冠心病(Coronary heart disease,CHD)的發生風險[1]。且其典型特征有反復發作的夜間低氧及高碳酸血癥,具有一定的潛在致死性,對患者生命安全構成不容忽視的威脅。持續正壓通氣(Continue positive airway pressure,CPAP)是一項常用于呼吸系統疾病治療的醫療手段,能有效改善患者通氣情況、緩解缺氧狀態[2]。血清缺氧誘導因子-1α(HIF-1α)是一種與缺氧及炎癥反應相關的轉錄因子,被證實在氧平衡調節中具有關鍵作用[3]。為進一步探究CPAP對OSAHS合并CHD患者血脂代謝及HIF-1α水平的影響,本研究選取60例重度OSAHS合并CHD患者進行研究,報道內容如下。
1 資料與方法
1.1 一般資料 選取2016年3月—2020年3月我科收治的60例重度OSAHS合并CHD患者作為觀察對象。納入標準:(1)符合中華醫學會關于重度0OSAHS的診斷標準[4];(2)呼吸暫停低通氣指數(AHI)≥30次/h;(3)符合CHD的診斷標準。排除標準:(1)既往曾行疾病相關手術;(2)合并其他心臟疾病;(3)合并其他呼吸系統疾病;(4)其他腫瘤或代謝性、免疫性疾病;(5)妊娠期、哺乳期女性;(6)近4周有抽煙、酗酒。根據數字隨機法分為觀察組及對照組,各30例。觀察組男17例、女13例,平均年齡(65.49±8.27)歲,平均CHD病程(4.32±1.74)年,平均左室射血分數(LVEF)(49.16±4.68)%,平均體重指數(BMI)26.73±3.49;對照組男19例、女11例,平均年齡(66.08±8.23)歲,平均CHD病程(4.59±1.69)年,平均LVEF(48.95±4.75)%,平均BMI 27.11±3.54。兩組一般資料比較差異無統計學意義(P>0.05)。
1.2 治療方法 兩組患者均予抗凝、擴血管等常規治療,包括阿司匹林抗凝、美托洛爾控制心室率、單硝酸異山梨酯片,擴張血管降脂藥物如阿托伐他汀類藥物治療、過度肥胖患者予以適當控制飲食、增加運動頻率、氧療和夜間側臥。觀察組患者在此基礎上增加每晚>4h的經鼻CPAP治療(儀器選用飛利浦偉康系統1557),治療壓力6~18cmH2O(1cmH2O=0.098kPa)。持續治療6個月。
1.3 觀察指標 (1)采用多導睡眠儀對患者進行7h以上的睡眠情況監測,統計呼吸暫停低通氣指數(AHI)、氧減指數(ODI)、最低血氧飽和度(LSaO2);(2)Epworth嗜睡量表(ESS)評價患者的白日嗜睡情況,總分24分,分值越高、嗜睡情況越嚴重,ESS評分>9分即可能存在嗜睡現象[5];(3)清晨空腹采血,利用全自動生化分析儀(儀器由上海聚慕醫療公司提供)測定總膽固醇(TC)、甘油三酯(TG)、低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL-C)含量;(4)酶聯免疫法(試劑盒由廣州菲康生物科技公司提供)測定血清缺氧誘導因子-1α(HIF-1α)及腫瘤壞死因子-α(TNF-α)水平;(5)統計治療期間所有患者心律失常、心肌梗死、心力衰竭等不良心血管事件發生率。

2 結果
2.1 多導睡眠儀檢測結果及ESS評分 治療前,兩組患者的AHI、ODI、LSaO2、ESS評分比較無統計學差異(P>0.05);治療后,兩組患者的AHI、ODI、ESS評分均下降,LSaO2均上升,且觀察組的AHI、ODI、ESS評分低于對照組,LSaO2高于對照組,差異有統計學意義(P<0.05)。見表1 。
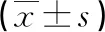
表1 兩組患者多導睡眠儀檢測結果及ESS評分比較
2.2 血脂代謝指標 治療前,兩組患者的TC、TG、LDL-C、HDL-C水平比較無統計學差異(P>0.05);治療后,兩組患者的TC、TG、LDL-C水平均下降,HDL-C水平均上升,且觀察組的TC、TG、LDL-C水平低于對照組,HDL-C水平高于對照組,差異有統計學意義(P<0.05)。見表2。

表2 兩組患者血脂代謝指標比較
2.3 炎癥水平 治療前,兩組患者的HIF-1α、TNF-α水平比較無統計學差異(P>0.05);治療后,觀察組的HIF-1α、TNF-α水平低于對照組,差異有統計學意義(P<0.05)。見表3。

表3 兩組患者炎癥水平比較
2.4 不良心血管事件發生情況 治療期間,觀察組患者的不良心血管事件發生率為3.33%,低于對照組的20.00%,差異有統計學意義(χ2=4.043,P=0.044<0.05)。見表4。

表4 兩組患者不良心血管事件發生情況比較[n(%)]
3 討論
OSAHS在我國人群中具有較高的發病率,OSAHS患者在睡眠狀態下可出現氣道阻塞現象,引起睡眠結構破壞、間歇性低氧、高碳酸血癥等多種癥狀,尤其是間歇性的低氧可刺激交感神經興奮性,放大氧化應激反應、炎癥反應,而過度堆積的活性氧和炎性因子在體內積聚,可影響脂質、核酸、蛋白質的合成,引起一系列合成和代謝異常,進一步造成氧代謝、脂質代謝、內皮功能的損傷和紊亂[6-7]。因此,OSAHS被認為是心血管損傷的危險因素。而間歇性的低氧對機體帶來的影響隨時間逐漸累積,使得累及部位的病變情況也隨之加重,血管管腔狹窄問題越發嚴重。因此,OSAHS合并CHD患者的治療中,單一的CHD藥物治療并不理想[8]。
CPAP是治療重度OSAHS的有效方法,通過將能產生壓力的小氣泵與鼻腔連接,在氣道中產生并保持一定壓力,防止睡眠過程中出現的氣道塌陷,避免再次出現呼吸暫停或低通氣現象,以達到改善低氧血癥、緩解白天嗜睡現象的治療目的[9],與本文治療后觀察組的AHI、ODI、ESS評分低于對照組,LSaO2高于對照組的結果相符。
HIF-1α是近年來研究熱度較高的轉錄因子,在各種哺乳動物由缺氧引起的各種特異性免疫應答中廣泛存在。大量資料證明,缺氧可使心肌缺血—再灌注過程中的早期適應性反應可使HIF-1α表達增加,而合并CHD的OSAHS患者在睡眠狀態下發生的間歇性低氧恰可導致患者心肌發生缺氧現象[10]。由此可見,HIF-1α水平可以作為評估OSAHS合并CHD患者心肌缺血、缺氧狀態的客觀指標。本文結果顯示觀察組的不良心血管事件發生率及HIF-1α、TNF-α水平低于對照組,提示患者的機體炎癥及心肌缺氧狀態有所改善,這可能與CPAP使用可以緩解甚至逆轉機體缺氧造成的交感神經興奮性異常現象,糾正心肌缺氧、改善缺氧所致的炎性因子異常有關[11]。聯合CPAP使用除了可以改善低通氣造成的各項病癥外,氧代謝恢復后,缺氧造成的脂質合成基因表達紊亂得以改善、脂質合成減少[12-13],與本文結果中觀察組的各血脂相關指標優于對照組相符。
綜上所述,采用CPAP治療可以幫助OSAHS合并CHD患者改善呼吸暫停、低通氣、白天嗜睡癥狀,及血脂及心肌損傷指標,降低不良心血管事件的發生率,具有較高的臨床參考價值。

