瘤胃源枯草芽孢桿菌BX1-12的篩選鑒定及其產酶抑菌活性
孫尹雙,陳甜甜,白冬紅,辛國芹,汪祥燕,徐海燕,谷 巍
(山東寶來利來生物工程股份有限公司,山東省動物微生態制劑重點實驗室,山東泰安 271000)
抗生素長期、大量使用,其弊端日益凸顯,例如:病原菌耐藥性的產生、畜禽腸道微生態紊亂及免疫力下降、抗生素殘留等,嚴重制約畜牧業的持續、健康發展,很多國家已經明確禁止使用飼用抗生素(竇茂鑫等,2013)。因此,尋找安全、有效的新型綠色飼料添加劑迫在眉睫。飼用微生態制劑作為飼料添加劑,一方面能夠通過產生復合酶系分解糖類、蛋白質、纖維素等物質,從而提高飼料利用率,同時還能維持動物腸道微生態的穩態,抑制病原菌的生長與繁殖,提升動物的免疫力等(Abd等,2020)。有研究表明,在日糧中添加微生態制劑不僅能夠提升豬的免疫力、生長性能,還能夠減少有害氣體的排放(Lei等,2014)。隨著研究的不斷深入,以有益微生物開發的動物微生態制劑已被養殖產業接受并廣泛使用(張增衛,2013)。
動物微生態制劑開發的核心是優良菌種的選育。理想的生產菌種應具備以下幾個特點:(1)安全性好,對宿主、環境無害;(2)能夠在消化道、腸道定植;(3)功能明確,能夠產生有益物質,如淀粉酶、蛋白酶、纖維素酶等;(4)能夠抑制病原菌;(5)穩定性好,加工及貯存過程中能夠保持活性(趙述淼,2009)。目前用于開發動物微生態制劑的菌種主要是芽孢桿菌(Bacillus)和乳酸菌(Lactobacillus)等。與其他類型的益生菌相比,芽孢桿菌由于其功能突出、抗逆性強、生產及貯藏性能好而具有廣闊的開發及應用前景(張新雄等,2013)。本研究以健康高產奶牛瘤胃液為篩選源,旨在篩選出產酶性能和抑菌性能優良的菌株,為飼用芽孢桿菌奶牛微生態制劑的研究和開發提供科學依據和菌種資源。
1 材料與方法
1.1 材料
1.1.1 瘤胃液的采集 于晨飼前從健康高產奶牛采集瘤胃液,通過4層紗布過濾,置于39℃保溫瓶中,立即蓋嚴瓶口并轉移至實驗室保溫存放。
1.1.2 培養基NA(Nutrient Agar)固體培養基:蛋白胨1%,牛肉粉0.3%,氯化鈉0.5%,瓊脂1.5%~2%,pH 7.0~7.2,121℃滅菌20 min。LB(Luria-Bertani)液體培養基:蛋白胨1.0%,氯化鈉0.5%,酵母膏0.5%,pH 7.0~7.2,121℃滅菌20 min。大豆胰蛋白胨瓊脂培養基(TSA):胰蛋白胨1.5%,大豆胨0.5%,氯化鈉0.5%,瓊脂1.3%,pH 7.3~7.5。
1.1.3 供試病原菌 大腸桿菌(Escherichia coli)、金黃色葡萄球菌(Staphylococcus aureus)和傷寒沙門氏菌(Salmonella trphimurium)均由山東省動物微生態制劑重點實驗室保藏并提供。
1.2 方法
1.2.1 瘤胃液中芽孢桿菌的分離 將新鮮瘤胃液取出后充分混勻,吸取10 mL置于裝有90 mL無菌水的錐形瓶中,80℃水浴15 min殺滅非芽孢菌;按照梯度稀釋法將加熱處理后的瘤胃液稀釋至10-7;分別吸取10-4、10-5、10-6、10-7稀釋液均勻涂布于NA固體培養基表面,每個稀釋度3個平板。37℃培養24 h后,根據菌落形態特征區分,挑取形態差異的單菌落進行純化并保藏(Wang等,2021)。
1.2.2 產酶活性測定 纖維素酶活測定:采用CMC糖化力法對各菌株發酵液中纖維素酶活力進行測定(李蘭曉等,2006)。纖維素酶活力單位定義為1 mL酶液在40℃、pH 4.6條件下,每分鐘水解羧甲基纖維素鈉(CMC-Na)產生1.0 μg葡萄糖,即為1個酶活力單位,以U/mL表示(蛋白酶活力測定法SB/T 10317-1999)。試驗重復3次,每次3個平行。
蛋白酶活力測定:測定方法參照中華人民共和國專業標準SB/T10317-1999中的福林法(蛋白酶活力測定法SB/T 10317-1999)。酶活定義單位為1 min水解酪蛋白產生1 μg酪氨酸的酶量為一個酶活力單位(U/mL)。試驗重復3次,每次3個平行。
α-淀粉酶活力測定:參照測試盒使用說明書(C106-1-1,南京建成生物工程研究所)采用淀粉-碘比色法測定各菌株的α-淀粉酶活力。酶活單位定義為100 mL上清液中的淀粉酶,在37℃與底物作用30 min,水解100 mg淀粉為1個單位(U/100 mL)。
1.2.3 抑菌活性測定 病原菌指示菌菌液制備:取斜面保存的大腸桿菌、金黃色葡萄球菌和傷寒沙門氏菌于NA固體培養基劃線,37℃活化12 h;挑取單菌落接種至裝有50 mL LB液體培養基的錐形瓶中經37℃、180 r/min振蕩培養24 h;通過稀釋涂布法計數并將各病原指示菌的濃度調節為1×107cfu/mL,4℃保存備用。
芽孢桿菌發酵上清液的制備:取斜面保存的芽孢桿菌菌株于NA固體培養基劃線,37℃活化12 h;挑取單菌落接種至裝有50 mL LB液體培養基的錐形瓶中經37℃、180 r/min振蕩培養12 h制備種子液;按1%體積的接種量接種于裝有50 mL的LB液體培養基的錐形瓶中經37℃、180 r/min振蕩培養24 h制備發酵液;發酵液經4℃、12000 r/min離心10 min后棄去菌體,吸取上清液過0.22 μm無菌濾膜后4℃保存備用。
抑菌試驗:分別吸取100 μL各病原指示菌菌液,均勻涂布于NA固體平板上;用無菌鑷子將牛津杯放置在平板上;向牛津杯中加入200 μL發酵上清液,處理完成后小心將平板轉移至37℃培養箱內靜置培養24 h后測量抑菌圈直徑。以無菌LB液體培養基為空白對照,試驗共重復3次,每次3個平行。
1.2.4 菌種鑒定 菌株的生理生化采用Biolog-GEN-III微孔板法進行鑒定:將與NA固體培養基活化12 h的菌株接種于TSA固體培養基,33℃培養16 h后用無菌一次性棉簽沾取單菌落接種于IF-B接種液中,攪拌均勻并用濁度計調節細胞濃度為90%~98%T。將菌懸液倒入無菌的V型槽中,并用移液器轉移至微孔板,每孔100 μL。將微孔板在33℃培養24 h后,采用MicroStation自動微生物鑒定分析系統分析菌株生理生化特征并于標準菌株數據庫進行比對(Li等,2019)。分子生物學鑒定:將菌株于NA固體培養基活化12 h后,挑取單菌落接種至LB液體培養基中,37℃、180 r/min振蕩培養12~16 h后獲得菌懸液。參照試劑盒(CW0552,康為世紀)使用說明收集菌體并提取細菌基因組DNA。以提取的基因組DNA為模板,采用細菌16S rRNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)及1492R(5′-ACGGCTACCTTGTTACGCTT-3′)進行擴增,引物由上海生工生物工程股份有限公司合成(王建宇等,2021)。擴增體系為25 μL,其中基因組DNA模板2 μL,上下游引物(10 μM)各1 μL,2×Easy-TaqRPCR SuperMix(AS111,北京全式金生物)12.5 μL,ddH2O 8.5 μL。擴增程序為:95℃預變性5 min;94℃變性30 s,50℃退火30 s,72℃延伸90 s,共34個循環;72℃再延伸10 min。PCR產物經純化后委托上海生工生物工程股份有限公司完成測序,將獲得的序列在NCBI上BLAST比對并用Mega 6.0軟件進行聚類分析,采用鄰接法構建系統發育樹,重復1000次進行自展值分析(王建宇等,2021)。
2 結果
2.1 菌種篩選 通過純培養的方法,根據菌落形態區分,結合菌體產芽孢的鏡檢結果,從健康奶牛瘤胃樣品中共分離獲得22株芽孢桿菌,編號如表1所示。
2.2 產酶活性 對分離得到的22株芽孢桿菌的產酶活性進行了測定,結果表明具有產纖維素酶活性的菌株有15株,產蛋白酶活性的菌株有17株,所有分離菌株均有產淀粉酶活性,能夠同時產三種酶的菌株有12株;其中芽孢桿菌BX1-12產酶活性最高,其纖維素酶、蛋白酶及淀粉酶活性分別為27.33、137.54 U/mL以及1450.53 U/100 mL(表1)。
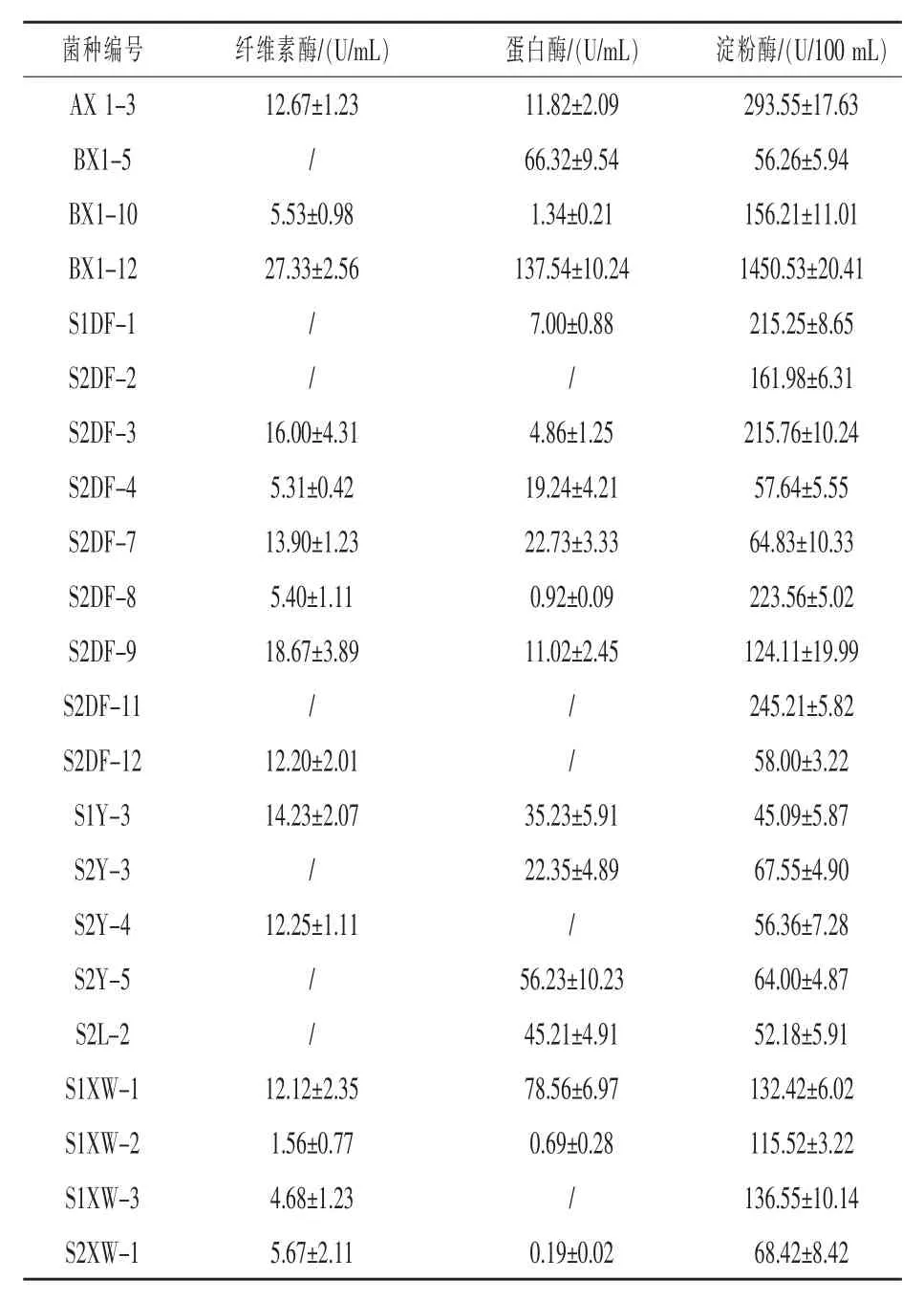
表1 22株芽孢桿菌產酶活性
2.3 抑菌活性 由表2可知,22株芽孢桿菌均具有一定的抑菌活性,能夠抑制大腸桿菌的菌株有12株,其中S2Y-5活性最強,抑菌圈直徑為18.02 mm;13株菌具有拮抗金黃色葡萄球菌活性,15株菌能夠抑制傷寒沙門氏菌,其中芽孢桿菌BX1-12對兩種病原菌的抑制活性最強,抑菌圈直徑分別為23.21、25.97 mm。此外,BX1-12對大腸桿菌也具有抑制效果,表現出廣譜的抗菌性。
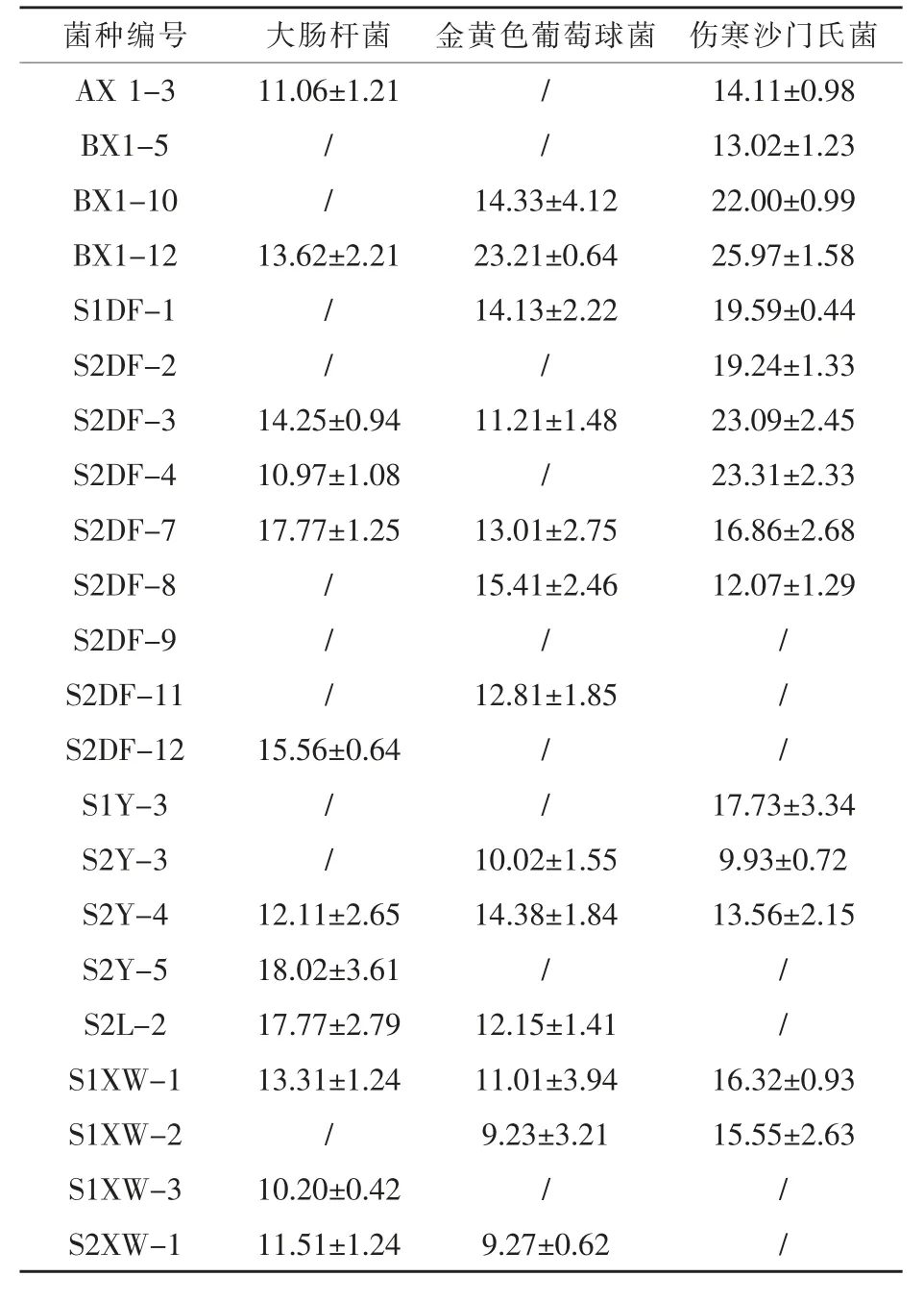
表2 22株芽孢桿菌對三種病原指示菌的抑菌圈直徑mm
2.4 芽孢桿菌BX1-12鑒定
2.4.1 生理生化鑒定 綜合產酶及抑菌活性,對菌株BX1-12進行了系統鑒定。部分Biolog生理生化實驗結果如表3所示,該菌株能夠利用蔗糖、糊精、D-纖維二糖、D-半乳糖、龍膽二糖、L-天冬氨酸等生長因子;化學敏感試驗中,菌株能夠耐受四唑紫、溴酸鈉、1%乳酸鈉、氯化鋰、4% NaCl等物質。經Biolog-GEN-III微孔板法鑒定,該菌與枯草芽孢桿菌(Bacillus subtilis)相似度最高。
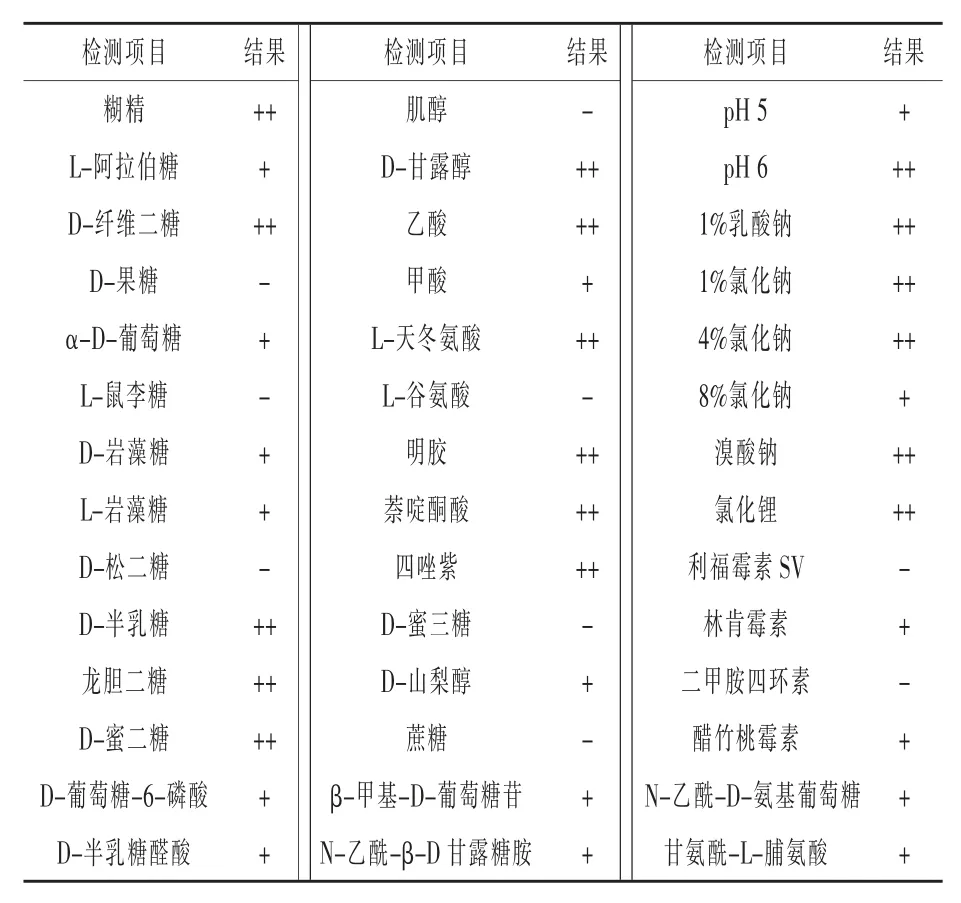
表3 芽孢桿菌BX1-12生理生化測定結果
2.4.2 分子生物學鑒定 將菌株BX1-12 16S rRNA序 列在NCBI(https://www.ncbi.nlm.nih.gov/)上進行同源性比較并構建了菌株的Neighbor-Joining進化樹。結果如圖1所示,該菌與枯草芽孢 桿 菌 (Bacillus subtilis)DSM 22148T(HE582781)同源性為97%。結合Biolog生理生化特性,該菌株經鑒定為枯草芽孢桿菌。
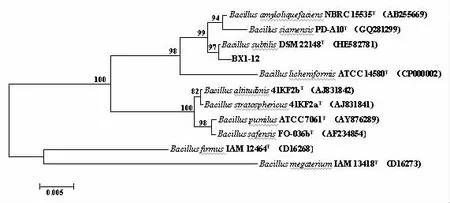
圖1 基于16S rRNA序列采用鄰接法構建菌株BX1-12以及其他相關菌株的系統進化樹
3 討論
芽孢桿菌是自然界中常見的一種微生物,由于其抗逆性強、功能多樣、產業化性能好等優點廣泛應用于養殖業、種植業等領域(龔慧等,2014)。目前,常見的作為飼料添加劑使用的芽孢桿菌的種類主要有枯草芽孢桿菌、凝結芽孢桿菌、地衣芽孢桿菌、短小芽孢桿菌、遲緩芽孢桿菌等,其中枯草芽孢桿菌是目前研究、應用最多的菌種之一,同時也是農業農村部許可使用的安全菌株(成廷水等,2012)。例如,林顯華等(2013)發現在飼料中添加枯草芽孢桿菌B7能夠使肉雞增重,并改善肉雞機體免疫力。
雖然枯草芽孢桿菌的功能在養殖業中已得到廣泛認可,但多集中在雞和豬的應用上,在反芻動物養殖上的研究相對較少(郝生宏等,2015)。此外,動物微生態制劑能否發揮作用很大程度上取決于其在動物胃腸道中的定植量,而宿主的生理條件通常會影響菌種的增殖(張新雄等,2013)。基于此,本研究以原位篩選為原則,從健康奶牛瘤胃液中共分離得到22株芽孢桿菌,為奶牛用微生態制劑開發積累了重要的菌種資源。
飼用微生態制劑主要的功能之一是能夠合成并分泌纖維素酶、淀粉酶、蛋白酶等酶類,從而促進飼料的消化吸收,減少畜禽因消化不良引起的腹瀉,此外,功能菌種還能夠抑制病原菌,提升畜禽的抵抗力(張吉鹍等,2019)。本研究系統評價了22株芽孢桿菌的產酶、抑菌活性并從中發現一株枯草芽孢桿菌BX1-12,該菌具有高產酶活及廣譜抑菌活性,應用潛力較好,因此如何將該菌開發成為飼用微生態制劑是后續研究的重點。
4 結論
本試驗以健康高產奶牛瘤胃液為研究對象,以產酶(纖維素酶、α-淀粉酶、蛋白酶)、抑菌(大腸桿菌、金黃色葡萄球菌、傷寒沙門氏菌)活性為評價指標,獲得了一株能夠高效產酶及廣譜抑菌的芽孢桿菌,編號為BX1-12,經鑒定該菌為枯草芽孢桿菌,并為飼用芽孢桿菌奶牛微生態制劑的研究和開發提供科學依據,積累了寶貴的菌種資源。

