基于UHPLC-MS/MS的藥用植物內源性激素含量檢測方法及黃花蒿不同器官激素的測定*
李姝諾,高守紅,陳軍峰,陳 梟,崔莉莉,劉艷平,陳萬生,**
(1. 上海中醫藥大學中藥研究所中藥資源與生物技術中心 上海 201203;2. 海軍軍醫大學附屬長征醫院 上海 200003)
植物激素是指植物通過自身代謝產生、在低濃度下就能產生明顯生理效應的有機信號分子。目前植物激素主要包括茉莉素、生長素、水楊酸、細胞分裂素、油菜素甾醇、赤霉素(Gibberellins, GAs)、脫落酸、乙烯、獨腳金內酯及多肽類激素[1]。植物激素不僅在調節植物生長發育以及抵抗外界脅迫中起著關鍵作用[2-4],在植物合成次生代謝產物方面也發揮著重要作用[5],因此,研究植物組織中內源性植物激素含量的測定技術具有重要意義。部分植物激素具有不穩定性、對介質溫度和周圍環境敏感的特點[6],從植物中檢測出痕量激素的含量、種類存在挑戰[7],在方法學上主要體現在提取、純化和檢測3 個方面。目前應用最廣泛的提取方法是溶劑提取法,甲醇因其較強的滲透性可以滲透到植物細胞中,是植物激素提取的首選溶劑[8]。在純化方面主要有液液萃取、固相萃取及免疫純化三種方式,其中固相萃取極大的簡化了植物激素的前處理過程,應用較廣泛的主要包括反相C18柱、Oasis HLB柱、混合模式柱等[9-10]。在檢測分析方面有免疫分析、電化學分析以及色譜質譜聯用等方法[9],在本文中構建的植物激素檢測方法采用的是常用的色譜質譜聯用的檢測方式。
青蒿為菊科蒿屬一年生草本植物黃花蒿(Artemisia annuaL.)的干燥地上部分,青蒿味苦、辛,性寒,具有清熱解毒的功效[11]。黃花蒿特異生成的青蒿素在瘧疾治療中發揮著核心作用[12]。青蒿素的合成累積發生在青蒿葉片的分泌性腺毛中,多種植物激素被發現對青蒿素的生物合成途徑具有調控作用[13-14],還可直接或間接調控腺毛的發育[15],又或是建立不同激素信號通路間的調控網絡,如生長素可抑制黃花蒿中赤霉素甲基-D-赤蘚醇磷酸鹽(2-c-methyl-derythritol 4-phosphate,MEP)合成途徑的關鍵酶1-脫氧-D-木酮糖-5-磷酸還原異構酶(1-deoxy-Dxylulose-5-phosphate reductoisomerase,DXR),使得青蒿素在開花期、營養期的產量降低,進而影響青蒿素的產量[16]。可見,激素的調控作用是青蒿素合成途徑及黃花蒿生長發育機制的重要方向,然而,如何對黃花蒿中種類眾多的激素實現高效精準的檢測成為了相關研究的技術瓶頸。
本研究以黃花蒿為例,旨在盡量減少前處理過程時間的同時檢測在青蒿素合成中起重要作用的相關內源性植物激素。目前,國內發表的植物激素檢測方法所檢測到的種類大多較少,如基于高分辨率質譜技術對于微藻胞間植物激素的檢測共測定到6種植物激素[10];朱莉莉等人基于HPLC-MS/MS 技術同時測定植物6種內源激素[17];賈鵬禹構建了在大豆中4種植物激素的檢測方法[18]。近來于國外發表的植物激素檢測的方法所檢測到的激素種類繁多,但前處理過程存在時間較長或是操作較為繁瑣的待改進之處[19-20]。據此,本研究通過比較優化不同的提取純化方式,構建了可同時測定16 種植物內源性激素的UHPLC-MS/MS 檢測方法,并以此方法對青蒿的根、莖和葉的內源性激素水平進行精確定量。
1 材料
1.1 儀器
Agilent 1290-6460A 超高效液相色譜-串聯質譜儀,包括G4220A 二元高壓泵、G4226A 自動進樣器、G1330B 控溫箱、G1316C 柱溫、Mass Hunter 數據處理工作站B.06.00(美國Agilent公司);BSA124S-CW 型天平、CPA225D 型天平(德國Sartorius 公司);Eppendorf Centrifuge 5430 R 離心機(德國Eppendorf 公司),多樣品自動濃縮儀(上海力德生物科技有限公司),超聲儀(上海科導超聲儀器有限公司),多樣品冷凍研磨儀(上海萬柏生物有限公司),Waters 固相萃取儀(美國Waters公司)。
1.2 試劑與材料
質譜級甲醇和乙腈(MERCK 德國),甲酸(國藥集團化學試劑有限公司),標準品及內標見表1,Waters HLB 6cc(200 mg)固相萃取小柱,Waters WAX 3cc(60 mg)固相萃取小柱,Waters WCX 3cc(60 mg)固相萃取小柱。黃花蒿(上海交通大學滬蒿1號)。
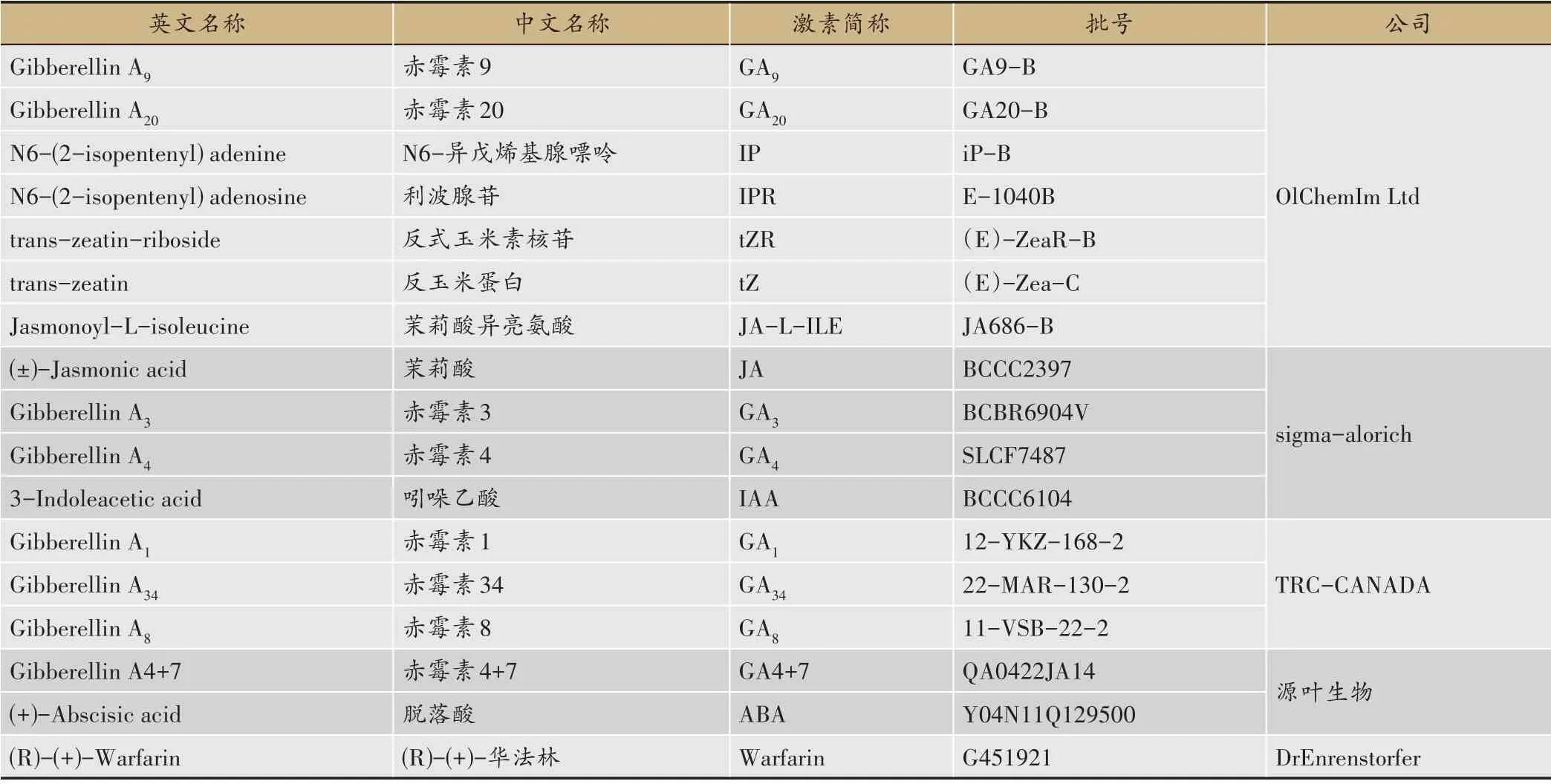
表1 標準品信息
2 方法
2.1 標準品配制
分 別 精 密 稱 取GA1、GA3、GA4+7、GA4、GA8、GA9、GA20、GA34、ABA、IAA、IPR、IP、tZR、tZ、JA-L-ILE、JA標準品及內標華法林約5.00 mg,置于5 mL 容量瓶中,用質譜級甲醇溶解定容,即得1.00 mg·mL-1標準品及華法林的甲醇溶液,分裝放置-20℃保存備用,使用時用甲醇稀釋上述標準品貯備液配置成混合標準品溶液,GA1、GA3、GA4+7、GA4、GA9、GA34、ABA、IPR、JA 濃度為50 ng·mL-1,GA8濃度為100 ng·mL-1,tZ、IAA、GA20濃度 為200 ng·mL-1,IP 濃度 為2 ng·mL-1,tZR 濃 度為210 ng·mL-1,JA-L-ILE 濃度為20 ng·mL-1。華法林使用時以50%乙腈稀釋儲備液至200 ng·mL-1。
2.2 前處理方法優化
在植物激素提取方面,?imura J 等人經過詳盡的考察提出50%乙腈提取效果好,并采取4℃過夜提取,而構建植物激素檢測方法不僅要保證在提取純化過程中保持低溫狀態,還要使得整個樣品制備的時間盡量縮短[21],因此本文考察了50%乙腈分別4℃過夜提取及4℃超聲提取1 h 的植物激素提取方式,根據檢測的峰面積結果,最終確定50%乙腈4℃超聲提取1 h 的提取方式。
通過比較不同純化方式[19-20]對純化方式繼續優化,通過比較回收率選定更高回收率的純化方式。取新鮮植物待測組織,用清水沖洗干凈,于液氮中速凍,稱取200 mg 速凍樣品于離心管中,加入2 顆小鋼珠與1 mL 冰浴的50%乙腈水(含有200 ng·mL-1的華法林)溶液,用多樣品冷凍研磨儀充分研磨。研磨后的樣品渾濁液冰浴超聲1 h。樣品經過超聲提取后,用高速離心機在4℃下12 000 r·min-1離心30 min。離心后,將上清液吸入新的離心管中備用。
2.2.1 HLB固相萃取小柱純化方式
依次用2 mL 純甲醇,2 mL 超純水,2 mL 50%乙腈水溶液通過HLB 固相萃取小柱(200 mg,6 cc),活化并平衡萃取小柱。將樣品上清液加入固相萃取小柱,分三次加入3 mL 30%乙腈水溶液進行洗脫。將樣品上清流出液與洗脫液合并后4℃氮氣吹干后,于200 μL 30%乙腈水溶液復溶。
2.2.2 WCX與WAX固相萃取小柱純化方式
用2 mL 純甲醇、2 mL 超純水、2 mL 50%乙腈水溶液依次通過WCX和WAX固相萃取小柱對其進行活化平衡。將樣品上清液加入固相萃取小柱后用1.2 mL 90%甲醇進行洗滌。至此,將WCX 和WAX 萃取小柱分離。WAX 萃取小柱用2 mL 5%甲酸水溶液洗滌,1.5 mL 甲醇洗脫IAA、ABA、JA、GAs;WCX 萃取小柱依次用1.5 mL 含有2%甲酸的5%甲醇、1.5 mL 5%甲醇、1.5 mL 甲醇洗滌,最后用1.5 mL 含有5%氫氧化銨的80%甲醇洗脫細胞分裂素(cytokinin,CKs)。將兩種含有不同成分的洗脫液分別在4℃下用氮氣吹干。用200 μL 40%甲醇水溶液對WAX 萃取小柱的洗脫部分進行復溶,用200 μL 20%甲醇水溶液對WCX 萃取小柱的洗脫部分進行復溶。
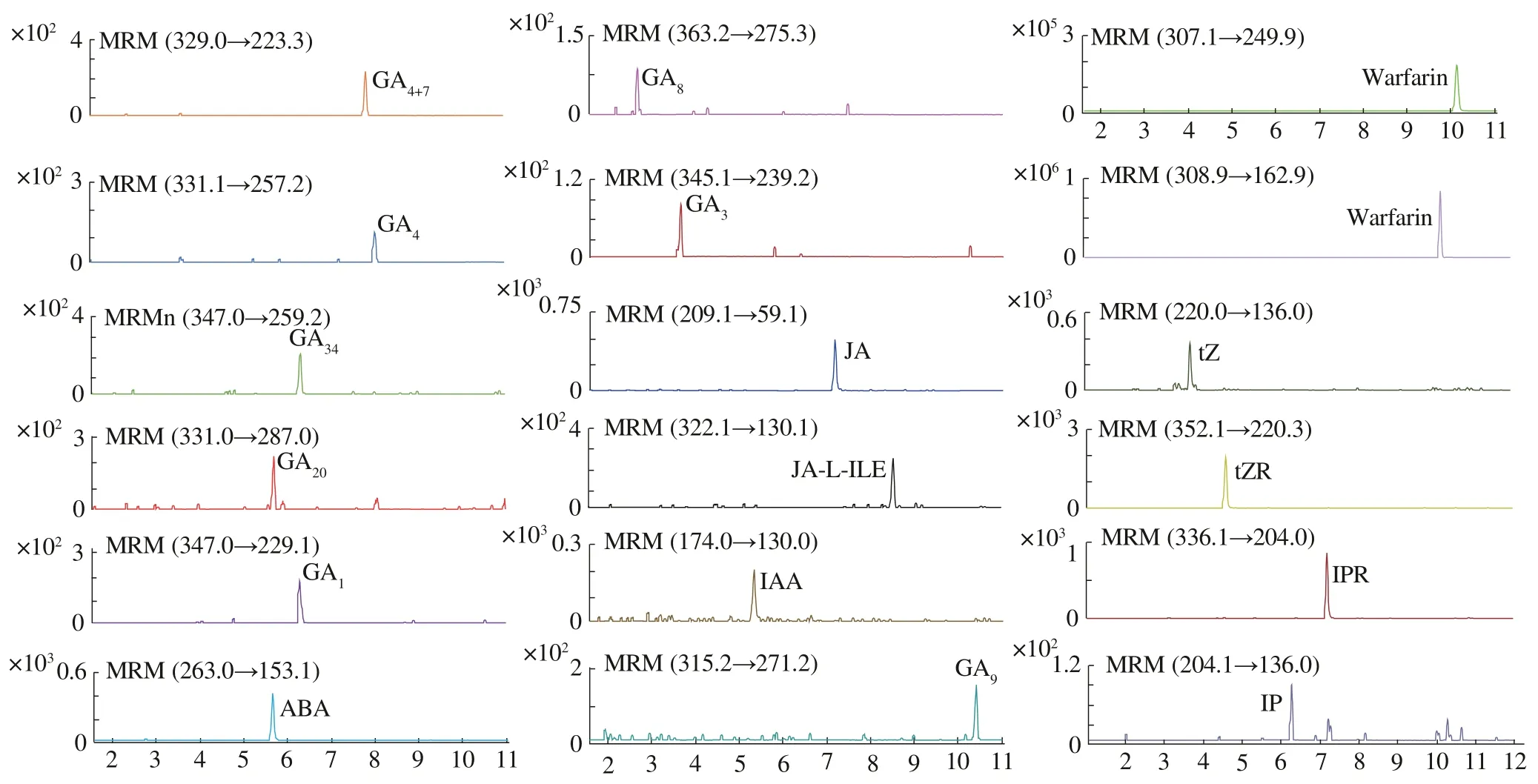
圖1 混合標準品MRM色譜圖
2.3 色譜-質譜條件
2.3.1 色譜條件
分 別 考 察Agilent Eclipse XDB-C18(3.5 μm,2.1 mm×150 mm)、Agilent ZORBAX SB-C18(3.5 μm,2.1 mm×100 mm)、Agilent ZORBAX SB-CN(3.5 μm,2.1 mm×100 mm)、Agilent ZORBAX Eclipse plus C18(3.5 μm,2.1 mm×100 mm)、Agilent Poroshell 120 EC-C18(2.7 μm, 3.0×150 mm)、Agilent Poroshell 120 EC-C18(2.7 μm, 4.6×100 mm)、Agilent Poroshell 120 SB-C18(2.7 μm, 2.1×75 mm)、Waters XbridgeTMHILIC(3.5 μm,2.1 mm×100 mm)、Waters Amide?(3.5 μm,2.1 mm×100 mm)色譜柱對16 個待測成分含量測定的影響,當色譜柱為Agilent Poroshell 120 EC-C18(2.7 μm, 3.0×150 mm)時,16 個待測成分和內標的峰形以及分離度最佳;分別考察水-乙腈、0.05%甲酸-乙腈、0.1%甲酸-乙腈、2mM 醋酸銨-乙腈、5mM 醋酸銨-乙腈、0.05%甲酸-甲醇流動相對16 種成分含量測定的影響,最終確定采用0.05%甲酸(A)-乙腈(B)梯度洗脫的響應及峰形較好;16種植物激素分正負兩套方法分開進行梯度洗脫,負離子模式:0-11 min,73%-23%A;體積流量為0.3 mL·min-1;正離子模式:0-8 min,95%-59% A;8-8.05 min,59%-5% A;8.05-12 min,5%A;流速為0.4 mL·min-1;柱溫35℃(正/負離子模式);樣品盤溫度4℃;進樣量10 μL。
2.3.2 質譜條件
電噴霧離子源(electrospray ionization,ESI);多反應檢測模式(multiple reaction monitoring,MRM);離子化電壓為4500 V(正/負離子模式),脫溶劑氣溫度350℃,脫溶劑氣體積流量為12 L·min-1,噴霧氣壓為45 psi;數據處理用儀器所配定量軟件進行分析,各種激素的質譜參數見表2。

表2 16種植物激素的多反應監測優化參數
2.4 方法學考察
2.4.1 專屬性
分別精密取植物樣品溶液和標準品的混合溶液、對照品溶液以及空白溶劑10 μL 進行專屬性檢測分析。
2.4.2 線性范圍及定量下限
按照“2.1”的方法配制混合標準品溶液,加甲醇稀釋制成14 種濃度梯度的標準曲線工作溶液。混合標準品標準曲線工作溶液由低到高記為Q1-Q14,GA8使 用Q6-Q12,GA1、GA3、GA4+7、GA20、GA34、JA、ABA、IAA、tZ 使用Q3-Q14,GA4、GA9、JA-L-ILE 使用Q6-Q14,tZR 使用Q1-Q12,IP、IPR 使用Q1-Q14,按上述色譜質譜條件進行分析,并用儀器所配定量軟件計算各化合物濃度的線性回歸方程。
2.4.3 加樣回收率
取植物樣本經“2.2”項下方法提取,提取上清液混合后分成12 份500 μL,取“2.1”項下配制的混合標準品,分別稀釋成高、中、低三組不同濃度標品工作液各3 份,每份500 μL。將植物激素提取上清液和混合標準品的混合液以及植物激素提取上清液分別經過“2.2.1”項下條件處理并將測定的含量分別記為S 和S1,未經處理的混合標準品測定的含量記為S0,計算回收率R=(S-S1)/S0*100%。
2.4.4 穩定性
同一植物樣本不能涵蓋所有內源性植物激素[22-23],故在此采用混合標準品進行考察穩定性。取高、中、低三種濃度的標準品溶液各3 份,分別放置0 h,6 h,12 h 后測定其穩定性。計算各組穩定系數(以RSD表示),以考察分析方法的穩定性。
2.4.5 精密度
取高、中、低三種濃度的混合標準品溶液各一份,按照“2.3”項下條件分別連續進針6 次。計算16 種植物激素峰面積的RSD值,以考察日內精密度。
2.4.6 重復性
取同一份植物樣品溶液(6 個植物樣本分別經提取后混合成1份植物樣品溶液),與混合標準品溶液混合后按“2.2.1”項下方法平行制備6 份,按“2.3”項下質譜與色譜條件進行測定,通過峰面積計算RSD。
2.5 黃花蒿不同器官植物激素含量的測定
分別取上海黃花蒿新鮮根、莖、葉,其中重點關注的莖和葉各取三批植物樣本,每批植物樣本分別取三個生物學重復樣品,根取三個生物學重復,參照“2.2.1”項下方法進行激素提取并參照“2.3”項下方法進行檢測。
3 結果
3.1 純化方式的優選
參照“2.2”項下方法考察兩種固相萃取方法的回收率,利用HLB 固相萃取小柱純化方式的回收率為52.54%-105.39%,利用WCX-WAX 固相萃取小柱純化方式的回收率為22.64%-82.99%,HLB 固相萃取小柱純化方式的回收率在50%以上,回收率良好。根據考察結果最終選用回收率更高,用時更短的HLB 固相萃取純化的方法(表3)。

表3 兩種純化方式回收率比較(n=3)
3.2 方法學考察
3.2.1 專屬性
參照“2.4.1”方法對16 種植物內源性植物激素進行方法專屬性考察,混合標準品的色譜圖見1。負離子模式下共檢測12 個植物內源性激素,共需11 min,各內源性激素及內標化合物在檢測過程中不存在明顯干擾,分離度良好;正離子模式下共檢測4個植物內源性細胞分裂素,在8 min 時完成細胞分裂素的檢測,因內標化合物的檢測,共需12 min,各內源性激素及內標化合物在檢測過程中分離度良好,表明該方法專屬性良好[24]。
3.2.2 線性范圍及定量下限
參照“2.4.2”的方法進行線性范圍及定量限的考察,16種測定的植物激素的濃度與峰面積呈良好的線性關系[24],r值均大于0.99(表4)。
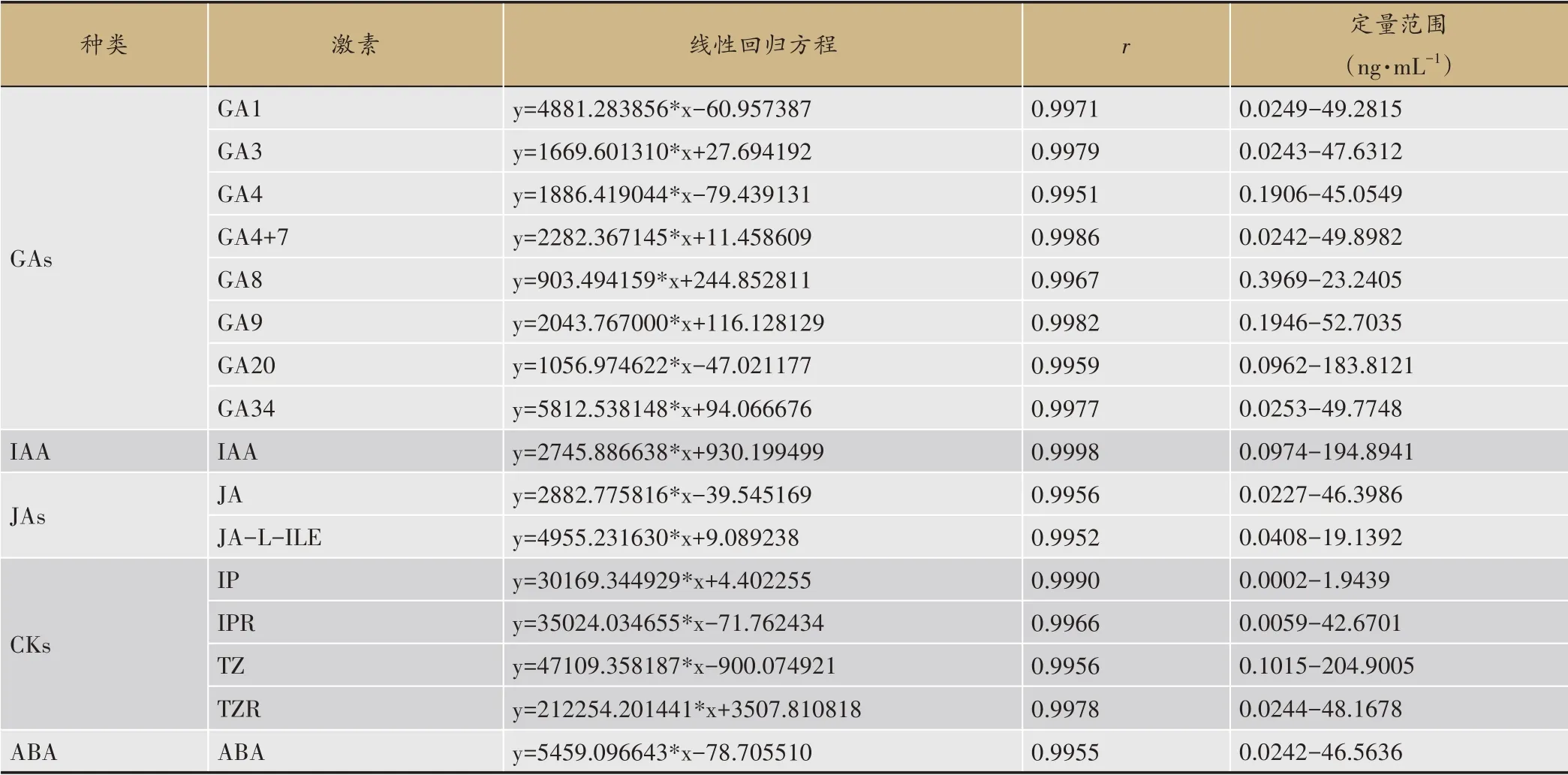
表4 各植物激素檢測線性及定量下限
3.2.3 加樣回收率
參照“2.4.3”的方法進行加樣回收率的考察,通過計算12 個內源性激素的回收率在70.97%-113.77%,其中IAA 和tZ 的回收率分別在中濃度時為61.53%和高濃度時為52.76%,GA9和IP 的回收率在52.04%-66.55%之間,回收率均在50%以上(表5),該方法回收率良好[19]。
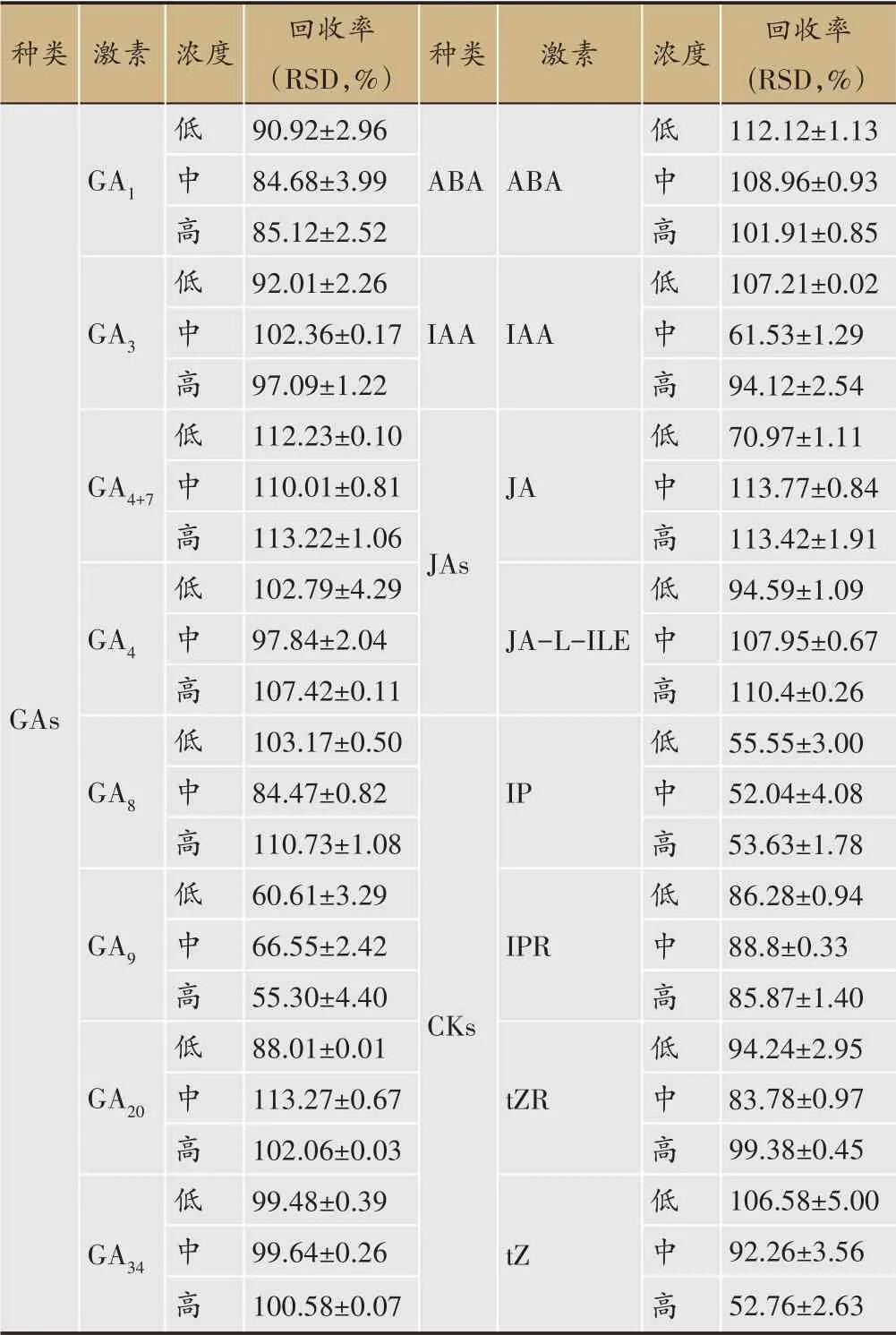
表5 16種植物激素加樣回收率(n=3)
3.2.4 穩定性
參照“2.4.4”的方法,分別在0 h,6 h,12 h 進行穩定性考察,6h時各內源性激素的穩定性范圍在3.06%-13.60%,12 h時各內源性激素的穩定性范圍在5.16%-14.89%。RSD 值均小于15%(表6),表明該方法穩定性良好[25]。

表6 16種植物激素的穩定性與精密度

續表
3.2.5 精密度
參照“2.4.5”進行日內精密度的考察,日內精密度RSD 值見表6,RSD 值范圍在0.81%-11.35%,均小于12%,表明儀器精密度良好[25]。
3.2.6 重復性
結果顯示,GA1、GA3、GA4+7、GA4、GA8、GA9、GA20、GA34、ABA、IAA、IPR、IP、tZR、tZ、JA-L-ILE、JA 16種化學成分的峰面積RSD 分別為4.08%、2.09%、2.79%、1.57%、5.27%、6.31%、1.27%、2.62%、1.58%、3.87%、1.42%、8.10%、2.67%、8.31%、1.58%、3.99%,表明該方法重復性良好[24]。
3.3 黃花蒿不同器官植物激素含量的測定
取黃花蒿的新鮮根、莖、葉器官利用上述方法進行激素檢測,在不同器官中共檢測到8 種激素(圖2),并且呈現顯著的含量差異(圖3)。所有檢測到的激素濃度范圍在0-38 ng·mg-1,與已知的植物中激素含量水平相近[17,26],進一步證明本檢測方法的準確性。結合所測葉與莖的三批樣本平均值與根的三個生物學重復樣品平均值,所有激素在樣本中的含量水平檢測結果表明IAA 在根中含量最高;ABA、IPR、tZ、JA、JAL-ILE 在葉中含量最高;tZR、IP 在莖中含量最高。各批次青蒿莖與葉中的激素含量與根中的激素含量相比,其差異結果見圖3。結果顯示不同批次中各激素含量水平差異較大,這可能與樣本采集時的發育階段相關,第一批樣本采集時期為青蒿苗期階段,第二批和第三批樣本為青蒿成熟時期采集。

圖2 青蒿不同器官激素檢測色譜圖
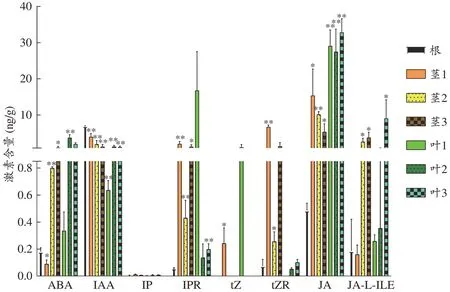
圖3 青蒿不同器官激素含量(±s,n=3)
4 討論
樣品提取是開展植物內源激素檢測的最關鍵步驟。由于植物激素本身在細胞內累積水平極低,需要對樣品進行富集才能達到檢測濃度。目前,植物激素的純化主要有液液萃取、固相萃取及免疫純化三種方式,本研究主要考慮了固相萃取及液液萃取。利用液液萃取時,植物激素純化效率不高且難以克服乳化現象[27-28],故采取固相萃取的方式進行純化。植物樣品的純化多使用C8、HLB、MCX、WAX、MAX 等固相萃取柱的單用和聯合使用[19-20,29-31]。我們通過對HLB 單用及WCX、WAX 聯用兩種方法進行比較優化,根據考察結果選用HLB 固相萃取純化的方法。對于分析條件方面,本實驗分別采用了負、正離子掃描模式對單個植物激素標準品的質譜響應進行初步考察,結果表明GA1、GA3、GA4+7、GA4、GA8、GA9、GA20、GA34、ABA、IAA、JA、JA-L-ILE 在負離子模式下靈敏度高;IP、IPR、tZR、tZ 在正離子模式下靈敏度高;分別進行了流動相和色譜柱的考察,結果表明流動相0.05%甲酸-乙腈梯度洗脫,色譜柱為Agilent Poroshell 120 EC-C18 (2.7 μm,3.0×150 mm)時待測成分的響應及峰形較好、分離度最佳。
與已報道的以作物為研究對象的植物內源檢測方法相比[28],本研究針對藥用植物的激素提取方法和激素種類,增加了茉莉酸的活性形式JA-L-ILE 以及更多的赤霉素種類(表2),與已發表的植物內源激素檢測方法相比,本方法對前處理過程進行了精簡[19-20],經過色譜條件優化,可以在相對較短的進樣時間檢測更多地激素種類[10,17-18,26]。本研究在所有青蒿器官中共檢測到了8 種內源激素,而非方法中所包含的16 種,該結果不能說明黃花蒿中不含有這些激素,可能由于低于本方法的檢測限而未檢測到;此外,這些激素也可能具有更特異的器官、組織特異性,或是需在特點的生長周期及特定誘導環境下才會累積[28],這需要我們對更多的發育階段的不同組織、器官的樣本進行檢測,才能構建完整的黃花蒿內源激素分布的代謝圖譜。
綜上,以黃花蒿為例,我們建立了一種對植物中內源激素進行精確定量的方法。利用該方法,我們還對丹參、擬南芥等藥用和模式植物進行了激素含量測定,均有較好結果,表明該方法檢測性良好、適用性廣泛。通過對植物內源性激素的檢測可輔助研究植物生長發育的過程[32-33]及受到外界脅迫的調控機制[34-35],為進一步探究植物的生長發育及次生代謝產物的合成提供了手段。