珊瑚菜抗鹽相關基因GlERF11克隆與鹽脅迫表達分析*
徐 瑤,任宏偉,孫唯航,張馨方,田雪梅,譚玲玲,袁 濤,高 婷**
(1. 青島農業大學生命科學學院/山東省高校植物生物技術重點實驗室 青島 266109;2. 青島農業大學建筑工程學院 青島 266109)
藥用植物在遭受外界的生物脅迫與非生物脅迫時,其體內的代謝水平會發生變化,包括初生代謝與次生代謝兩方面[1]。代謝產物在植物細胞的液泡中進行累積,代謝產物的累積會降低植物細胞內的滲透勢,使得外界的水分子更有利于被植物細胞吸收,為植物在面對非生物脅迫時提供了優勢[2-5]。
在分子水平上,逆境脅迫會導致植物部分轉錄因子基因表達量發生變化,進而對植物代謝水平進行調控,從而適應外界的逆境脅迫。與植物抗逆相關的轉錄因子家族蛋白主要有ZIP、WRKY、AP2/ERF、MYB和NAC 等[6]。其中AP2/ERF 類轉錄因子在植物非生物脅迫中發揮了重要作用,AP2/ERF 轉錄因子家族蛋白全稱為APETALA2 乙烯響應原件結合因子家族蛋白,其結合靶標位點為DRE/CRT 順式作用元件,進而對下游基因進行調控,改變下游基因的表達量,使植物細胞響應生物與非生物脅迫,最終發揮相應的生物學功能[7-12]。在楊亞苓等人的研究中顯示,花椰菜AP2/ERF 轉錄因子ERF056 在鹽脅迫下呈下調表達,負向響應鹽脅迫[13]。研究發現,AP2/ERF 轉錄因子不僅參與了植物逆境脅迫,同時它也參與了植物的次生代謝產物調控、合成以及累積過程。Lu等人研究發現,青蒿素AaERF1、AaERF2 與AaERF3基因對青蒿素合成起正調控作用[14]。張蒙等人研究發現TcERF12和TcERF15 能夠分別抑制和激活紅豆杉中TASY(紫杉烯合酶)的表達[15]。Kathleen等人研究發現煙草中的AP2/ERF 轉錄因子ORC1 的過量表達能夠促進煙草中生物堿次生代謝產物的合成[16]。羅紅梅等人研究發現丹參中的AP2/ERF轉錄因子SmAP2/ERF152參與調控丹參酮的合成[17]。
珊瑚菜(Glehnia littoralisFr.Schmidt ex Miq.)屬于傘形科芹亞科珊瑚菜屬的單種屬多年生藥用草本植物,大多數生長在海邊沙地,屬于瀕危物種[18]。珊瑚菜藥食同源,市場供不應求。如何提升珊瑚菜產量與品質是珊瑚菜育種工作者的重要任務。本課題組對珊瑚菜抗逆相關基因進行發掘,為了獲得珊瑚菜ERFs抗鹽相關基因,我們對珊瑚菜轉錄組中篩選的ERFs相關基因進行初步鹽處理表達分析,其中c43768_g1基因在鹽處理后表達量相較對照組明顯上升。將c43768_g1 轉錄組序列在NCBI 網站上進行blast 比對,結果顯示該轉錄組序列對應的氨基酸序列與胡蘿卜DcERF11氨基酸序列(XP_017234597.1)最為相似,相似度為71.35%,因此將c43768_g1 轉錄組序列命名為GlERF11。本文首次對珊瑚菜AP2/ERF 超家族的GlERF11基因進行了克隆并開展生物信息學分析;同時對GlERF11基因進行了鹽處理前后的表達分析。旨在為該基因的功能鑒定及后續珊瑚菜遺傳學、育種學等研究奠定基礎,如進一步增強珊瑚菜抗鹽抗逆能力,有望提高鹽堿地的利用率并改善我國土地環境。
1 實驗材料
1.1 植物材料
珊瑚菜幼苗(由青島農業大學藥用植物園苗圃提供)。
1.2 實驗試劑
本實驗的主要試劑包括:植物多糖多酚植物總RNA 提取試劑盒(北京天根生化科技有限公司);HiScript?III RT Super Mix for qPCR (+gDNA wiper)反轉錄試劑盒(南京諾唯贊生物科技有限公司);SMARTer?RACE5′/3′Kit 試劑盒(大連寶生生物工程有限公司);SYBR?Premix Ex Taq ?II 定量試劑盒(大連寶生生物工程有限公司);TIAN Midi Purification Kit瓊脂糖凝膠DNA 回收試劑盒(上海生工有限公司);Ex Taq 酶(寶日醫生物技術(北京)有限公司)。
1.3 實驗儀器
本實驗的主要儀器包括:5424 小型臺式離心機(德國Eppendorff Centrifuge 公司);PCR 儀(美國安捷倫公司);實時熒光定量PCR 儀(美國ABI 公司);SIM-F140AY65 制冰機(日本三洋公司);Tanon500 凝膠成像分析儀(上海領成公司);核酸電泳系統(美國BIO-RAD 公司);壓力蒸汽滅菌鍋(上海申安公司);Nano Drop One 超微量分光光度計(美國Thermo公司)。
1.4 使用軟件與網站
使用軟件:DNAMAN 6.0,WPS 2010,Primer 5.0,Pymol 1.5,MEGA 5,clustalx 2.0,Bioedit7.0。
使用網站:NCBI (https://www.ncbi.nlm.nih.gov/),Protscale (https://web. expasy. org/protscale/),TMHMM Server (http://www. cbs. dtu. dk/services/TMHMM/),SOMPA (https://npsa-prabi. ibcp. fr/cgi-bin/npsa_automat. pl? page=npsa_sopma. html),SWISS-MODEL(https://swissmodel.expasy.org/),ITOL (https://itol.embl.de/)。
2 實驗方法
2.1 珊瑚菜轉錄組數據分析
由本實驗室提供珊瑚菜轉錄組數據,使用關鍵詞ERF11對珊瑚菜轉錄組數據庫注釋信息進行搜索,獲得c43768_g1 基因核酸序列。使用NCBI 網站ORF finder 功能尋找c43768_g1 轉錄組序列的正確開放閱讀框蛋白序列,隨后使用protein blast 功能尋找相似度最高的同源蛋白序列,以確定其蛋白功能以及蛋白序列的完整性。
2.2 GlERF11基因cDNA克隆與測序
使用Primer 5.0 軟件對c43768_g1 轉錄組序列開放閱讀框序列設計引物。提取珊瑚菜幼苗總RNA,反轉錄獲得cDNA,通過PCR 進行擴增,擴增產物電泳驗證膠回收后連接到18-T 載體上。將構建完畢的18-T載體轉入大腸桿菌感受態細胞中,AMP(氨芐青霉素)抗性的LB 固體培養基篩選培養。次日挑取飽滿圓形的大腸桿菌進行菌液PCR,將陽性菌株送測。
2.3 GlERF11基因3’Race克隆與測序
使用Primer 5.0 軟件,依據其部分cDNA 序列(5′端完整,3′端不完整)對c43768_g1 轉錄組序列開放閱讀框分別設計長、短3’Race PCR 引物,將擴增后測序結果與原序列進行拼接,從而獲得該基因的全長cDNA序列。
2.4 GlERF11生物信息學分析
使用NCBI 網站的CD Search 功能,尋找該基因全長cDNA 的保守結構域。使用Protscale 網站分析該蛋白的理化性質,使用TMHMM Server 網站分析跨膜結構域。使用SOMPA 與SWISS-MODEL 網站進行蛋白質二級或三級結構預測。
2.5 GlERF11基因鹽脅迫表達分析與差異表達分析
從種植苗圃中挑選健康的剛生長出真葉的珊瑚菜幼苗,用蒸餾水洗凈表面泥沙,吸干多余水分備用。在培養皿中鋪上干凈的濾紙,并在濾紙上倒入適量的200 mmol.L-1的NaCl 溶液,將洗凈的珊瑚菜幼苗鋪在培養皿的濾紙上,放入黑暗培養箱中培養。分別在0 h、3 h、6 h、12 h、24 h、36 h 各取樣一次,樣品全株及時放入液氮中速凍粉碎,隨后提取RNA,隨后反轉錄。使用TB Green?Premix Ex Taq?II (Tli RNaseH Plus)熒光定量試劑盒與Appliedbiosystems 實時熒光定量PCR儀對不同樣品中的GlERF11基因表達量進行熒光定量分析。使用NCBI設計定量引物,使用2-ΔΔCT數據分析法對熒光定量數據進行分析(表1)。

表1 GlERF11基因克隆及RT-qPCR所用的引物序列
3 結果與討論
3.1 GlERF11 cDNA克隆與3’RACE 克隆
3.1.1GlERF11cDNA克隆
為了獲得珊瑚菜GlERF11cDNA 序列,通過已有的轉錄組GlERF11序列設計引物,對珊瑚菜GlERF11cDNA 序列進行PCR 克隆以及測序,如圖1-圖2 所示,GlERF11電泳條帶位置與轉錄組GlERF11開放閱讀框長度一致,對電泳條帶回收測序,測序結果顯示與轉錄組序列基本一致。從而證明已獲得了珊瑚菜GlERF11的cDNA序列。
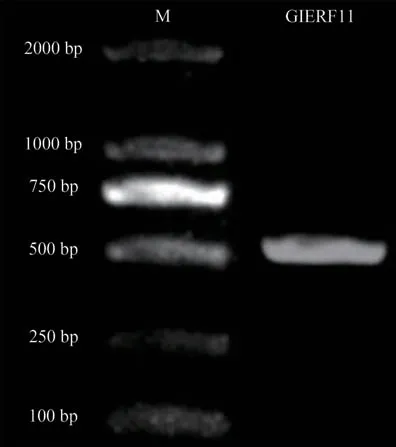
圖1 GlERF11cDNA克隆電泳圖

圖2 GlERF11 cDNA克隆測序比對結果
3.1.2GlERF11基因cDNA3’RACE克隆
對GlERF11 基因進行3’Race PCR,電泳結果如圖3 所示,通過對GlIPT 基因3’UTR 長度進行推測,PCR正確片段長度大約在250-500 bp 之間,因此對圖3 中正確的的DNA 條帶進行回收,連接18-T 并測序。將測序結果與原序列進行拼接從而獲得GlERF11 基因的全長cDNA 序列。用NCBI 提供的Open Reading Frame Finder(ORF Finder)進行開放閱讀框分析得到該序列長1019 bp,ORF(Open Reading Frame)為537 bp,120 bp 5′非轉譯區(5′UTR),250 bp 3′非轉譯區(3′UTR)和28 bp polyA 尾,編碼177個氨基酸,編碼的蛋白質相對分子質量為19710.95 Da(圖4)。

圖3 GlERF11 3’RACE PCR電泳圖

圖4 GlERF11cDNA全長序列與氨基酸序列
3.2 GlERF11蛋白生物信息學分析
3.2.1 GlERF11蛋白保守結構域預測
將GlERF11 蛋白序列于NCBI 在線網站進行保守結構域預測。預測結果如圖5 所示,GlERF11 蛋白的第22-79 個氨基酸編碼區屬于AP2 超家族保守結構域。

圖5 GlERF11蛋白保守結構域預測
3.2.2 GlERF11蛋白理化性質分析
對GlERF11 蛋白進行了親疏水性預測以及蛋白跨膜結構域預測,如圖6-圖7所示,GlERF11蛋白相對分子質量為19710.95 Da,等電點為6.31。不穩定系數為52.48,說明該蛋白不穩定。總平均親水性為-0.534,為親水性蛋白,GlERF11 蛋白在第43 個氨基酸位點,最低峰值是-2.744,在第158 個氨基酸位點,最高峰值是1.911,預測該蛋白無跨膜結構域。

圖6 GlERF11蛋白質親疏水性預測
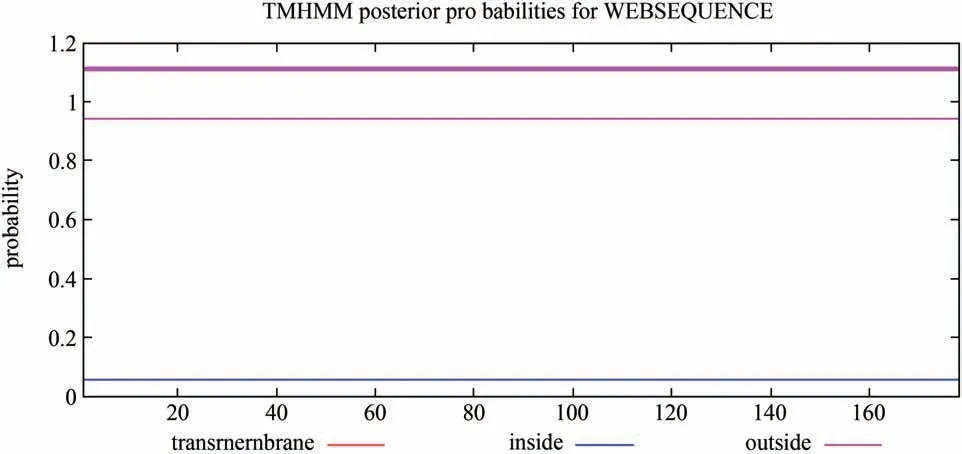
圖7 GlERF11蛋白跨膜結構域預測
3.2.3 GlERF11蛋白二級結構預測
對珊瑚菜GlERF11 蛋白二級結構進行預測。如圖8 所示,GlERF11 二級結構中有21 個氨基酸參與形成了α-螺旋,占11.8%。36 個氨基酸參與了延伸鏈的形成,占20.22%。117 個氨基酸參與了無規卷曲的形成,占65.73%。GlERF11 主要結構均為延伸鏈和無規卷曲,α-螺旋是最為穩定的蛋白質空間結構,其中α-螺旋的比例僅為11.8%,因此推測此蛋白不穩定。

圖8 GlERF11蛋白的二級結構預測
3.2.4 GlERF11蛋白三級結構預測
對已知功能蛋白擬南芥AtERF11 與未知功能蛋白珊瑚菜GlERF11 進行三級結構預測,結果如圖9 所示,預測GlERF11蛋白結構包含285個氨基酸,占編碼氨基酸總數的93.14%,可信度較高。GlERF11 與AtERF11 預測蛋白空間結構較為相似,普遍包含無規則卷曲、β-片層、ɑ-螺旋三種空間結構,推測兩者蛋白在功能上可能存在一定的保守性與相似性。

圖9 AtERF11和GlERF11蛋白三級結構預測
3.2.5 GlERF11蛋白系統進化分析與氨基酸比對
對不同物種的ERF11 蛋白進行了氨基酸序列比對與系統進化樹分析,如圖3~6所示,GlERF11與胡蘿卜Daucus carota,刺苞菜薊Cynara cardunculus以及向日葵Helianthus annuus的ERF11 蛋白親緣關系較近,與密花豆Spatholobus suberectus,玉米Zea mays以及粟Setaria italica等物種的ERF11蛋白親緣關系較遠。通過GlERF11 蛋白與其他物種ERF11 蛋白氨基酸比對結果(圖10)發現,圖中所有物種的ERF11蛋白存在部分保守性基序,從而說明圖中各個物種的ERF11 蛋白存在一定的同源性,同時對圖中所有物種的ERF11 蛋白進行三級結構預測,結果顯示蛋白結構均與GlERF11 蛋白結構相似,保守結構域預測結果顯示,圖中所有蛋白氨基酸序列均包含一個AP2 DNA binding domain 的蛋白保守結構域。該保守結構域至少存在兩個基序,第一個基序位于β-sheet 1 與βsheet 2 預測區,序列為RGVRXRPWGRYAAEIRDP(X為任意氨基酸)。第二個基序位于β-sheet 3 預測區,序列為RVWLG(圖11)。
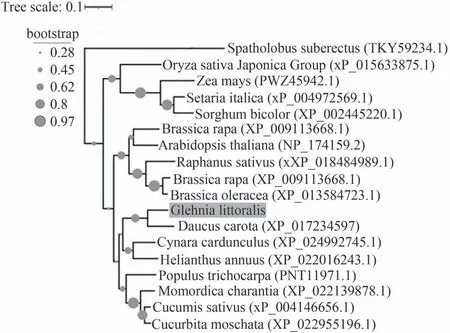
圖10 ERF11蛋白系統進化樹

圖11 GlERF11蛋白與其他物種氨基酸比對
3.3 鹽處理下珊瑚菜GlERF11基因熒光定量表達分析
對不同時間段鹽脅迫處理下的珊瑚菜幼苗的GlERF11基因進行了熒光定量表達分析,結果如圖12所示。珊瑚菜GlERF11基因表達量在鹽脅迫3 h 時間段顯著上調,在6 h 時間段顯著下調,在12 h 顯著上調,在24 h 顯著下調,呈現出節律性變化。說明GlERF11基因響應了鹽脅迫,參與了珊瑚菜的鹽脅迫反應。

圖12 珊瑚菜鹽脅迫處理GlERF11基因表達量變化
4 討論
珊瑚菜是一種重要的鹽生藥用植物,其干燥根是藥典收載的重要中藥材北沙參。有研究表明:在珊瑚菜種子萌發階段和幼苗生長期均具有較好的耐鹽性,在100 mmol·L-1NaCl 處理的珊瑚菜幼苗生長狀態和生長量正常,當溶液中濃度超過200 mmol·L-1時生長開始受到抑制,在300 mmol·L-1處理條件下開始出現植株死亡,存活率為50%左右[19]。對于珊瑚菜抗鹽基因的研究,對揭示藥用植物抗鹽抗逆機理具有重要價值。
AP2/EREBP 是植物中最大的轉錄因子家族之一,根據AP2 結構域數量可以分為兩種,其中只具有一個AP2 結構域的為ERF 亞族,其屬于乙烯響應因子,在調節植物生物和非生物逆境反應中發揮重要作用[20-21]。研究表明很多物種的ERF11基因參與抗逆脅迫。Marieke 等人發現:在甘露醇處理下擬南芥AtERF11基因表達量受到誘導呈上調趨勢[22]。在白樺(Betula platyphylla)中,ERFs 基因的表達存在組織差異性,并且在鹽脅迫下BpERF11基因呈上調的表達趨勢,說明其參與白樺對鹽脅迫的響應[23]。劉悅等人在楊 樹(Populus simonii × P.nigra)中克隆并獲得了PsERF11基因,并對該基因進行了生物信息學和表達分析。實驗結果顯示該基因在楊樹組織中存在差異表達,同時響應鹽脅迫與干旱脅迫[24]。在大白菜(Brassica pekinensis(Lour.) Rupr.)和蘋果(Malus × domesticaBorkh.)中,ERF11基因也參與了植物的生物脅迫[25-26]。本研究通過RACE 技術得到珊瑚菜抗鹽相關基因GlERF11的全長cDNA 序列,將其與NCBI 上植物的同源蛋白序列進行比對,發現GlERF11 蛋白存在1 個AP2 蛋白保守結構域。利用生物信息軟件進行序列分析,從而全面研究基因信息;通過qPCR 分析鹽脅迫下的珊瑚菜幼苗,結果顯示:在200 mmol·L-1NaCl 的不同時間處理該基因表達量均有顯著上調;在12 h 處理下,該基因的表達量增幅最大,是空白的2 倍多。說明了GlERF11基因響應鹽脅迫,從而參與珊瑚菜的抗鹽過程。本研究為ERFs 家族基因促進珊瑚菜抗鹽的分子機制研究提供依據,后續功能鑒定及機理解析實驗有待進一步開展。
乙烯作為一種植物激素不僅調節生長發育、果實成熟,還能在植物體內快速傳遞環境信號,進而使植物對脅迫做出應答[27]。一些轉錄因子可以通過響應乙烯來調節植物的鹽脅迫。如大部分具有較高水平ERFs的煙草乙烯不敏感突變體,對環境脅迫表現出明顯的抗性[28-29]。推測乙烯響應因子GlERF11 可能通過結合結構基因的上游順勢作用元件來調控下游基因的表達,即GlERF11 可能是通過調節乙烯的生成進而協調相應信號途徑之間的相互作用,參與珊瑚菜的抗逆過程,有待后續研究。
此外,植物在受到外界環境的影響壓迫時,體內的次生代謝物一般會大量產生,進而來抵御惡劣環境。如有研究表明:一定量的環境脅迫可以增加甘草中甘草苷、甘草酸等有效成分的積累,進而提高其相關品質[30-31]。抗性與高品質存在一定關聯性,珊瑚菜的抗性優良品種很可能也是高產優質品種。因此,對于珊瑚菜抗鹽基因的研究,不僅有利于開發利用耐鹽植物資源、提高國家鹽堿地的利用率,并且對提高藥用植物的產量及優化中藥材品質都有一定現實意義。