豌豆超微粉碎膳食纖維對糖尿病小鼠腸道菌群及其代謝產物的影響
厲佳怡,王紅磊,楊倩倩,楊進潔,嵇 威,南希駿,盛桂華,*
(1.山東理工大學農業工程與食品科學學院,山東 淄博 255049;2.山東省高校農產品功能化技術重點實驗室,山東 淄博 255049;3.煙臺雙塔食品股份有限公司,山東 煙臺 265404)
糖尿病的治療已成為當今最重要的公共衛生挑戰和經濟負擔之一。患有2型糖尿病(type 2 diabetes mellitus,T2DM)的人口數量約占糖尿病患者的90%。目前,糖尿病的治療主要是通過飲食干預、藥物治療以及加強運動來控制血糖,其中飲食干預是治療的重要途徑。相比于藥物治療,改善糖尿病人的飲食結構、增加膳食纖維的攝入副作用更小。膳食纖維屬于多糖類物質,是一種優質的功能性食品,可以保持人體健康和預防機體疾病,具有一定的生理功效。根據相關研究表明,膳食纖維在降血糖方面有顯著作用,其降血糖的作用可能包括以下幾個方面:1)在人體內能夠影響-淀粉酶活力,降低淀粉的水解速度,減緩葡萄糖的釋放及濃度上升;2)在腸道中能夠吸附游離的葡萄糖并排出;3)可以增加神經末梢對胰島素的敏感性,改善胰島素抵抗的狀態。
研究發現,與正常人相比,糖尿病患者腸道中擬桿菌門(Bacteroidetes)、變形菌門(Proteobacteria)的豐度升高,厚壁菌門(Firmicutes)豐度降低,此外雙歧桿菌和乳酸桿菌等有益菌的豐度也顯著減少。張影研究了膳食纖維和蛋白質兩種物質對T2DM患者腸道菌群的影響,結果表明,膳食纖維飲食能夠改善糖尿病患者的血糖濃度,使腸道有益菌豐度升高;而蛋白質飲食雖然能夠改善患者的糖穩態,降低血糖濃度,但是會加重患者的胰島素抵抗。Qin Junjie等利用宏基因組技術對345 名志愿者的腸道菌群樣本進行測序;結果表明T2DM患者腸道菌群明顯失調,各種致病菌的豐度增加,而某些產丁酸鹽等短鏈脂肪酸(short chain fatty acids,SCFAs)的常見細菌豐度減少。SCFAs能夠在小腸、胰腺和肝臟等器官中作為信號分子調節體內的能量代謝,進而調控血糖水平。
有學者認為膳食纖維降血糖與腸道菌群及其代謝產物SCFAs有關系。不能消化吸收的膳食纖維可以調節腸道菌群的紊亂行為,同時能夠被腸道中的數百種菌群所分解利用,產生的代謝物質SCFAs能被人體吸收參與代謝。Zhao Liping等研究表明,碳水化合物發酵產生的SCFAs可以調節腸道微生物系統的生態環境,高膳食纖維飲食可以促進特定腸道益生菌的增殖,從而調節糖尿病患者的腸道菌群,這些益生菌在腸道生態系統中比其他產生SCFAs的細菌和致病菌更具競爭力。
豌豆膳食纖維(pea dietary fiber,PDF)具有潛在的降血糖功能開發價值。Hashemi等通過動物實驗證實,PDF具有降低血糖的效果,并且可能有改善腸道菌群組成的作用。然而目前鮮有研究報道PDF的降血糖機制。由實驗室前期研究結果可知,超微粉碎的PDF具有更小更均勻的粒徑、更高的可溶性膳食纖維含量,這都有利于發揮降糖效果。因此,本研究探討超微粉碎豌豆膳食纖維(ultrafine grinded pea dietary fiber,UGPDF)對小鼠腸道菌群豐度、物種組成及代謝產物、肝臟組織形態及磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/類胰島素生長因子(insulinlike growth factors,IGF)蛋白表達的影響,以期從腸道菌群角度探究UGPDF降血糖機制,拓寬PDF的應用領域,為PDF降血糖機制研究提供新的思路和理論參考。
1 材料與方法
1.1 動物、材料與試劑
BALB/C雄性小鼠,體質量(25±3)g,購自濟南金豐實驗動物有限公司,生產許可證號:SCXK(魯)2014-0007。
豌豆膳食纖維由煙臺雙塔食品股份有限公司提供。
鏈脲佐菌素(streptozocin,STZ)、二甲雙胍、十二烷基硫酸鈉 上海愛純生物科技有限公司;RIPA裂解液 北京索萊寶生物科技有限公司;聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜 美國Millipore公司;AxyPrepDNA凝膠回收試劑盒 美國Axygen公司。
1.2 儀器與設備
血糖儀、血糖試紙條 長沙三諾生物傳感股份有限公司;FDV型超微粉碎機 江蘇省金壇市金城國盛實驗儀器廠;凝膠電泳儀 美國Bio-Rad公司;JY04S-3B型凝膠成像分析系統 上海圣科儀器有限公司;ABI GeneAmp9700型聚合酶鏈式反應(polymerase chain reaction,PCR)儀 美國ABI公司;Miseq型測序儀美國Illumina公司;8890B-5977B GC/MSD氣相色譜-質譜聯用儀 美國安捷倫科技有限公司;微型熒光計美國Promega公司;倒置顯微鏡 德國Leica公司。
1.3 方法
1.3.1 超微粉碎膳食纖維制備
參考Wang Meng等的方法,用FDV型超微粉碎機將PDF粉碎(粉碎30 s、停歇30 s,循環2 次)得UGPDF。
1.3.2 動物實驗設計
以BALB/C雄性小鼠為實驗對象,分籠飼養,自由進食和飲水飼喂1 周以適應環境,保持溫度(22±2)℃、相對濕度(55±10)%以及無菌通風狀態。動物飼養和處理遵循中國實驗動物科學協會實驗動物福利和倫理委員會規定。
用0.1 mol/L檸檬酸緩沖液配制STZ溶液,現用現配,避光冰浴保存,10 min內完成腹腔注射。小鼠適應性飼養1 周后,斷食16 h,不斷水,將小鼠分為正常對照組(10 只)和實驗組(40 只),實驗組一次性腹腔注射STZ溶液(100 mg/kg),正常對照組(NC)腹腔注射等體積檸檬酸緩沖液。3 d后血糖儀測定小鼠尾靜脈血糖水平,以空腹血糖濃度大于11.1 mmol/L判定為糖尿病小鼠模型造模成功。正常對照組(NC)腹腔注射等體積檸檬酸緩沖液。
將建模成功小鼠隨機分為模型組(DC)、膳食纖維高劑量組(UGPDF-GH,0.9 g/(mL·d))、膳食纖維低劑量組(UGPDF-GL,0.45 g/(mL·d))、陽性(二甲雙胍)對照組(PC,10 mg/(mL·d)),每組10 只,NC組與DC組給予標準飼料,UGPDF-GH、UGPDF-GL、PC組小鼠灌胃劑量為0.25 mL/d,周期為4 周。
1.3.3 小鼠血糖濃度測定
每周最后1 d在小鼠尾部靜脈取血,用血糖儀測定各組小鼠血糖濃度。
1.3.4 肝臟組織形態觀察
解剖小鼠后,將各組肝臟組織分別浸泡在體積分數10%福爾馬林溶液中;分別用體積分數為70%、80%、95%、100%的乙醇梯度脫水,石蠟包埋切片(5 μm)。用蘇木精-伊紅染色,在放大400 倍的倒置顯微鏡下觀察肝臟組織形態變化。
1.3.5 Western blot檢測
將小鼠肝臟組織切開,用RIPA裂解液對肝臟蛋白質抽提,用BCA法對抽提后樣本蛋白質量濃度進行定量,使各樣本的蛋白質量濃度達到相近水平,再將處理后的蛋白樣本置于99 ℃水浴中加熱5 min,使蛋白變性,隨后取出冰浴5 min。通過十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳對處理好的樣品進行蛋白分離,用PVDF膜進行膜轉化后清洗1~2 次,4 ℃密封過夜。在原稀釋液中孵育1 h,洗滌3 次,每次5 min,第二次抗體孵育步驟同上,最后置于凝膠成像儀中拍照分析。
1.3.6 腸道菌群分析
1.3.6.1 糞便DNA提取、擴增、測序
對各組小鼠糞便抽提DNA,1%瓊脂糖凝膠電泳檢測。檢測合格后PCR擴增。擴增區域為V3~V4可變區,引物為338F:ACTCCTACGGGAGGCAGCAG,806R:GGACTACHVGGGTWTCTAAT,擴增后進行2%瓊脂糖凝膠電泳,AxyPrepDNA凝膠回收試劑盒,切膠回收PCR產物,Tris-HCl緩沖液洗脫,利用微型熒光計的QuantiFluor?-ST系統定量后通過IIlumina GAIIx高通量測序平臺進行測序。以上操作由上海美吉生物有限公司協助完成。
1.3.6.2 生物信息學分析
將Miseq測序儀測序得到的數據根據overlap進行拼接,質控過濾,優化去雜;聚類分析區分樣本序列,形成操作分類單元(operational taxonomic units,OTU)劃分,通常對97%相似水平下的OTU進行生物信息統計分析。在域、界、門、綱、目、科、屬、種水平統計樣本的群落物種組成,對比的數據庫包括細菌和古菌16S rRNA數據庫、真菌18S rRNA數據庫、真菌ITS數據庫、功能基因數據庫。基于OTU聚類結果,得到對應的物種信息和豐度分布;分析群落的豐富度(Chao指數)、群落多樣性(Shannon指數、Simpson指數);并通過群落柱狀圖與群落熱圖分析各組在門、屬水平上的群落結構組成情況。
1.3.7 腸道SCFAs含量測定
小鼠糞便中SCFAs含量采用GC-MS測定。取100 mg樣品于2 mL研磨管中,加入900 μL甲醇和100 μL內標溶液(1 000 μg/mL 2-乙基丁酸)后冷凍研磨兩次,每次3 min。研磨后冰水浴超聲30 min,-20 ℃靜置30 min,13 000×離心15 min(4 ℃),取上清液,加50 mg無水硫酸鈉再次離心,取上清液進行氣相色譜-質譜分析。
色譜條件:HP FFAP毛細管柱(30 m×0.25 mm×0.25 μm),以流速1.0 mL/min高純氦氣為載氣,進樣口溫度260 ℃,進樣量1 μL,分流比為10∶1。管柱初始溫度80 ℃,以40 ℃/min升至120 ℃,再以10 ℃/min升溫至200 ℃,后230 ℃保持1 min。質譜條件:電子轟擊離子源,離子源溫度230 ℃,四極桿溫度150 ℃,傳輸線溫度230 ℃。全掃描模式,掃描范圍:30~300/。通過Masshunter定量軟件計算結果。
1.4 數據處理與分析
每個實驗3 次重復,采用SPSS 19.0軟件進行數據統計分析,結果表示為平均值±標準差,進行單因素方差分析,采用Origin 8.5軟件作圖。
2 結果與分析
2.1 UGPDF對小鼠血糖濃度的影響
研究表明,飲食中的膳食纖維含量可反映血糖指數,當攝食高含量膳食纖維時,人體血糖指數下降,因此,膳食纖維攝入量是T2DM最重要的預測因素之一。表1為4 周內各組小鼠的血糖濃度變化情況,DC組小鼠的血糖濃度呈持續上升趨勢,并在第4周血糖濃度達到(19.10±1.65)mmol/L;經過UGPDF干預后,與DC組相比,不同劑量組小鼠血糖濃度均顯著降低(<0.05),且存在劑量依賴關系,其中UGPDF-GH組和PC組的降血糖效果最顯著,第4周血糖濃度分別降到(6.70±0.90)、(6.90±0.53)mmol/L,與NC組無差異(>0.05),與文獻[21-22]報道結果一致。
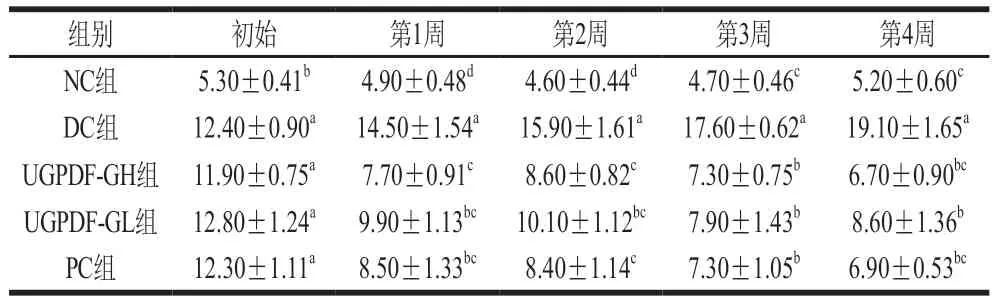
表1 不同組別小鼠4 周內血糖濃度變化Table 1 Changes in blood glucose of DM mice during the four-week administration period mmol/L
2.2 UGPDF對糖尿病小鼠肝臟組織形態的影響
肝細胞具有解毒、調節多種營養物質分泌、排泄代謝產物等功能,是肝臟主要的功能細胞,也是體內葡萄糖代謝異常、發生糖異生的主要場所。如圖1所示,NC組的肝細胞排列整齊、緊密,細胞形態飽滿,肝小葉形態完整,而DC組肝細胞的胞間隙變大,細胞核大小不均,形態有所改變,這與王賽等建立的T2DM模型肝細胞形態相似。經過4 周干預后,與模型組相比,PC組肝臟細胞間隙較明顯變小,細胞形態也有所改善,UGPDF對細胞改善情況呈劑量依賴性,UGPDF-GH組肝細胞排列整齊,糖原沉積情況有所緩和,核質分布均勻。表明UGPDF對糖尿病小鼠肝組織損傷具有明顯的改善作用。
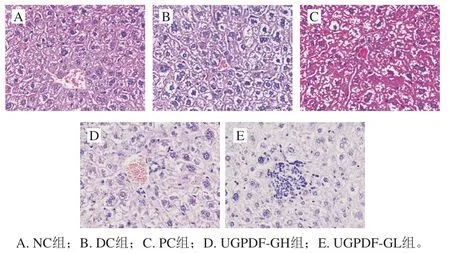
圖1 UGPDF對糖尿病小鼠肝臟細胞形態的影響Fig. 1 Effect of UGPDF on hepatic cell morphology in diabetic mice
2.3 UGPDF對糖尿病小鼠肝臟PI3K/AKT/IGF蛋白表達的影響
IGF與胰島素的結構類似,功能也相似,具有促進細胞增長、促進葡萄糖轉運代謝、增強人體對胰島素敏感度、促進損傷細胞修復的功能。有相關研究報道,IGF可以通過激活PI3K/AKT通路,從而刺激胰島β細胞增殖,增加胰島素敏感性。小鼠肝臟組織Western blot檢測結果如圖2、3所示。與NC組相比,DC組小鼠肝臟的PI3K、AKT和IGF表達量顯著降低。使用陽性藥物和UGPDF干預,顯著改善了糖尿病小鼠肝臟內的蛋白表達,其中以陽性藥物效果最為顯著,與DC組相比,PC組PI3K、AKT、IGF蛋白表達量分別升高了495.42%、255.11%、385.09%。UGPDF-GH組蛋白表達量明顯高于UGPDF-GL組,與DC組相比,UGPDF-GH組PI3K、AKT、IGF蛋白表達量分別升高了420.33%、105.71%、327.67%。結合肝組織蘇木精-伊紅染色圖像來看,推測DC組上游信號轉導因子PI3K/AKT表達受影響后,導致肝糖代謝異常,進一步影響肝細胞損傷。表明UGPDF能夠通過提高糖尿病小鼠肝臟細胞PI3K/AKT信號通路的傳導,促進IGF蛋白表達,修復肝臟組織損傷。
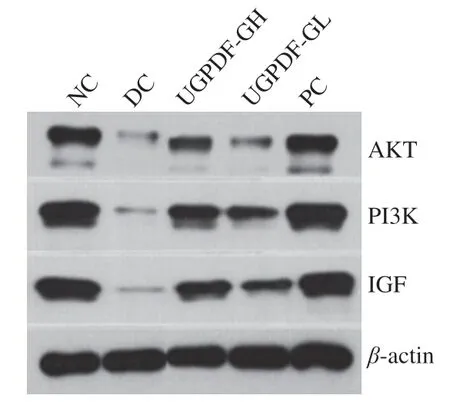
圖2 小鼠肝臟蛋白Western blot圖Fig. 2 Protein expression in liver tissues of mice measured by Western blot
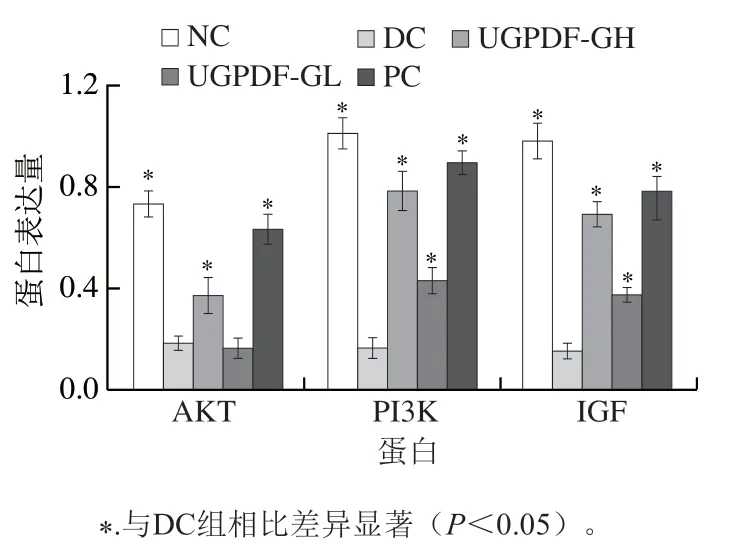
圖3 小鼠肝臟中PI3K、AKT、IGF蛋白表達量Fig. 3 Expression levels of PI3K, AKT, IGF proteins in liver
2.4 UGPDF對糖尿病小鼠腸道菌群的影響
2.4.1 腸道菌群的多樣性
Coverage指數代表各樣本文庫覆蓋率,由表2可知,所有組中的Coverage指數都大于0.998,接近于1,說明該測序結果能夠反映出樣本中微生物的真實情況。Chao指數用于估計樣本中所含OTU數,Shannon與Simpson指數用來估算樣本中微生物多樣性,Shannon指數越大,菌群群落多樣性越高;Simpson指數與之相反。
在大于97%的序列相似性的篩選下,各組小鼠的OTU數及腸道菌群Alpha多樣性如表2所示。由表2與圖4可知,DC組OTU數為188±28,與NC相比顯著下降了51.80%;且DC組與NC組共有的OTU數為120,特有的OTU數為68,說明糖尿病小鼠腸道菌群發生顯著改變,豐度和多樣性發生變化;而UGPDF-GH組和PC組的OTU數分別為300±36、331±29,與DC組共有的OTU數分別為152、149,與NC組共有的OTU數目分別為190、242;說明在經過UGPDF和二甲雙胍干預4 周后,糖尿病小鼠的腸道菌群豐度和多樣性得到不同程度的顯著改善,并向NC組小鼠靠近。Shannon與Simpson指數也側面反映了這個趨勢,與NC組相比,DC組小鼠腸道菌群Shannon指數顯著降低,Simpson指數顯著升高;與DC組相比,經UGPDF干預后,UGPDF-GH組Shannon指數顯著升高,Simpson指數顯著降低,并且這兩個指數與NC組相比,沒有顯著差異性。這一趨勢與魏國華的研究結果相似。這可能是因為UGPDF可以被腸道內菌群發酵,改變腸道內pH值,從而調節腸道菌群豐度及多樣性,改善糖尿病導致的腸道菌群紊亂。
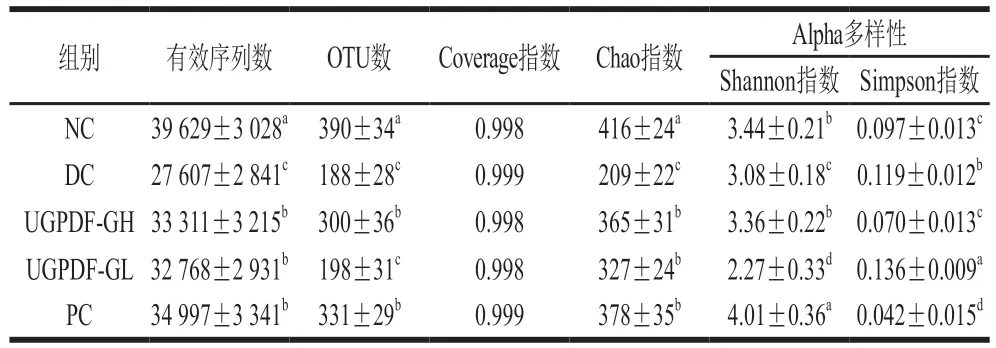
表2 小鼠腸道菌群豐度及多樣性變化Table 2 Changes in intestinal flora abundance and diversity in mice
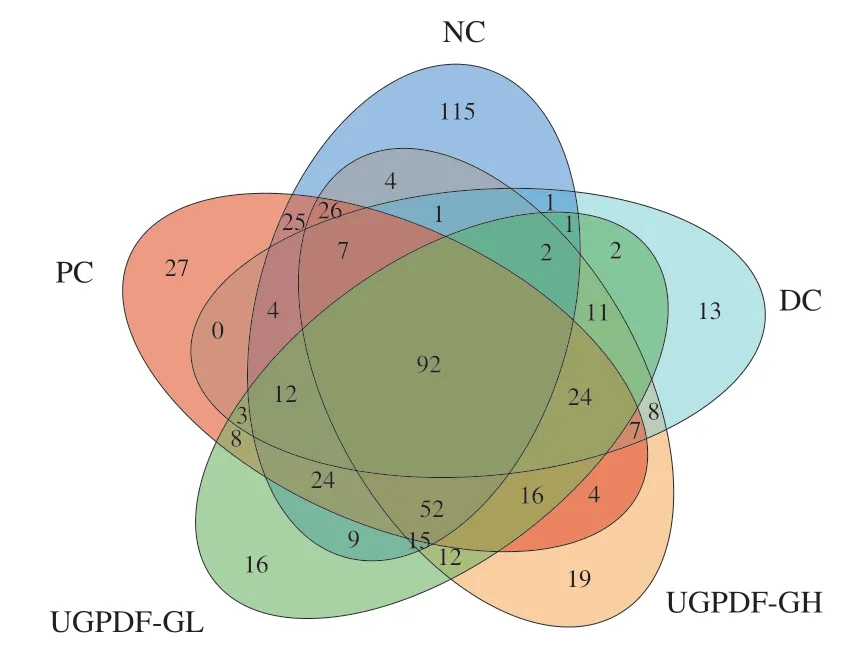
圖4 小鼠腸道菌群OTU數Venn圖Fig. 4 Venn diagram showing the number of unique and shared OTUs in the intestinal flora of mice
2.4.2 腸道菌群在門水平的差異
在對腸道菌群高通量測序后,與數據庫比對可以得到小鼠腸道菌群組成與豐度變化情況。為了明顯觀察UGPDF對糖尿病小鼠腸道菌群多樣性及物種組成的影響,對腸道菌群在門和屬水平上差異進行比較分析。由圖5A可知,Firmicutes與Bacteroidetes為腸道內兩大優勢菌門,占85%以上。由圖5B可知,與NC組相比,DC組小鼠腸道中Firmicutes和Bacteroidetes相對豐度顯著下降(<0.05),Epsilonbacteraeota與Proteobacteria豐度顯著增加(<0.05),經過UGPDF的干預后,與DC組相比,Firmicutes相對豐度顯著提高,Epsilonbacteraeota與Proteobacteria相對豐度顯著下降(<0.05),Bacteroidetes相對豐度也下降,但變化不顯著(>0.05)。這與Wang Xueliang等的研究結果類似。有研究報道,Firmicutes與Bacteroidetes的相對豐度變化影響著機體代謝從而控制體質量增長率,Firmicutes相對豐度高于Bacteroidetes時,會使機體有效吸收營養物質,體質量增加。Epsilonbacteraeota與Proteobacteria包含條件致病菌,如腸桿菌、幽門螺旋桿菌等,過度富集容易引起腸道慢性炎癥,從而引起胰島素抵抗,以及增加代謝疾病的風險。
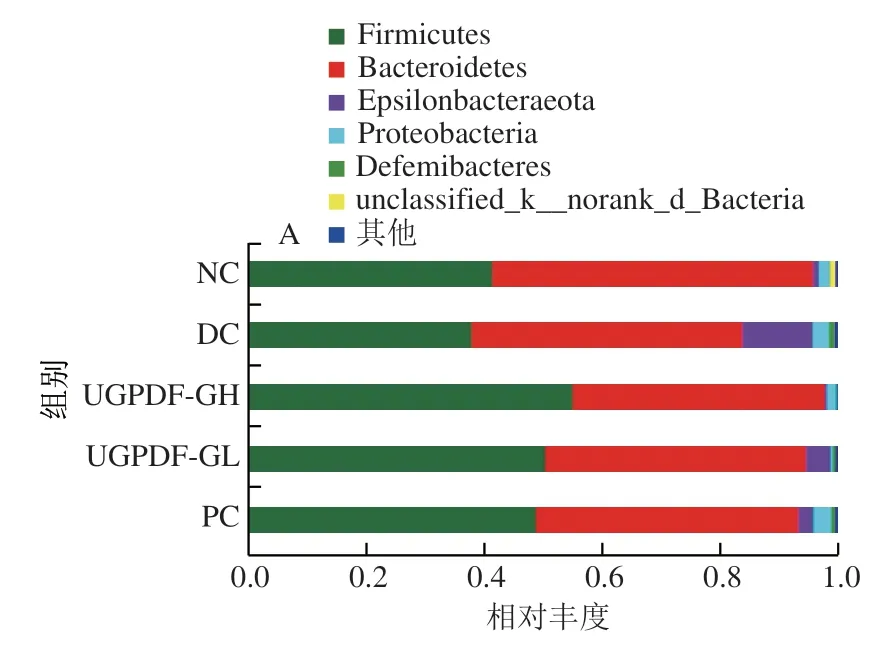
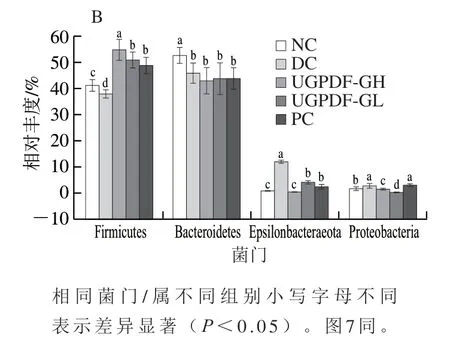
圖5 小鼠腸道菌群物種門水平組成(A)與優勢物種豐度(B)Fig. 5 Intestinal flora composition at the phylum level (A) and dominant species abundance (B)
2.4.3 腸道菌群在屬水平的差異
如圖6A、B所示,各組小鼠腸道菌群在屬水平的相對豐度存在明顯差異。為了更直觀反映各組小鼠優勢菌屬水平的差異,選取3 類具有代表性的菌屬(圖7):1)有益菌:乳酸菌()、普雷沃氏菌科(Prevotellaceae)、顫桿菌克屬();2)條件致病菌:螺桿菌屬()、克雷伯氏菌屬()、梭狀桿菌()、腸球菌();3)產SCFAs的菌:毛螺菌科(Lachnospiraceae)、擬普雷沃菌屬()、布勞特氏菌()。由圖7A、B可知,與NC組小鼠相比,糖尿病小鼠的腸道菌群在屬水平存在紊亂現象,其中有益菌屬、Prevotellaceae、的相對豐度顯著降低(<0.05);條件致病菌、、過度富集,而、、這些致病菌在正常小鼠腸道內的相對豐度低于0.1%,甚至檢測不出;由圖7C可知,糖尿病小鼠腸道內的部分產SCFAs的菌群相對豐度顯著降低(<0.05),這與聶啟興的研究結果一致。經過UGPDF的飲食干預后,與DC組小鼠相比,有益菌屬和產SCFAs的菌屬豐度整體上顯著升高,達到甚至超過正常小鼠的水平,其中UGPDF-GL干預組中大量富集,成為主要菌屬。為乳酸菌的一種桿狀菌群,分解糖類物質能力極強,最終代謝產物為乳酸;Prevotellaceae與可以發酵碳水化合物,產物為乙酸、琥珀酸等SCFAs;代謝產物為乙酸。在4 周的飲食干預下,UGPDF可以被腸道內的有益菌及產SCFAs菌群所發酵利用,調節腸道pH值,達到抑制致病菌的效果,因此UGPDF可以調節小鼠腸道菌群環境,促進腸道菌群健康。
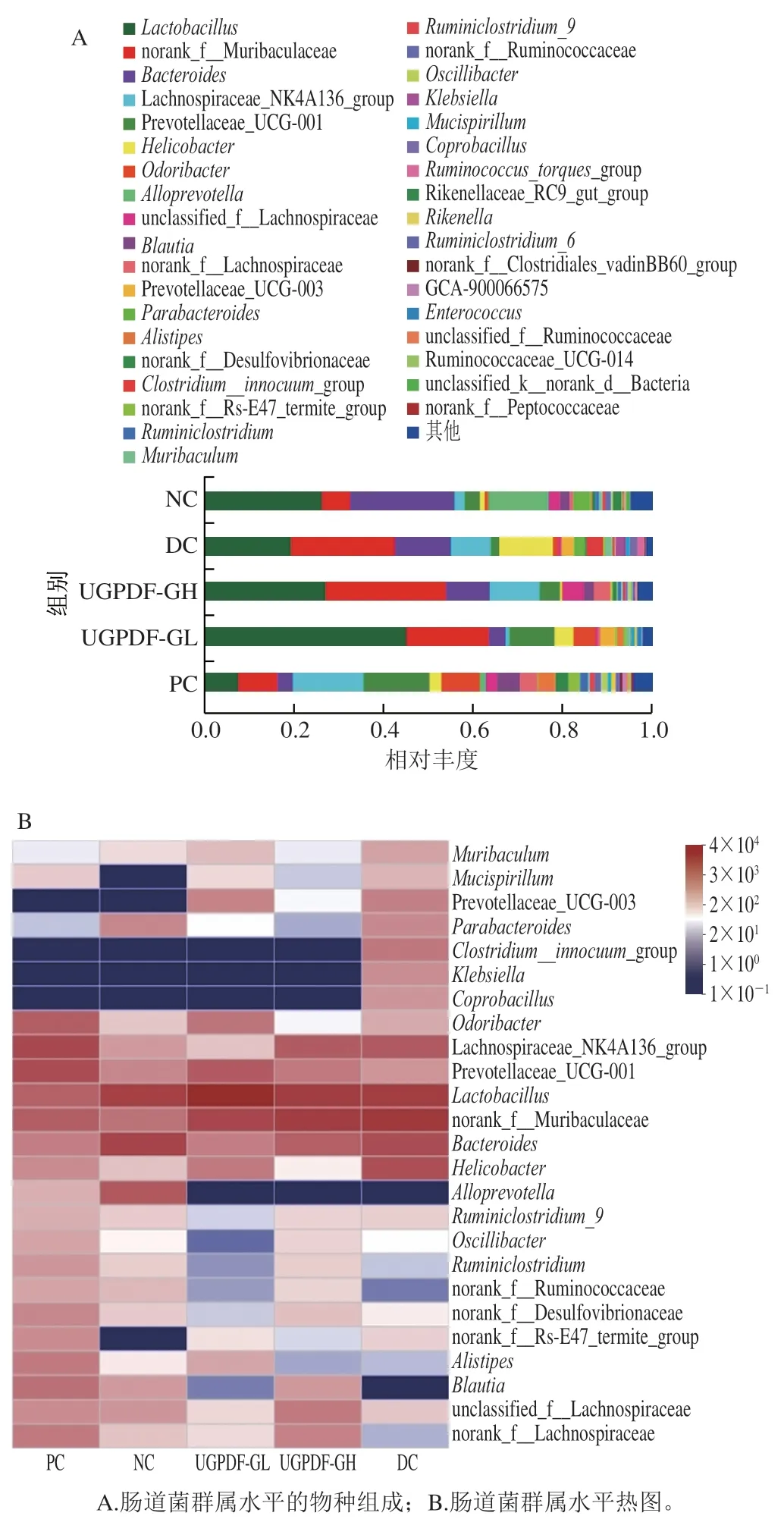
圖6 小鼠腸道菌群屬水平物種分析Fig. 6 Intestinal flora composition at the genus level of mice
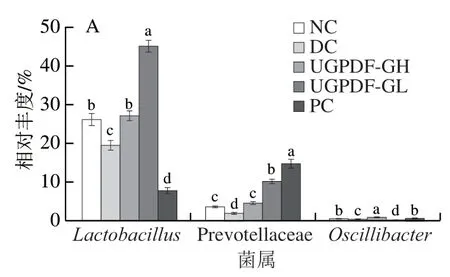

圖7 小鼠腸道菌群屬水平的相對豐度Fig. 7 Intestinal flora abundance at the genus level
2.5 UGPDF對糖尿病小鼠糞便SCFAs含量的影響
臨床研究表明,SCFAs可以維持腸道形態和功能,并具有一定的調節作用,可用于評估腸道內細菌的種類和活性。因此,腸道或糞便中SCFAs的含量是評估各種腸道慢性疾病的主要指標之一。由圖8可知,乙酸、丙酸和丁酸是小鼠糞便中主要的SCFAs,其含量明顯高于異丁酸、戊酸、異戊酸。與NC組相比,糖尿病小鼠糞便中各SCFAs含量顯著降低(<0.05),與Zhao Liping等的研究結果一致。經過UGPDF飲食干預后,與DC組相比,小鼠糞便內的SCFAs含量顯著升高,且存在劑量依賴關系,其中以UGPDF-GH組效果最為顯著,其乙酸、丙酸、丁酸含量分別為(1.49±0.11)、(0.51±0.06)、(0.49±0.05)μg/mg,較DC組分別提高了63.7%、75.9%和96.0%,且接近NC組小鼠。
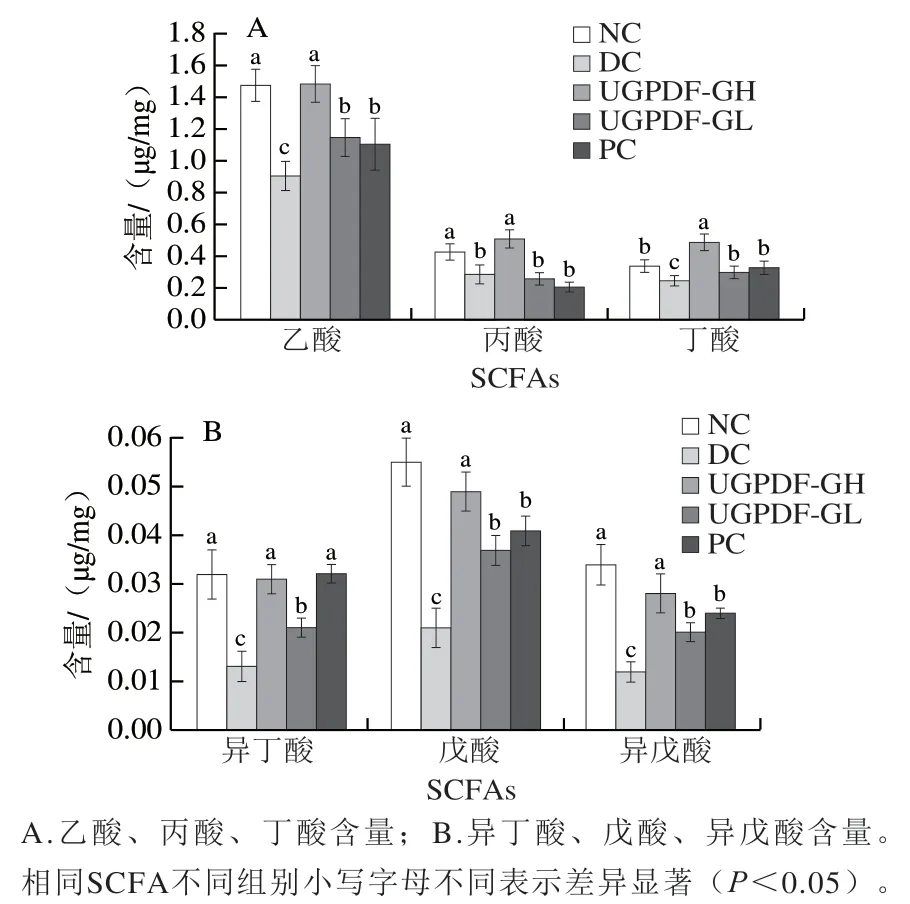
圖8 各組小鼠糞便SCFAs含量Fig. 8 Contents of SCFAs in feces of mice in each group
研究表明,乙酸能夠減少肝臟中木酮糖-5-磷酸的積累和降低磷酸果糖激酶-1的活性,從而調節機體的糖酵解、糖異生代謝,降低糖尿病患者的血糖濃度;丙酸能夠作用于胰島細胞,促進胰島素分泌,減緩胰島β細胞凋亡,同時刺激胰高糖素樣肽-1的分泌,改善胰島素抵抗;丁酸可以增加胰島素敏感性,以及通過促進腸道糖異生作用抑制肝臟糖異生,改善代謝,同時丁酸在腸道中可以調節微生物生態,增加豐度降低腸桿菌等致病菌的豐度。而UGPDF攝入后可以被這些菌群所發酵代謝,提高乙酸、丙酸等SCFAs的代謝產量,從而調節代謝,達到降血糖的作用。
3 結 論
UGPDF可以修復肝臟細胞損傷,改善小鼠肝臟PI3K/AKT/IGF蛋白表達;調節糖尿病小鼠體內腸道菌群的豐度及多樣性,改善小鼠腸道環境,增加有益菌的豐度,抑制致病菌的增殖;此外,由于不易消化的特性,使其可以在腸道內被功能性菌群所發酵代謝,增加其代謝產物SCFAs的含量。UGPDF能夠被小鼠腸道內有益菌群所發酵,如、Lachnospiraceae等,同時抑制致病菌、等的增殖,促進腸道菌群環境健康。從代謝產物SCFAs來看,經過UGPDF干預后,小鼠糞便內的6 種SCFAs含量較DC組均顯著升高,其中以UGPDF-GH組提升效果最為顯著,其SCFAs含量接近NC組小鼠水平。本研究為UGPDF的應用提供了思路,并補充完善了其降血糖的機制,為UGPDF功能性應用提供了參考。

