大黃素對大鼠非酒精性脂肪肝及肝組織11β-羥基類固醇脫氫酶1表達的影響*
孫紅爽 李鵬霖 劉永雙 乜春城 種寶貴
(哈勵遜國際和平醫院藥學部,衡水 053000)
非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)是代謝綜合征的主要臨床表現之一,其發病機制尚不完全明確,但“二次打擊”理論已被普遍認同,胰島素抵抗、氧化應激、炎性反應和脂質代謝紊亂在其發病過程中發揮了重要作用[2]。大黃素(emodin)是中藥材大黃的主要有效單體組分,可從大黃、虎杖、決明子、何首烏和蘆薈等中藥材中有效提取。大黃素具有多種藥理作用,主要包括抗炎、抗氧化、調節血脂、保護肝細胞、抗腫瘤等[3]。研究發現,大黃素可以改善高脂飼料喂養大鼠非酒精性脂肪肝及脂質代謝紊亂[4]。本次研究通過高熱量飼料喂養建立NAFLD大鼠模型,觀察大黃素對高熱量飼料喂養所致大鼠NAFLD的治療作用并探討其作用機制,為NAFLD的藥物治療和發病機制研究提供理論基礎。
1 材料和方法
1.1 實驗動物
清潔級雄性Wistar大鼠40只,體質量200~220 g,購自河南實驗動物中心,實驗動物生產許可證編號SCXK(豫)2017-0001,飼養于中國藥科大學藥理教研室【SYXK(蘇)2018-0018】;適應性喂養1周后開始實驗。本研究經哈勵遜國際和平醫院倫理委員會審核批準(2018-3-015)。
1.2 試劑與儀器
大黃素(鄭州荔諾生物科技有限公司,批號:160724,純度98%),全自動生化分析儀(日立公司,7600-020),兩步法RT-PCR試劑盒(TaKaRa公司);11β-HSD1抗體(Santa Cruz公司);實時定量PCR儀(MJ Research 公司);Western blot儀(Bio-Rad公司)。
1.3 動物分組與給藥
40只大鼠隨機分為:對照組、模型組、大黃素低劑量組(E1組)、大黃素高劑量組(E2組),每組10只。對照組給予普通飼料,其他3組給予自制高熱量飼料(配方:22%豬油+8%糖+2%膽固醇+2%食鹽+66%基礎飼料),飲用自來水。第9周開始,E1組、E2組每天分別灌胃給以大黃素30 mg/kg和60 mg/kg(用0.5%羧甲基纖維素鈉溶液提前配制,濃度10 mg/mL),對照組和模型組灌胃給以相同體積的0.5%羧甲基纖維素鈉溶液,每天給藥1次,連續6周。
1.4 指標檢測
1.4.1一般觀察:每周記錄大鼠體質量、進食量,觀察動物皮毛光澤度、糞便及活動情況。
1.4.2肝指數的測定:大鼠麻醉后頸動脈插管取血,血樣1 370 r/min離心10 min,分離血清,于-20 ℃保存待測。打開腹腔,取完整肝組織,反復漂洗后稱重,并計算肝指數(hepatic index, HI):HI(mg/g)=肝臟重量(g)/體質量(g)×1 000。
1.4.3血液指標測定:采用全自動生化分析儀檢測血清中的血糖、總膽固醇(totalcholesterol,TC)、三酰甘油(triglycerides,TG)、高密度脂蛋白(high density lipoprotein, HDL)、游離脂肪酸(free fatty acid, FFA) 及丙氨酸轉氨酶(alaninne aminotransferase,ALT)、天冬氨酸轉氨酶(aspartate aminotransferase,AST)。采用DFM-96型16管放射γ免疫計數器檢測血清腫瘤壞死因子-α(tumor necrosis factor α, TNF-α)和胰島素。并計算胰島素抵抗指數(HOMA-IR):HOMA-IR=(空腹胰島素×空腹血糖)/22.5。
1.4.4肝組織生化指標測定:取新鮮肝組織200 mg肝組織,制成10%的肝組織勻漿,1 370 r/min離心15 min,取上清液,-20 ℃冰箱保存。用于測定肝組織TC、TG、FFA及TNF-α含量,檢測方法同血液指標測定。

1.4.6肝組織11β- HSD1蛋白表達:取適量肝組織,提取組織蛋白進行Western blot檢測。14.7%分離膠、5%濃縮膠,60V電泳后轉膜2 h,室溫封閉2 h,以兔抗小鼠11β-HSD1多克隆抗體為一抗(1∶200 稀釋)4 ℃過夜,以羊抗兔IgG-HRP抗體為二抗(1∶800稀釋)室溫作用2 h,ECL檢測。實驗所得條帶,在Bandscan分析軟件中測得各自的總灰度值,進行定量分析,并用自身β-actin灰度值校正。
1.4.7肝組織病理學檢查:取適量新鮮肝臟,甲醛溶液固定,乙醇梯度脫水,切片,蘇木精-伊紅染色法(HE)染色,光學顯微鏡下觀察。參考非酒精性脂肪性肝炎(NASH)臨床研究評分系統[5],評價肝組織病變情況,即:脂肪變性(0~3分)、小葉炎癥(0~3分)、匯管區炎癥(0~1分)、肝細胞氣球樣變(0~2分)和肝組織纖維化(0~4分),評分標準見表1。

表1 NASH評分標準Table 1 NASH clinical research network scoring system
1.5 統計學分析
2 結果
2.1 一般情況
對照組食欲良好,體質量穩定增長,大便呈顆粒狀、黃而質硬,皮毛整潔,行動敏捷。模型組食欲減退,肥胖,大便呈顆粒狀、黑而質硬,毛色發黃且蓬亂,行動遲緩。與模型組比較,E1組體質量較模型組下降,大便質軟,皮毛微黃;E2組體質量下降更為明顯,大便質稀、不成形,皮毛微黃,行動較敏捷。
2.2 肝指數
各組大鼠肝指數檢測結果見圖1。與對照組比較,模型組及E1組肝指數顯著增大(P<0.01或P<0.05);與模型組比較,E1組及E2組肝指數均有下將趨勢,但只有E2組有顯著差異(P<0.05)。
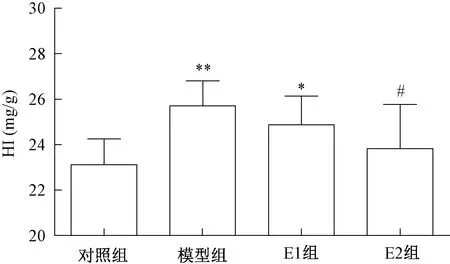
注:*P<0.05,**P<0.01,與對照組比較;#P<0.05,與模型組比較Note:*P<0.05,**P<0.01, compared with control group;#P<0.05, compared with model group圖1 各組大鼠肝指數Fig.1 Hepatic index (HI) in wistar rats
2.3 血液生化指標
肝功能、血糖、血脂、胰島素及TNF-α檢測結果見表2。與對照組比較,模型組大鼠AST、ALT、血糖、血脂、胰島素及炎性因子TNF-α水平均顯著升高(P<0.01);與模型組比較,E1組和E2組以上各項指標均有好轉趨勢,且E2組變化更為顯著(P<0.01或P<0.05)。說明模型組動物出現血糖、血脂紊亂,肝功能異常及炎性反應,而大黃素治療可有效改善以上病變,且高劑量組效果更明顯。同時HOMA-IR與胰島素耐量試驗結果很好吻合。
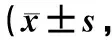
表2 各組大鼠血液生化指標結果Table 2 The serum parameters of wistar rats n=10)
2.4 肝指數及肝臟生化指標
肝指數、肝組織脂質沉積及TNF-α含量檢測結果見表3。與對照組比較,模型組大鼠肝指數顯著增大,出現明顯的肝脂質沉積,且肝TNF-α含量明顯升高(P<0.01);與模型組比較,E1組和E2組以上各項指標均有下降趨勢,且以E2組下降更為顯著(P<0.01或P<0.05)。
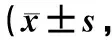
表3 各組大鼠肝生化指標結果Table 3 The hepatic tissue biochemical parameters of wistar rats n=10)
2.5 肝組織11β-HSD1基因及蛋白表達
與對照組比較,模型組和E1組肝組織11β-HSD1 mRNA及蛋白表達明顯升高 (P<0.01);與模型組比較,E1組和E2組肝組織11β-HSD1 mRNA及蛋白表達均顯著降低(P<0.05,P<0.01),且E2組變化更為顯著,結果見圖2。
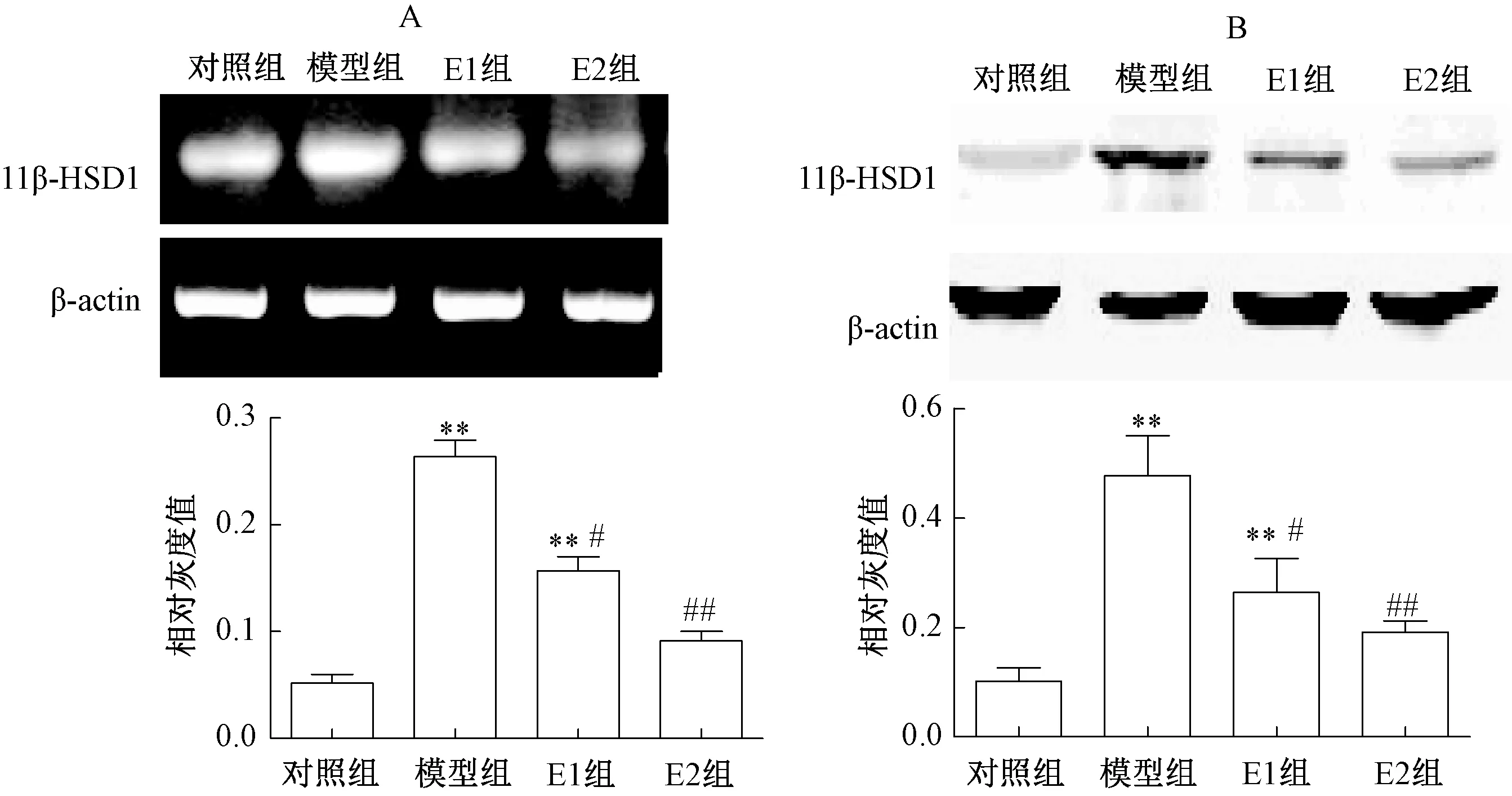
注:A:肝組織11β-HSD1基因表達結果;B:肝組織11β-HSD1蛋白表達結果;與對照組比較,**P<0.01;與模型組比較,#P<0.05,##P<0.01Note: A: The expression of 11β-HSD1 mRNA in liver; B: Western blot analysis of 11β-HSD1 in liver; Compared with control group,**P<0.01;Compared with model group,#P<0.05,##P<0.01圖2 各組肝組織11β-HSD1基因及蛋白表達結果Fig.2 The expression of 11β-HSD1 mRNA and protein in liver of wistar rats
2.6 肝組織切片
肝組織切片顯示:對照組大鼠肝細胞結構完整,肝小葉輪廓清晰,所有動物均未顯示脂肪變性及炎性反應;模型組大鼠脂肪變性明顯,可見匯管區炎性反應,并伴有輕度或中度肝細胞氣球樣變,部分發現肝組織纖維化;E1組大鼠脂肪變性程度減輕,部分發現匯管區炎性反應及輕度肝細胞氣球樣變,個別肝組織纖維化;E2組大鼠肝小葉結構清楚,個別出現輕度脂肪變性、匯管區炎性反應及肝細胞氣球樣變,未見肝組織纖維化。典型肝組織切片見圖3。
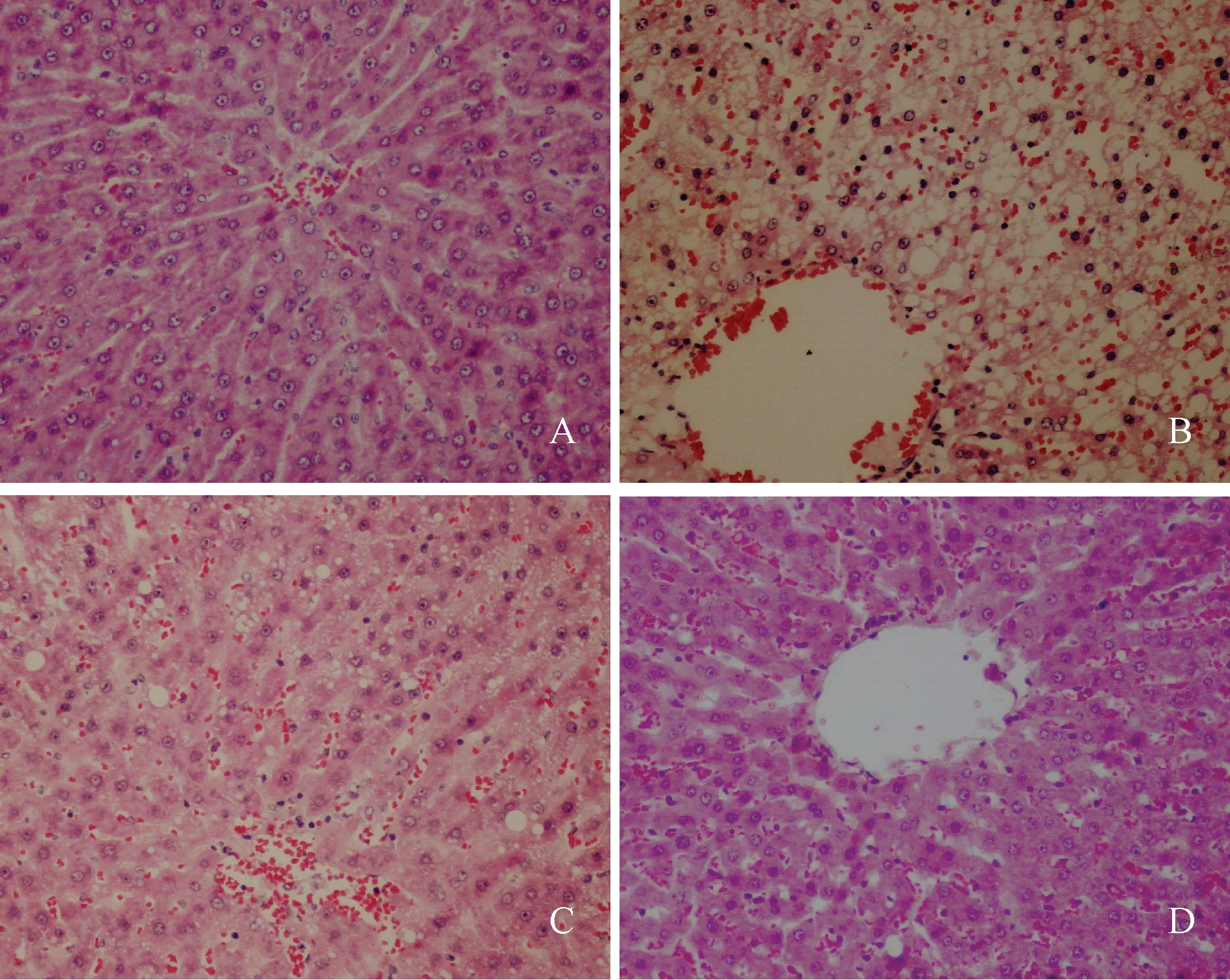
注:A:對照組;B:模型組;C:E1組;D:E2組Note: A: the control group; B: the model group; C: the E1 group; D: the E2 group圖3 大鼠肝病理切片Fig.3 Representative histopathological ndings in the liver of wistar rats (HE, ×200)
3 討論
NAFLD是代謝綜合征疾病譜中的重要一員,其發病機制尚未完全闡明,但現已證實其發病過程與胰島素抵抗密切相關。截至目前,并沒有針對NAFLD的特效治療藥物,多采用改善飲食結構、運動等行為方式改變,結合降脂藥物、胰島素增敏劑、抗氧化劑、保肝藥物等對癥治療[6-7]。
大黃是我國傳統中藥材,具有瀉熱通便、涼血解毒、逐瘀通經的功效。大黃素是中藥大黃的主要活性成分,屬游離型蒽醌類衍生物,具有瀉下、抗感染、抗菌、抗病毒、降脂、降壓和抗腫瘤等作用[8-9]。近年來,大黃素用于治療糖尿病、脂肪肝的報道日益增多,研究顯示其在改善糖脂代謝、胰島素抵抗狀態、肝臟脂質沉積等方面具有顯著作用[10],有學者認為這可能與其抑制炎性反應有關[11]。本課題前期研究發現,大黃素可以明顯改善胰島素抵抗大鼠的糖脂代謝水平和胰島素敏感性,抑制11β-HSDl基因及蛋白表達可能是其作用機制之一[12]。
11β-HSD1是一種低親和力、NADPH依賴的微粒體酶,在體內可以催化無活性的 17-羥-11脫氫皮質酮轉化成具活性的皮質醇,從而調節體內糖皮質激素水平來發揮生理效應[13]。11β-HSDl與代謝綜合征、2型糖尿病密切相關,11β-HSDl基因敲除可改善胰島素抵抗,11β-HSDl抑制劑可有類似效果。目前已知的天然 11β-HSD1 抑制劑主要包括:膽汁酸、孕激素的代謝產物、黃酮/羥基黃酮、生胃酮、大黃素、姜黃素以及越南割舌樹提取物cochinchinoid K等[14]。另外,許多研究者通過改變已知11β-HSD1 抑制劑的結構,人工合成了許多11β-HSD1 抑制劑,如BVT2733、INCB013739、MK0916、PF-915275等[15]。11β-HSD1 作為一個新的靶點已經成為近年來創新藥物研究的熱點。有文獻報道,大黃素可以通過選擇性的抑制11β-HSD1活性,降低空腹血糖水平,增加糖耐量,增加胰島素敏感性,有效改善胰島素抵抗狀態[16-17],這與本研究前期研究一致。
本次研究結果顯示,大黃素治療能夠顯著改善高熱量飼料喂養所致大鼠NAFLD,表現為:降低肝指數,改善肝功能,降低血脂及肝脂質沉積,減少炎性因子的釋放。肝組織切片觀察結果與指標檢測結果吻合,大黃素治療組肝脂肪變性、肝細胞氣球樣變、匯管區炎性反應、纖維化等NAFLD病理改變均有不同程度的改善。并且,大黃素高劑量組較大黃素低劑量組治療效果更為明顯,說明大黃素對NAFLD的治療作用呈劑量依賴性。同時,大黃素可有效抑制胰島素抵抗及肝組織內的11β-HSD1基因和蛋白表達量。推測,大黃素通過抑制體內11β-HSD1活性,改善胰島素抵抗狀態,進而發揮對NAFLD的治療作用。

