酰胺質子轉移加權成像與體素內不相干運動成像評估肺腺癌病理分級及其與SUVmax 的相關性
馮鵬洋,孟楠,方婷,董柏,楊陽,袁健閔,魏巍,王梅云,*,吳亞平
作者單位:1.河南大學人民醫院(河南省人民醫院)醫學影像科,鄭州 450003;2.鄭州大學人民醫院醫學影像科,鄭州 450003;3.河南省人民醫院骨科,鄭州 450003;4.北京聯影智能影像技術研究院,北京 100094;5.上海聯影醫療科技股份有限公司,上海 201815;6.河南省人民醫院醫學影像科,鄭州 450003
肺癌是目前全球患病率和病死率最高的惡性腫瘤[1],其中,肺腺癌已成為全世界最常見的組織學癌癥類型[2]。病理分級作為評估肺腺癌惡性程度的一個獨立的指標,其影響治療方式及判斷患者預后[3]。腫瘤分化程度越低,表明增長速度快,易發生轉移,預后不佳,因此能夠盡早預測肺腺癌的病理分級是亟待解決的問題。活檢目前是評估病理分級的主要手段,不僅會對身體造成醫源性損傷,而且臨床操作者的操作經驗、取樣位置、大小均會對病理分析造成誤差。體素內不相干運動成像(intravoxel incoherent motion, IVIM)包括雙指數模型和拉伸指數模型[4],前者主要反映水分子的擴散和灌注信息[5],后者主要反映組織的異質性[6]。酰胺質子轉移加權成像(amide proton transfer weighted imaging, APTWI)[7-8]可用于定量評估組織中多肽及游離蛋白質水平。正電子發射型電子計算機斷層掃描(positron emission tomography,PET)[9]能夠反映組織的代謝情況。已有研究表明,APTWI與IVIM可用于評估肺部良、惡性[10],表觀擴散系數(apparent diffusion coefficient, ADC)可用于肺腺癌分化程度的評估[11],同時,最大標準化攝取值(maximum standard uptake value, SUVmax)在不同病理分級中存在差異[12],但是APTWI與IVIM在病理分級中的對比研究鮮有報道。本研究旨在應用PET/MR[13],探討APTWI、IVIM及SUVmax在診斷肺腺癌病理分級中的價值,以期為肺腺癌的診斷和治療提供更多的幫助。
1 材料與方法
1.1 研究對象
本研究經河南省人民醫院倫理委員會批準(批準文號:2020116),全體受試者均簽署了知情同意書。前瞻性收集2020 年11 月至2021 年10 月經河南省人民醫院影像檢查懷疑為肺部腫瘤的患者,共95例患者進行胸部PET/MR檢查。納入標準如下:(1)PET/MR 檢查無禁忌證(起搏器、金屬支架、幽閉恐懼癥等);(2)PET/MR 掃描后1 周內獲得明確病理結果;(3)均為肺腺癌患者,病理分級明確。排除標準如下:(1)經手術或穿刺病理證實為鱗癌、小細胞肺癌、大細胞肺癌或非肺癌患者;(2)結節最大直徑小于1 cm 的患者;(3)圖像受偽影影響顯示不佳的患者;最終共66 例患者被納入,其中男34 例,女32 例,年齡34~79(61.5±10.36)歲。術后病理結果顯示高分化17 例,中分化22 例,低分化27 例。由于低分化腺癌較中高分化腺癌更容易發生腫瘤壞死及淋巴結轉移,預后不佳,因此本研究將高分化與中分化肺腺癌患者納入中高分化組,將低分化肺腺癌患者納入低分化組(表1)。
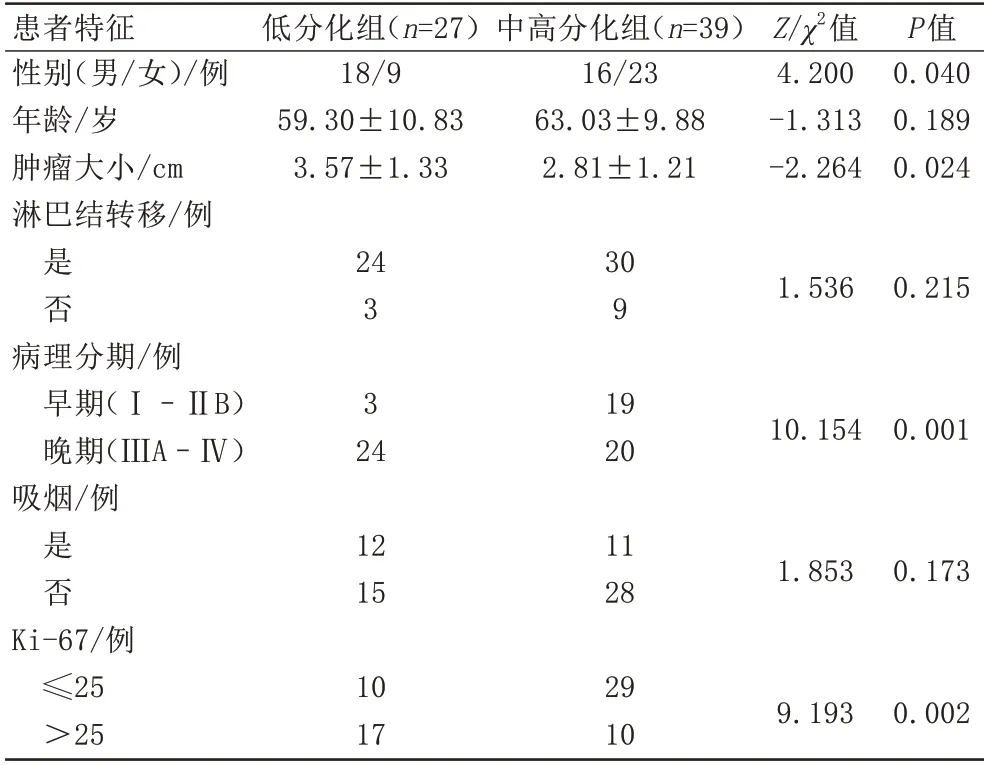
表1 肺腺癌患者基本信息Tab.1 Basic information of patients with lung adenocarcinoma
1.2 檢查方法
采用12 通道相控陣體線圈的3.0 T PET/MR 掃描儀(uPMR790,上海聯影醫療科技股份有限公司,上海,中國)進行掃描。患者檢查前需禁食6 h以上,晨起空腹血糖<6.5 mmol/L。掃描前再次確認患者未攜帶金屬物品,按標準劑量0.11 mCi/kg 靜脈注射PET 示蹤劑18F-FDG。胸部PET/MR 是在注射后靜息60 min 左右進行,要求患者仰臥位。掃描范圍為上界至中頸部,下界至上腹部(膈下2 cm),以完整覆蓋全肺為標準,使用呼吸導航以監測呼吸。PET 掃描采用1 個床位,采集時間為27 min,采用有序子集最大期望值迭代法重建圖像(迭代次數:2,子集:20,體素大小:2.6 mm×2.6 mm×2.0 mm)。在PET 掃描的同時,獲得二維軸位T1WI、T2WI、IVIM 及APTWI 序列圖像。T1WI掃描序列參數:2D-快速自旋回波(fast spin echo, FSE),TR 3.54 ms,TE 1.51 ms,層厚2 mm,FOV 400 mm×300 mm,矩陣304×100,層數35,NEX 1,掃描時間14 s;T2WI 掃描序列參數:2D-FSE,TR 3315 ms,TE 90.2 ms,層厚5 mm,FOV 380 mm×300 mm,矩陣320×70,層數42,NEX 2,掃描時間2.26 min;IVIM掃描序列參數:平面回波成像(echo planar imaging,EPI),TR 3315 ms,TE 90.2 ms,層厚5 mm,FOV 400 mm×300 mm,矩陣128×100,層數10,b=0、25、50、100、150、200、400、600、800、1000 s/mm2,NEX 1、1、2、2、4、4、6、6、8 和10,掃描時間3.38 min;APTWI 掃描序列參數:2D-FSE,TR 4500 ms,TE 54.72 ms;層 厚5 mm,FOV 400 mm×300mm,矩陣128×100,層數1,NEX 1,掃描時間3.15 min,ETL 39,B1 1.3 μT 和2.5 μT,高斯脈沖,收集WASSAR圖像用于S0圖的校正。
1.3 圖像處理及分析
將所采集到的PET 和IVIM 圖像導入聯影工作站(UWS-MR:R005),利用高級軟件包進行處理。所有的APTWI 圖像傳入個人計算機,使用非對稱磁化轉移率(magnetization transfer ratio asymmetry, MTRasym)測量軟件進行分析。將IVIM各參數的偽彩圖與擴散加權成像(diffusion weighted imaging, DWI)圖像相融合,以軸位T1WI 和T2WI 圖像為參考,對IVIM 各參數的偽彩圖及MTRasym 偽彩圖上具有腫瘤實性部分的所有層面沿腫瘤邊緣內側手動繪制感興趣區(region of interest, ROI),從而獲得擴散系數(D)、假擴散系數(D*)、灌注分數(f)、擴散分布指數(distributed diffusion coefficient, DDC)、擴散異質性指數(α)及非對稱磁化轉移率[MTRasym(3.5 ppm)]值。繪制ROI 時,注意避開明顯出血、壞死、鈣化及囊變等區域并取三次測量值的平均值作為結果。工作站的后處理軟件自動提取PET 的腫瘤感興趣體積(volume of interest, VOI),從而計算出腫瘤的SUVmax 值。以上均由兩位放射科醫師(分別為5 年和12 年胸部影像學診斷經驗的主治醫師和副主任醫師)在未知組織病理學結果的情況下,獨立繪制ROI及測量定量參數值。
1.4 統計學分析
采用SPSS23.0 以及Medcalc15.0 軟件對數據統計學分析。組內相關系數(intraclass correlation coefficient, ICC)用于評價兩名放射科醫師間測量結果的一致性。采用Shapiro-Wilk 檢驗各參數值是否服從正態分布。采用Mann-WhitneyU檢驗比較中高分化、低分化組間各參數的差異。采用Pearson 相關分析探討各參數與SUVmax 間的相關性。受試者工作特征(receiver operating characteristic, ROC)曲線被用來評估診斷效能。Delong檢驗用于分析每個參數下的ROC 曲線下面積(area under the curve, AUC)是否存在顯著差異。P<0.05為差異具有統計學意義。
2 結果
2.1 一致性分析
兩位醫師所測MTRasym(3.5 ppm)、D、D*、f、DDC、α 值均具有較高的一致性,ICC 分別為0.932、0.872、0.767、0.819、0.842、0.791。取二者的平均值作為最終結果納入本研究。
2.2 參數對比
APTWI、IVIM 和18F-FDG PET 各參數偽彩圖見圖1。低分化組的MTRasym(3.5 ppm)、f 值顯著高于中高分化組,而 D、DDC 值顯著低于中高分化組(P均<0.05)。低分化與中高分化組間D*、α 值的差異無統計學意義(表2)。
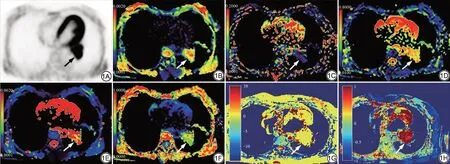

圖1 患者女,52 歲,左肺下葉中分化腺癌(箭)。1A:PET 軸位圖像, SUVmax=3.84;1B:D 偽彩圖,D=1.21×10-3 mm2/s;1C:D*偽彩圖,D*=23.98×10×10-3 mm2/s;1D:f 偽彩圖,f=23.00%;1E:DDC 偽彩圖,DDC=0.621×10-3 mm2/s;1F:α 偽彩圖,α=1.672;1G:B0 偽彩圖;1H:MTRasym 偽彩圖,MTRasym(3.5 ppm)=1.45%;1I:病理圖片(HE×100)。PET:正電子發射型電子計算機斷層掃描;SUVmax:最大標準化攝取值;D:擴散系數;D*:假擴散系數;f:灌注分數;DDC:擴散分布指數;α:擴散異質性指數;MTRasym(3.5 ppm):非對稱磁化轉移率。Fig. 1 Male, 52 years, with moderately differentiated adenocarcinoma of the left lower lobe (arrows). 1A is PET axial image;1B is D pseudo-colored maps,D=1.21×10-3 mm2/s;1C is D*pseudo-colored maps,D*=23.98×10×10-3 mm2/s;1D is f pseudo-colored maps, f=23.00%; 1E is DDC pseudo-colored maps, DDC=0.621×10-3 mm2/s; 1F is α pseudo-colored maps,α=1.672;1G is the B0 pseudo-colored maps;1H is the MTRasym pseudo-colored maps, MTRasym (3.5 ppm) =1.45%; 1I is pathological images (HE ×100). PET: positron emission tomography; SUVmax: maximum standard uptake value; D:diffusion coefficient;D*:false diffusion coefficient;f:perfusion fraction;DDC:distributed diffusion coefficient;α:diffusion heterogeneity index.

表2 肺腺癌低分化組與中高分化組間各參數值的比較Tab.2 Comparison of parameters between poorly differentiated group and moderately/well differentiated group of lung adenocarcinoma
2.3 診斷效能評估
不同參數鑒別肺腺癌低分化和中高分化的診斷效 能 如 下:AUC [MTRasym(3.5 ppm)]>AUC(D)>AUC(DDC)>AUC(f)>AUC(α)>AUC(D*)(AUC=0.858、0.743、0.661、0.645、0.577、0.531)。MTRasym(3.5 ppm)的診斷效能顯著高于除D 值以外的其他參數(P均<0.05),同時,MTRasym(3.5 ppm)具有最佳的特異度(92.59%)。
不同方法及其組合鑒別肺腺癌低分化和中高分化的診斷效能如下:AUC(APTWI+IVIM)>AUC(IVIM)>AUC(APTWI)(AUC=0.973、0.903、0.858)。APTWI聯合IVIM的診斷效能顯著高于單獨成像方法(P均<0.05),而IVIM與APTWI的AUC的差異無統計學意義(圖2~3,表3)。
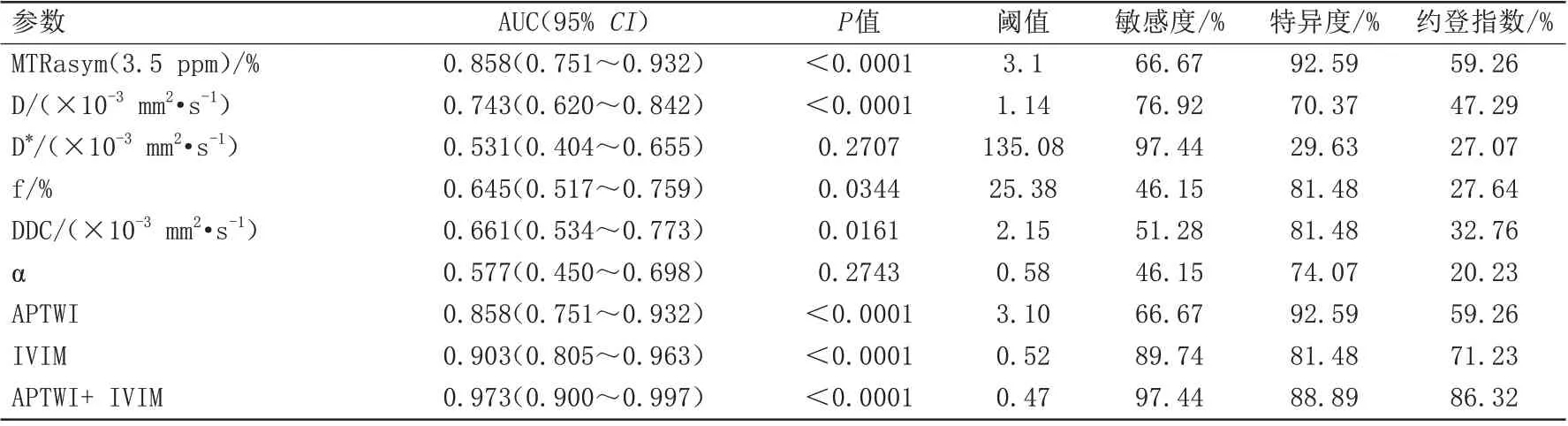
表3 不同參數單獨或聯合鑒別診斷低分化組與中高分化組的效能分析Tab.3 Efficacy analysis of different parameters alone or combined in differential diagnosis of poorly differentiated group and moderately/well differentiated group

圖2 各參數診斷肺腺癌病理分級的受試者工作特征(ROC)曲線。圖3 不同方法及聯合診斷肺腺癌病理分級的ROC曲線。MTRasym:非對稱磁化轉移率;D:擴散系數;D*:假擴散系數;f:灌注分數;DDC:擴散分布指數;α:擴散異質性指數;APTWI:酰胺質子轉移加權成像;IVIM:體素內不相干運動成像。Fig. 2 Graph shows receiver operating characteristic (ROC) curves of different parameters for discriminating pathological grade of lung adenocarcinoma. Fig. 3 Graph shows ROC curves of different methods and combined methods for discriminating pathological grade of lung adenocarcinoma. MTRasym: maximum standard uptake value; D: diffusion coefficient; D*: false diffusion coefficient; f: perfusion fraction; DDC:distributed diffusion coefficient; α: diffusion heterogeneity index; APTWI:amide proton transfer weighted imaging;IVIM:intravoxel incoherent motion.
2.4 相關性分析
MTRasym(3.5 ppm)與SUVmax 值呈弱正相關(r=0.396,P=0.001)。D、DDC 值分別與SUVmax 值呈弱負相關(r=-0.359,-0.249,P=0.003,0.044)。D*、α 值與SUVmax無相關性(P>0.05)(圖4)。
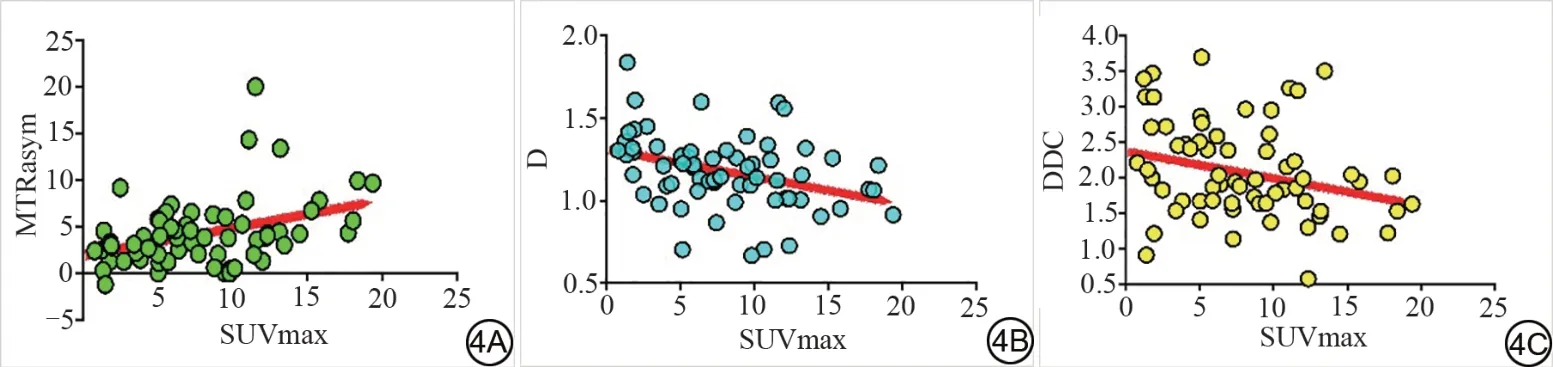
圖4 不同參數與最大標準化攝取值(SUVmax)相關性分析。4A:SUVmax與非對稱磁化轉移率(MTRasym)值間的相關性;4B:SUVmax與擴散系數(D)值間的相關性;4C:SUVmax與擴散分布指數(DDC)值間的相關性。Fig. 4 Correlation analysis between different parameters and maximum standard uptake value(SUVmax).4A:Correlation between SUVmax and magnetization transfer ratio asymmetry (MTRasym) values; 4B: Correlation between SUVmax and D values; 4C: Correlation between SUVmax and distributed diffusion coefficient(DDC)values.
3 討論
IVIM相較于單指數模型DWI可以更真實地反映水分子的微觀運動,APTWI 作為近年來新型的分子影像學技術,能夠通過檢測游離蛋白和多肽的含量來反映病灶的特征。本研究不僅使用新技術對肺腺癌的病理分級進行鑒別,同時還將兩種技術的對比和聯合應用進行探討,這將為肺腺癌患者的臨床診斷和預后評估提供新的見解。
3.1 IVIM在肺腺癌病理分級中的研究價值
D、DDC 值是IVIM 用于反映水分子的運動擴散情況的參數[14-15],前者主要代表了純水分子的擴散,而后者主要反映體素內ADC 值的連續分布情況。本研究中低分化組的D、DDC值均顯著低于中高分化組,這與前人的研究相類似[6],進一步表明D、DDC 值可以用于不同分化程度肺腺癌的鑒別。解釋其原因,D、DDC值均受腫瘤細胞密度的影響,低分化的肺腺癌細胞侵襲性強,腫瘤細胞排列密集,造成水分子擴散受限,因此低分化組的D、DDC 值更小。D*與f 值均是反映微循環灌注情況的兩個重要指標,理論上,低分化組的肺腺癌惡性程度更高,血供更豐富,腫瘤灌注水平更高,D*與f 值會增高。然而D*與f 值的可靠性一直存在爭議,魏毅等[16]在肝癌的病理分級研究中,認為f 與D*值均無意義。Ma 等[17]在胰腺導管腺癌病理分級中發現中高分化的f 值顯著高于低分化,D*值差異無統計學意義。本研究顯示,低分化組的f值顯著高于中高分化組,D*值差異無統計學意義,表明f 值可以用來反映腫瘤組織的血流灌注特性。造成上述差異的可能原因:(1)低分化腫瘤微循環豐富,但豐富的毛細血管血流易受壓減速,兩者比例不同會使灌注參數產生差異;(2)D*對信噪比變化非常敏感,從而限制了擬合效果[18]。α 值反映水分子擴散的不均質性,與病變成分的復雜程度相關。本研究發現α值不能區分肺腺癌病理分級,這可能與勾畫ROI時將囊變及壞死區域排除[19],影響了腫瘤的異質性有關,同時,本試驗病例數有限,組間樣本量不均衡也對結果產生一定影響。
3.2 APTWI在肺腺癌病理分級中的研究價值
MTRasym(3.5 ppm)值是APTWI 用于反映腫瘤組織內游離蛋白和肽類含量的參數[20-21]。Su 等[22]及Meng 等[23]分別探索了MTRasym(3.5 ppm)值在鑒別不同分級膠質瘤和子宮內膜癌中的價值,其結果均顯示由于低分化腫瘤往往擁有更大的細胞密度,更多的組織壞死,因此其內部合成蛋白質及多肽的量明顯增加[24],MTRasym(3.5 ppm)值往往增大。在本研究中,低分化組的MTRasym(3.5 ppm)值顯著高于中高分化組[25],這與上述研究結果相一致,表明MTRasym(3.5 ppm)值可以有效鑒別不同病理分級的肺腺癌。
3.3 各參數及不同技術聯合的診斷效能分析
本研究結果顯示,MTRasym(3.5 ppm)在診斷病理分級的AUC 最高,并顯著高于除D 值外的其他參數,表明相對于IVIM,APTWI 對鑒別肺腺癌病理分級更有明顯的優勢。解釋可能的原因,組織微觀結構的復雜性會導致水分子并不符合高斯分布,IVIM 雖然能將擴散與灌注相分離,但僅能部分反映真實水分子的運動狀態,同時IVIM 的灌注參數受信噪比變化、b 值的選擇的影響較大[18,26]。然而APTWI 卻不受上述因素的影響,并且可以更準確地從分子角度提供腫瘤微環境不同方面的信息。APTWI 在肺部的應用極少,Fang 等[10]研究發現,APTWI 技術可用在肺癌良、惡性及鱗、腺癌的鑒別診斷中,并且APTWI的診斷效能較D、f、D*值更加出色,與本研究結果類似。目前,多技術聯合應用已成為熱點[27],我們將APTWI 聯合IVIM 進行AUC 分析,發現鑒別肺腺癌病理分級的診斷效能得到了顯著提高,說明這種聯合可以更全面反映腫瘤細胞的代謝及生理信息,將為臨床診斷提供更可靠的參考價值。
3.4 SUVmax與各參數值的相關性分析
SUVmax是反映腫瘤葡萄糖代謝程度最常用的半定量指標[9,28]。本研究中,SUVmax 值與MTRasym(3.5 ppm)值呈弱正相關,與D、DDC 值呈弱負相關,表明腫瘤的代謝活性與細胞微環境存在相關性。分析其原因,較高的SUVmax 值反映了腫瘤細胞的增殖能力較強[12],活躍增殖的腫瘤細胞導致細胞密度增大,細胞間隙減小,水分子擴散受限,同時此過程會合成更多的游離蛋白質及多肽[29],故MTRasym(3.5 ppm)值增高且D 值、DDC 值降低。α 值越低,表明微觀結構異質性越大,腫瘤惡性程度更高,SUVmax 值越大,但研究并未發現兩者之間存在顯著相關性,認為這可能與SUVmax僅代表腫瘤單一維度的生物學特征[30],α 值的變異度較高[31],勾畫的ROI 存在誤差及樣本量有限等因素均有關。此外,SUVmax與f值沒有顯著相關性可能是因為f值受干擾因素過多,隨著腫瘤惡性程度增高,相伴而來的充血、水腫等良性反應也會增多[32],因此f值具有更大可變性。
3.5 局限性
這項研究存在一些局限性:首先,本實驗樣本量較小,未能把中分化與高分化分開進行差異對比,因此尚需大樣本研究來進一步驗證實驗結果;第二,腫瘤直徑小于1 cm以及受呼吸運動偽影而造成圖像顯示不清的患者被排除在外;第三,勾畫ROI時將壞死、囊變區域排除在外在一定程度上影響了α值的準確性。
綜上所述,APTWI和IVIM均可用于肺腺癌病理分級的無創評估,與IVIM 參數相比,APTWI 參數的診斷效能更高,部分參數與SUVmax 存在一定的相關性。此外,這兩種方法的聯合可顯著提高鑒別肺腺癌病理分級的診斷效能,這將為臨床診斷提供更多可參考的信息。
作者利益沖突聲明:全體作者均聲明無利益沖突。

