血清CysC、NGAL、KIM-1對靜脈-動脈體外膜肺氧合患者發生急/慢性腎衰竭和死亡的預測價值*
李治君,吳 松,李 成
1.三二〇一醫院檢驗科,陜西漢中 723000;2.陜西省寶雞市中心醫院檢驗科,陜西寶雞 721008
有研究表明,使用體外膜肺氧合(ECMO)支持可以提高重癥患者的生存率[1],然而這些治療心源性休克和心臟驟停的方法也為評估死亡率和發病率帶來了新的變數,如腎功能障礙[2-4]。在接受靜脈-動脈體外膜肺氧合(VA-ECMO)支持的患者中,因急性腎損傷(AKI)需要腎替代治療(RRT)與生存率顯著降低和VA-ECMO脫機失敗相關[5-7],其發生原因可能與基礎疾病相關的血流動力學改變或者VA-ECMO本身導致的多種機制變化有關[8]。確定VA-ECMO患者腎功能障礙的預測因素可能有助于改善重癥患者的預后。臨床用于評估腎功能最常用的實驗室指標是血清肌酐(SCr)[9]。最近,一些新的生物標志物如胱抑素C(CysC)、中性粒細胞明膠酶相關脂質運載蛋白(NGAL)、腎損傷分子-1(KIM-1)等也被引入[9-13]。雖然已經觀察到這些生物標志物與不同的心臟狀況之間的關聯,但是目前還缺少關于這些新的生物標志物在接受VA-ECMO支持的難治性心源性休克患者中的變化數據。因此,本研究旨在評估CysC、NGAL、KIM-1對于難治性心源性休克患者接受VA-ECMO支持后出現急/慢性腎衰竭及90 d內死亡的預測價值。現報道如下。
1 資料與方法
1.1一般資料 選取2017年6月至 2020年12月在三二〇一醫院接受VA-ECMO治療的196例難治性心源性休克患者作為研究對象,根據隨訪90 d后的結局將患者分為生存組(107例)和死亡組(89例)。納入標準:(1)年齡≥18歲;(2)在脫離體外循環(CPB)且被轉移到重癥監護病房(ICU)后不得不接受VA-ECMO支持的心臟手術患者;(3)VA-ECMO支持時間≥48 h;(4)有完整的可追蹤的電子病歷報告。排除VA-ECMO支持時間≤48 h、術前接受VA-ECMO治療者、心臟手術前或使用VA-ECMO前已經出現腎功能障礙者、臨床數據缺失者。本研究經三二〇一醫院醫學倫理委員會審查通過,患者或家屬均簽署知情同意書。
1.2方法
1.2.1持續腎替代治療(CRRT) 急性腎臟損傷網絡(AKIN)標準定義了AKI的3個階段[14]。1期為SCr在48 h內比基線增加0.3 mg/dL(26.2 μmol/L)或1.5~2.0倍,這被建議作為AKI的閾值。而SCr水平增加2~3倍則被定義為2期。若SCr較基線水平增加≥300%,血清肌酐增加≥4.0 mg/dL或啟動RRT 則被納入3期。所有符合AKIN 3期標準的患者均接受CRRT。
1.2.2VA-ECMO回路 使用的VA-ECMO回路由Quadrox氧合器(美國Maquet公司)和Rotaflow離心泵(美國Maquet公司)或CentriMag離心泵(美國Thoratec公司)組成,兩個回路都由肝素包裹。除了在心肺復蘇(ECPR)下放置VA-ECMO的患者外,其他患者在VA-ECMO插管之前放置Swan-Ganz導管。在出現以下情況時考慮進行VA-ECMO插管:在兩種血管收縮劑的支持下,心臟指數小于2.2 L/(min·m2)的難治性心源性休克,有終末器官灌注不足的跡象[如血清乳酸(LAC)升高、低尿量和缺血性肝炎]和(或)存在長期低血壓[收縮壓<90 mm Hg或平均動脈壓(MAP)<65 mm Hg]。在大多數患者中,VA-ECMO是由重癥監護醫師經皮放置的,在股動脈中常規放置遠端灌注套管。對符合脫機標準并通過VA-ECMO脫機試驗的患者進行脫機,同時測量心輸出量、心臟指數、MAP和中心靜脈壓(CVP),并進行超聲心動圖檢查,測量速度時間積分(VTI)和左室射血分數(LVEF)[12]。如果患者在VA-ECMO前接受主動脈內球囊反搏(IABP)支持,則在VA-ECMO插管時或VA-ECMO插管后24 h內取出球囊泵。當VA-ECMO回路顯示低流量時[血紅蛋白(Hb)水平<10 mg/dL或血流動力學穩定但Hb水平低于<7 mg/dL]則予以輸血[15]。
1.3觀察指標 主要研究終點是VA-ECMO使用期間急性腎衰竭和使用VA-ECMO后90 d需要CRRT的慢性腎衰竭,次要終點是90 d病死率。預先指定的協變量包括年齡、性別、體質量指數(BMI)、血漿游離血紅蛋白(FHb)水平、SCr、NGAL、KIM-1、LAC、Hb、總膽紅素(TBIL)、VA-ECMO使用期間輸血量、IABP或作為VA-ECMO期間額外的中間心臟設備的Impella?。研究中包括的SCr、NGAL、KIM-1、LAC、Hb和TBIL的基線水平在VA-ECMO插管前或之后即刻采集。在整個VA-ECMO使用過程中,每天檢測血清CysC、NGAL、KIM-1水平;使用美國Beckman-Coulter公司AU5800型全自動生化儀檢測血清CysC水平,檢測原理為免疫比濁法,試劑盒購自武漢博士德公司;采用酶聯免疫吸附測定法檢測血清NGAL、KIM-1水平,試劑盒購自中生北控生物公司。
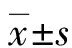
2 結 果
2.1兩組患者基線資料比較 生存組與死亡組患者年齡、性別比例、BMI、VA-ECMO使用時間、休克原因比較,差異均無統計學意義(P<0.05),見表1。
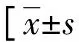
表1 兩組患者基線資料比較或M(P25,P75)或n(%)]
2.2兩組患者血清CysC、NGAL、KIM-1水平變化 根據兩因素重復測量的方差分析,生存組和死亡組患者血清CysC、NGAL、KIM-1水平隨時間變化的趨勢差異有統計學意義(P<0.05)。死亡組患者基線、24 h、72 h時血清CysC、NGAL水平均高于生存組(P<0.05);此外,雖然兩組KIM-1基線水平差異無統計學意義(P>0.05),但是24 h和72 h時死亡組血清KIM-1水平亦高于生存組(P<0.05)。見表2。
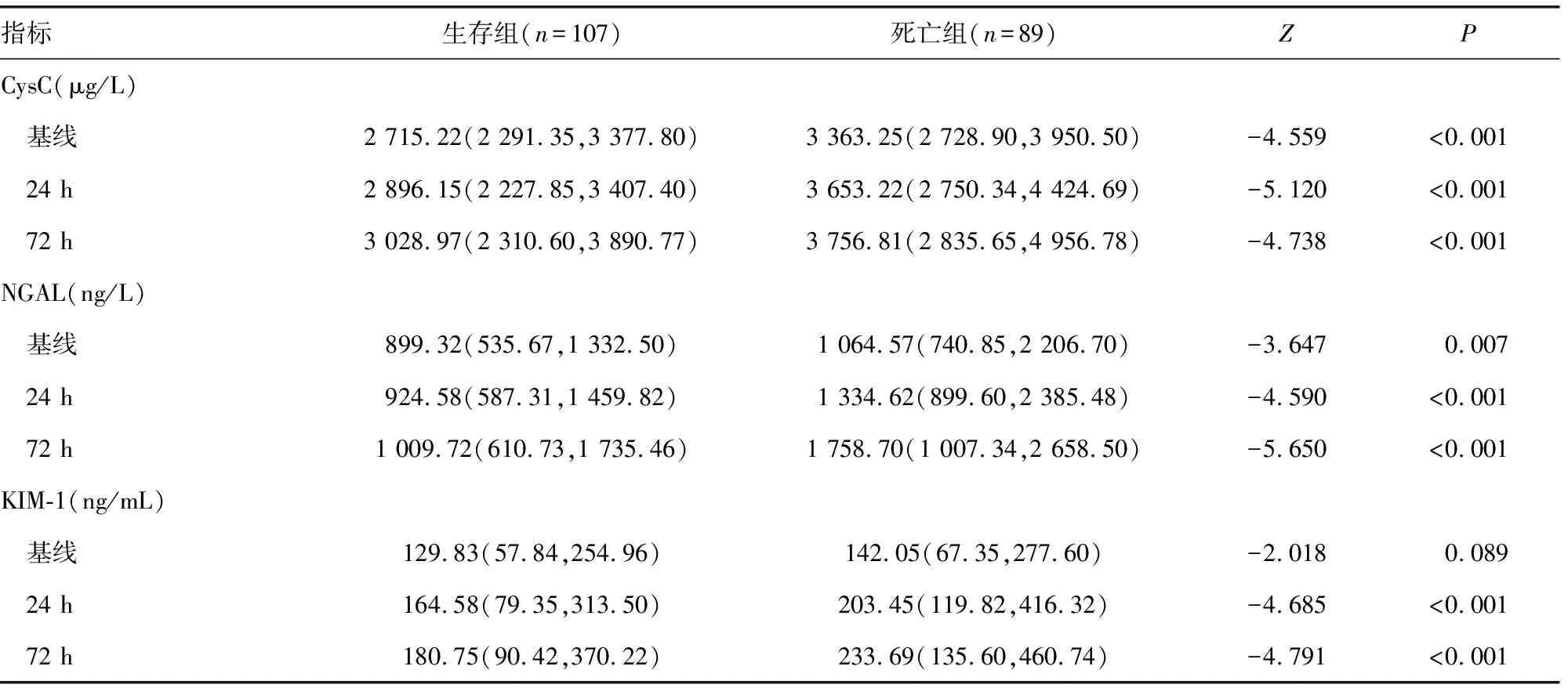
表2 VA-ECMO患者血清CysC、NGAL、KIM-1水平變化趨勢[M(P25,P75)]
2.3血清基線CysC、NGAL、KIM-1水平對VA-ECMO患者90 d死亡風險的預測價值 經ROC曲線分析,基線血清CysC、NGAL、KIM-1預測90 d死亡風險的AUC分別為0.842(95%CI:0.783~0.902)、0.795(95%CI:0.729~0.861)、0.740(95%CI:0.673~0.808)。見圖1。
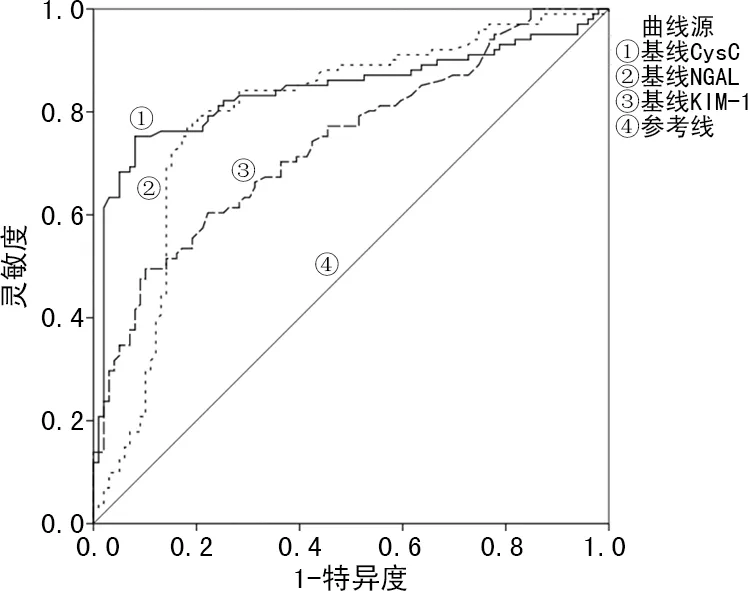
圖1 血清基線CysC、NGAL、KIM-1預測VA-ECMO患者90 d死亡風險的ROC曲線
2.4影響VA-ECMO患者90 d死亡風險的臨床因素分析 經單因素和多因素Logistic回歸分析,影響90 d死亡率的危險因素包括年齡≥65歲、基線CysC≥2 960.50 μg/L、基線NGAL≥977.50 ng/L、基線LAC≥4.3 mmol/L及VA-ECMO前未使用IABP。見表3。
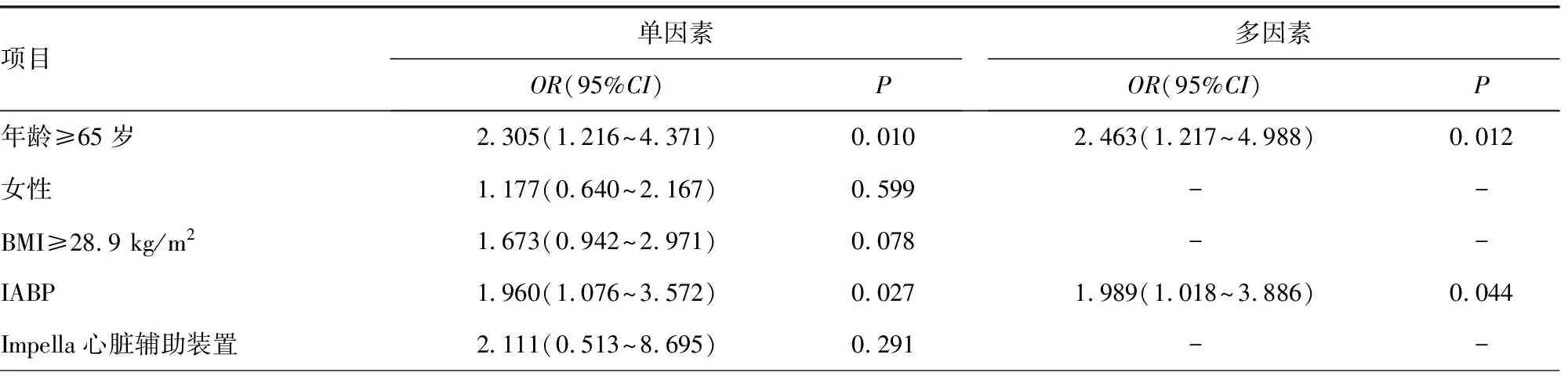
表3 影響VA-ECMO患者90 d 死亡風險的臨床因素分析
2.5影響VA-ECMO患者急/慢性腎衰竭的臨床因素分析 共有82例患者(41.80%)發生急性腎衰竭(AKIN 3期),均接受CRRT治療。在107例存活≥90 d的患者中,11例(10.28%)出現慢性腎衰竭(需要CRRT)。經單因素和多因素Logistic回歸分析,基線FHb、CysC、NGAL、LAC水平和VA-ECMO期間需要的輸血量是急性腎衰竭的重要預測因子(P<0.05)。尚未發現與90 d慢性腎衰竭相關的獨立預測因子(P>0.05)。見表4、5。
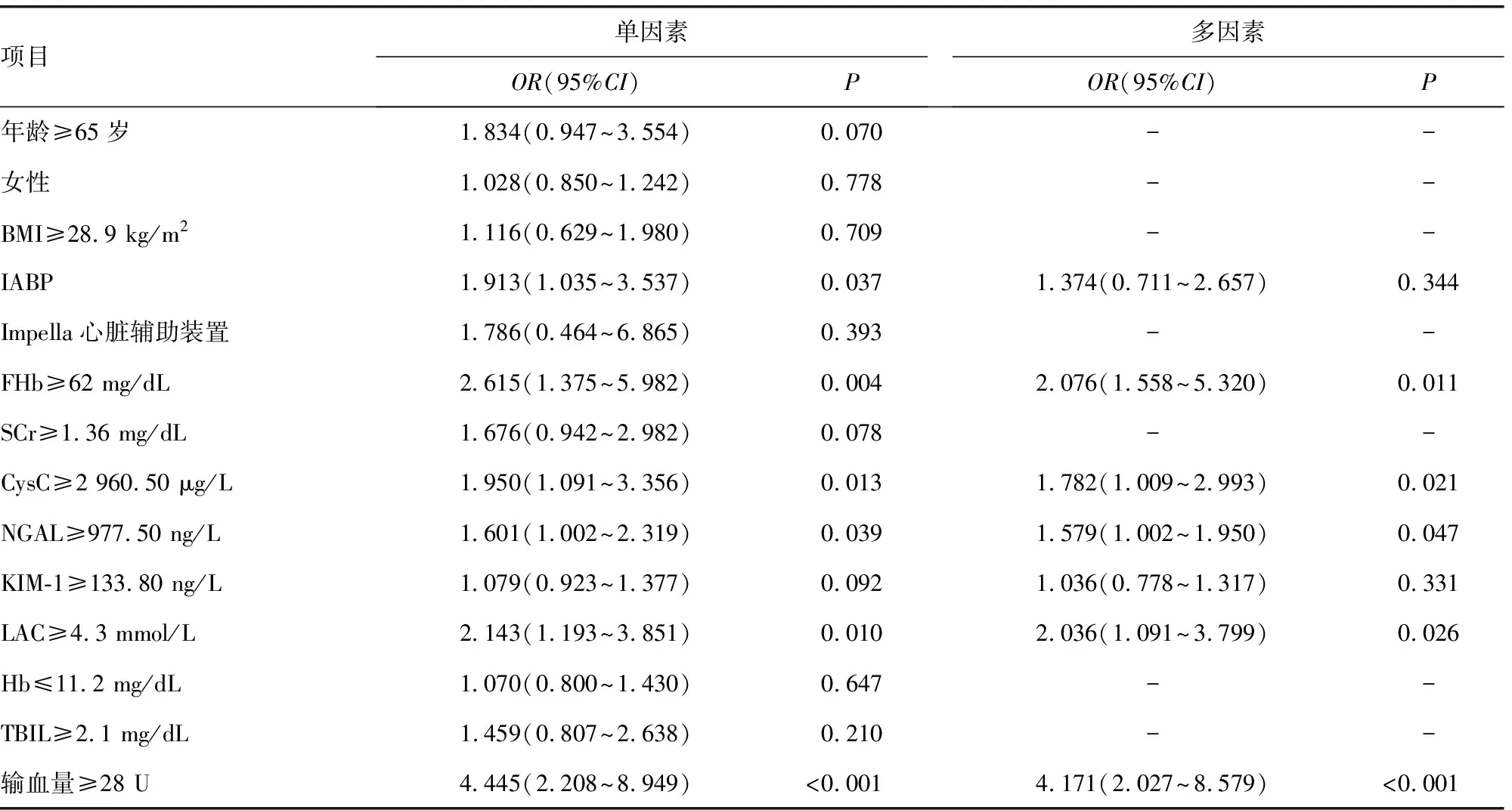
表4 單因素和多因素模型分析VA-ECMO患者發生急性腎衰竭的預測因子
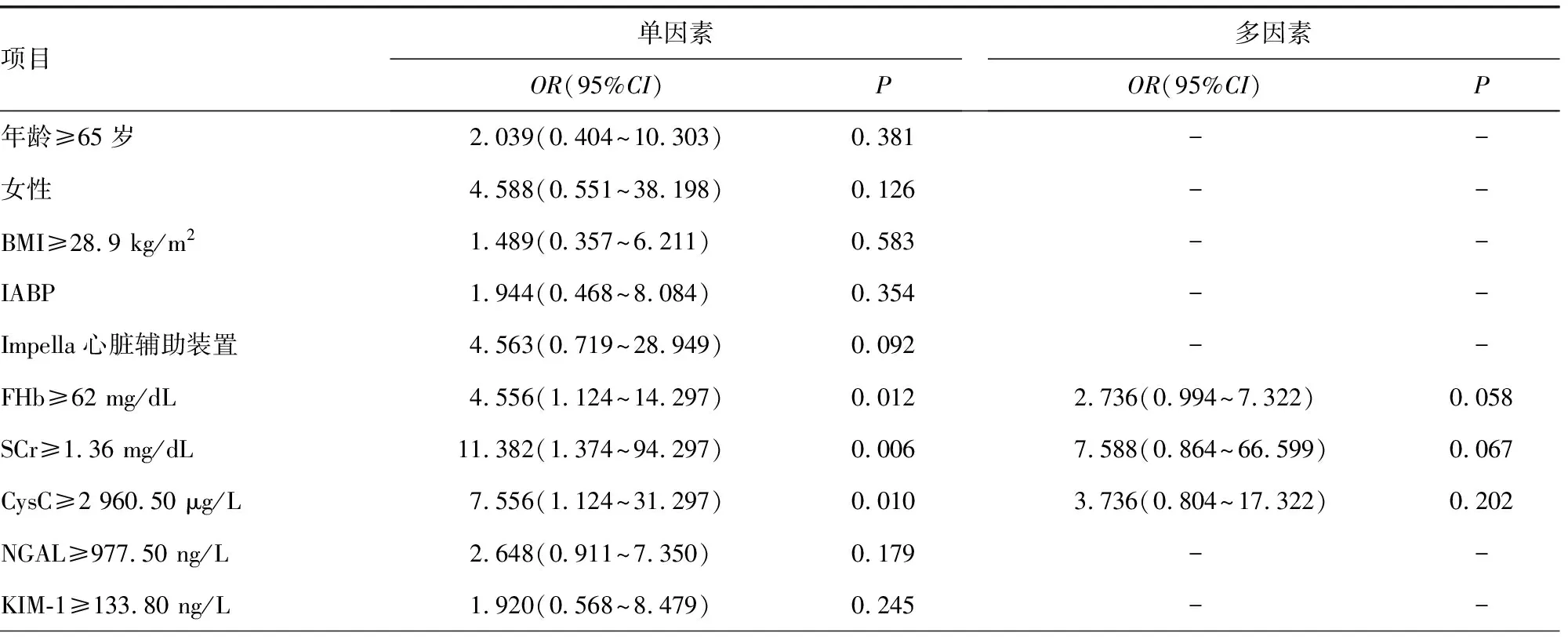
表5 單因素和多因素模型分析VA-ECMO 患者VA-ECMO后90 d內發生慢性腎衰竭的預測因子
3 討 論
目前,關于VA-ECMO患者腎衰竭預測因子的報道較為少見。在本研究中,VA-ECMO支持期間的急性腎衰竭發生率為41.80%,與其他文獻中報道中43%~52%的比例相當[16-18]。急性腎衰竭的病因可能包括多種病理生理機制,如腎供氧減少和(或)炎性損傷分子的大量產生。這些機制通常是由于患者及與基礎疾病和VA-ECMO循環相關的血流動力學改變引起的[8,10-13]。在這些潛在機制的背景下,本研究證實CysC、NGAL等指標有望成為患者需要CRRT或90 d死亡的有效預測因子。
腎衰竭是VA-ECMO患者中一種非常常見的并發癥,常用于預后評估[3]。發生AKI的患者通常在ICU停留的時間延長,且院內病死率明顯提高。CysC是一種參與細胞內蛋白質和多肽分解代謝的內源性半胱氨酸蛋白酶抑制劑,可被腎小球自由過濾,并能夠被近端腎小管細胞完全吸收和降解,而腎小球濾過率降低則可導致血清CysC的大量蓄積[10]。因此,血清CysC水平升高已被證明是腎功能急劇惡化的敏感指標之一。一項大型薈萃分析表明,CysC是比SCr更好的預測心血管疾病原因和終末期腎病死亡風險的重要指標[19]。這可能是因為與SCr相比,血清CysC的生命周期更短,且在腎損傷早期就會大量釋放,能夠比SCr更早地反映腎功能下降,更適用于急重癥患者。此外,SCr與腎功能之間的關系通常受血液稀釋、肌肉質量、營養、年齡和性別的影響[9]。而血清CysC水平受這些因素影響的可能性較小,可更可靠和更有效地反映早期腎功能損傷。NGAL是一種相對分子質量為25×103的蛋白分子,屬于Lipocalin超家族成員。雖然它可能由不同類型的人體組織細胞分泌(主要是上皮細胞和中性粒細胞),但在腎臟中,NGAL主要表達于Henle環和腎臟集合管的粗大上升支[11-12]。另外,KIM-1主要反映近端腎小管損傷,可由腎缺血引起跨膜蛋白表達上調,在健康受試者的尿液中幾乎檢測不到,但在患有急性腎小管壞死的患者中,KIM-1會大量增加[20]。本研究亦證實,NGAL和KIM-1是VA-ECMO患者中一個非常敏感的腎損傷生物標志物,而且與CysC一樣,血清NGAL、KIM-1水平升高一般發生在損傷后2 h內,相較于SCr能夠更早地預測腎功能障礙。但是本研究并未發現CysC、NGAL、KIM-1這些新的腎損害預測因子與慢性腎衰竭的獨立相關性。
體外回路將血液暴露于非生理表面和機械應力之下,這會導致多個酶級聯的激活和紅細胞的裂解。這些事件的結合會形成活性形式的氧,如過氧化氫(H2O2)。H2O2可以與Hb反應釋放氧化還原活性形式的鐵,其具有細胞毒性并可能導致腎衰竭[14-15]。因此在本研究中,基線LAC水平升高是急性腎衰竭及90 d死亡風險的一個預測因子,這與既往的多數研究結果基本一致[21]。此外,急性腎衰竭患者的輸血量顯著增加,但是它并不能作為慢性腎衰竭的預測因子。在心臟手術患者中,術中和圍手術期輸血量與術后AKI風險增加獨立相關。一般而言,大量輸注紅細胞對腎衰竭的影響有兩種可能的解釋:(1)輸血會增加溶血風險,這是由于供體和受體細胞類型之間不同類型的免疫不相容性引起的免疫反應引起的,溶血可導致嚴重的腎臟后遺癥。(2)紅細胞在儲存過程中發生不可逆的生化變化,因此可促進輸血后的促炎狀態,并且加劇組織氧化應激,進而導致AKI[8]。此外,LAC也是急性腎衰竭的重要預測指標,但不是慢性腎衰竭的重要預測指標。LAC作為反映終末期器官灌注的重要參數之一,在灌注不良的情況下,腎臟是最敏感的器官之一[21],然而LAC在單因素分析中的意義未能在多因素分析中得到證實。本研究是一項樣本量有限的單中心回顧性研究,因此在后續的研究中需要進一步擴大樣本量以證實血清CysC、NGAL、KIM-1與難治性心源性休克患者預后的關系。此外,使用VA-ECMO前和期間出現顯著低血壓的頻率和持續時間可能在腎衰竭的進展方面也發揮額外的作用。但是本研究中的患者因難治性心源性休克(通常包括顯著的低血壓)而接受VA-ECMO,在此治療期間,大多數患者MAP>65 mm Hg。然而,收集的數據不能提供在VA-ECMO使用之前和使用期間的顯著低血壓的確切持續時間,這是本研究的另一個限制。
綜上所述,腎衰竭對VA-ECMO患者的病死率有顯著影響,CysC和NGAL可作為急性腎衰竭的獨立預測因子,而且CysC和NGAL也可用于預測VA-ECMO患者90 d死亡風險。因此,CysC、NGAL可作為監測VA-ECMO患者急性腎衰竭的有效參數。

