子癇前期合并胎兒生長受限對新生兒嚴重不良結局的影響
王曉燕,彭 蘭
(南京醫科大學附屬蘇州市立醫院產科,江蘇 蘇州 215002)
胎兒生長受限(fetal growth restriction,FGR)的新生兒死亡率和發病率均高于正常胎齡兒[1],可增加成人心血管疾病和2型糖尿病等發病風險[2]。目前早發型子癇前期被認為是胎盤子癇前期,晚發型子癇前期被認為是母體子癇前期[3]。早發型子癇前期的產婦常易合并FGR,通常認為是由于胎盤功能不良導致。由于不同國家間診斷標準的差異,FGR在子癇前期產婦中的發病率從12.8%到58.6%不等[4-6]。
2018年國際妊娠高血壓研究學會(International Society for the Study of Hypertension in Pregnancy,ISSHP)指南建議子癇前期的診斷包含胎兒生長受限,但不建議作“輕度”或“重度”的分級,并強調FGR應作為子癇前期的診斷依據,其原因是子癇前期為胎盤源性疾病,胎盤源性疾病可以導致胎兒生長受限[7]。而2020年更新的美國婦產科醫師協會(American College of Obstetricians and Gynecologists,ACOG)指南未將胎兒生長受限作為子癇前期的診斷或嚴重特征之一[8]。我國2020年發布的妊娠期高血壓疾病診治指南中,將胎兒生長受限或羊水過少、胎死宮內、胎盤早剝等作為重度子癇前期的診斷指標之一[9]。不同指南的差異可影響子癇前期的診斷和處理,從而影響妊娠結局。本文選擇子癇前期產婦作為研究對象,目的在于探討子癇前期產婦合并FGR對新生兒結局的影響,為指導子癇前期合并FGR是否積極終止妊娠及分娩孕周的選擇提供臨床依據。
1 對象與方法
1.1 研究對象
選擇2015年1月1日至2015年12月31日在蘇州市立醫院本部分娩的300例子癇前期產婦為研究對象。納入標準:孕周≥28周、診斷為子癇前期、單胎活產分娩。排除標準:有內分泌疾病(如2型糖尿病、甲狀腺疾病等)、心血管疾病(慢性高血壓、心臟病等)、肝腎疾病等既往病史,胎死宮內者。所有研究對象均知情同意自愿參與研究。
1.2 資料收集及診斷標準
產婦及新生兒的相關信息通過醫院電子病歷系統查詢并獲取,內容包括年齡、不良孕產史、妊娠合并癥和并發癥、分娩方式、分娩孕周、圍產兒結局、入院至分娩前的血壓及尿蛋白的最差值等。所有數據通過EpiData軟件錄入,由雙人核對信息,建立數據庫。研究分組:按照結局分為發生新生兒嚴重不良結局組和未發生新生兒嚴重不良結局組。
本研究相關診斷標準包括①子癇前期:妊娠20周后孕婦出現收縮壓≥140mmHg和(或)舒張壓≥90mmHg,伴有下列任意1項:尿蛋白定量≥0.3g/24h,或尿蛋白/肌酐比值≥0.3,或隨機尿蛋白≥(+);無蛋白尿但伴有以下任何1種器官或系統受累:心、肺、肝、腎等重要器官,或血液系統、消化系統、神經系統的異常改變,胎盤-胎兒受到累及等;②胎兒生長受限:根據2019年發布的《胎兒生長受限專家共識》診斷[10];③新生兒嚴重不良結局:為復合不良結局,參考國內外文獻報道[11-13],包括新生兒死亡(含放棄搶救自動出院者)、呼吸衰竭、腦出血、壞死性腸炎、敗血癥等。
1.3 統計學方法
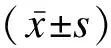
2 結果
2.1 影響新生兒嚴重不良結局的單因素分析
本研究共納入300例子癇前期產婦,年齡20~43歲,中位年齡29(26~33)歲。發生新生兒嚴重不良結局者41例(13.67%),未發生新生兒嚴重不良結局者259例(86.33%)。發生新生兒嚴重不良結局組產婦分娩孕周、胎兒出生體重均小于未發生新生兒嚴重不良結局組,且發生新生兒嚴重不良結局組流產史、剖宮產終止妊娠比例更高,疾病的嚴重程度更高(平均血壓更高,尿蛋白≥3+更常見),合并FGR的比例更高(Z/χ2值介于-9.28~42.15之間,P<0.05)。兩組年齡、是否試管嬰兒、瘢痕子宮、患有妊娠期糖尿病及發生胎盤早剝等方面差異無統計學意義(P>0.05),見表1。

表1 影響新生兒嚴重不良結局的單因素分析[M(Q1~Q3),n(%)]
2.2 影響新生兒嚴重不良結局的多因素分析
多因素Logistic回歸分析顯示,子癇前期產婦合并FGR是發生新生兒嚴重不良結局的獨立危險因素,分娩孕周較長(<40周)是發生新生兒嚴重不良結局的獨立保護因素,其OR值及95%CI分別為3.02(1.05~8.69)、0.47(0.37~0.60),P<0.05,見表2。

表2 影響新生兒嚴重不良結局的多因素Logistic回歸分析
2.3 子癇前期合并FGR產婦中孕周與新生兒嚴重不良結局的關系
對90例子癇前期合并FGR進行單獨分析,發生新生兒嚴重不良結局30例(33.3%),未發生新生兒嚴重不良結局60例(66.7%)。在子癇前期合并FGR產婦中,不同孕周發生新生兒嚴重不良結局差異有統計學意義(χ2=32.95,P<0.05),兩兩比較發現,28~33周組發生新生兒嚴重不良結局的風險高于34~36周組及37~40周組(χ2值分別為20.80、23.67,P<0.01),但后兩組差異無統計學意義,見表3。

表3 子癇前期合并FGR產婦中孕周與新生兒嚴重不良結局的關系[n(%)]
3 討論
3.1 FGR與胎盤功能不全
FGR可由母體因素(如營養不良、高血壓疾病、子癇前期)、胎兒因素(染色體異常、多胎)或胎盤因素等引起[14],其中大部分FGR是由胎盤功能不全引起的[15]。早發性子癇前期和FGR病都被認為是胎盤源性疾病,具有相似的胎盤病理變化,其特征是子宮和胎盤螺旋動脈的重塑存在生理缺陷,導致子宮胎盤灌注受限[16]。Surrico等[17]用人臍帶間充質干細胞和滋養層細胞系檢測子癇前期和胎兒宮內發育遲緩患者體內的過氧化應激反應,發現兩種疾病都與氧化應激水平升高有顯著聯系。因此當子癇前期患者出現FGR時,有理由認為此時胎盤功能受損。胎盤功能不全的特征是血流優先重新分布到重要器官(如腦、心肌和腎上腺),而其他器官包括胃腸道、皮膚等血流相對減少,這種胎兒血流的重新分布是由缺氧直接導致[18]。新生兒的預后通常取決于胎盤功能不全發生的時間和生長受限的嚴重程度,因此早期識別、早期干預對新生兒預后至關重要。
與本研究相似,Venkatesh等[6]發現<34周的子癇前期新生兒的不良結局與胎兒生長受限有關,且與有無合并癥無關。Carter等[12]研究發現子癇前期產婦中合并FGR者比不合并FGR者更易發生母親和新生兒不良結局。Gardosi等[19]通過兩年時間研究了389例死產,發現胎兒生長受限是死產的主要危險因素,并且產前未檢測到FGR的死產率比在產前檢測到FGR的死產率高5倍(32.0% vs 6.2%)。一項回顧性隊列研究顯示,對FGR的適當檢測有利于降低死產率[20]。FGR常常提示胎盤功能不全,應該引起臨床的足夠重視,因此本研究支持FGR作為重度子癇前期的診斷指標之一。
3.2 子癇前期合并FGR時分娩孕周的選擇
大多數國家指南推薦妊娠37周后的子癇前期孕婦應建議分娩,因為這樣既可顯著降低孕婦疾病發生風險又不會增加圍產兒疾病風險。然而,妊娠34~37周的先兆子癇孕婦應在何時終止妊娠,目前仍存在爭議。本研究將子癇前期合并FGR患者孕34~36周與37~40周對比,發現發生新生兒嚴重不良結局的差異無統計學意義,因此支持子癇前期合并FGR時,當孕周≥34周后即可適時終止妊娠。2019年《Lancet》上發表的研究共招募了46家醫院中901名妊娠34~37周的子癇前期孕婦,將其隨機分為計劃提前分娩組(n=450)和期待療法組(n=451),結果發現與期待療法組相比,計劃提前分娩可降低母親不良結局且未增加新生兒不良結局[21]。子癇前期產婦中合并FGR是新生兒嚴重不良結局的危險因素,但分娩時機仍需權衡早產相關的潛在風險。本研究認為部分患者經過系統評估后≥34周終止妊娠是可行的。
本研究存在一定的局限性。首先,樣本量相對較小,可能存在選擇偏倚,后期應進一步擴大樣本量;第二,本文為單中心研究,可進一步加大與多中心合作,增加其他相關因素的調查,降低混雜因素;第三,本研究未對胎兒生長受限的程度進行分層管理,且未對嚴重不良結局逐一進行分析,在之后的研究中可繼續深入探討。

