滇牡丹MYB家族成員鑒定及PdMYB2的功能驗證
鄒紅竹,韓璐璐,周 琳,呂紀杭,賈瑩華,王 雁
(中國林業科學研究院林業研究所,國家林業和草原局林木培育重點實驗室,北京 10009)
花色是牡丹(Paeonia suffruticosaAndr.)最重要的觀賞性狀,中國傳統品種的牡丹花色多為白色、紫紅色、粉色等顏色,黃色系的牡丹品種稀少。滇牡丹(Paeonia delavayiFranch.)是芍藥科(Paeoniaceae)芍藥屬(Paeonia)牡丹組(Section Moutan DC.)肉質花盤亞組(Delavayanae)的落葉亞灌木。滇牡丹中的黃色花類群是十分重要的育種資源,法國和美國的育種專家用中國滇牡丹中的黃花類群開展遠緣雜交,育出了當前流行的“金閣”、“金晃”、“海黃”等黃色花品種[1]。滇牡丹花色純黃,但花朵較小,單瓣,花頭下垂,在中原地區引種極難成功;中原牡丹與滇牡丹屬于不同亞組,雜交有一定難度,目前雜交育出的黃色品種較少,且花頭下垂[2]。迄今為止,傳統的雜交育種手段未能高效地培育出人們理想中的色彩明亮純正的黃色牡丹品種。了解滇牡丹黃色產生的分子機制對定向育種十分重要。
周琳等對滇牡丹黃色花的色素組成進行分析,認為主要為查爾酮苷/黃酮苷和黃酮醇苷的混合物,包括查爾酮苷類中的異杞柳苷及山奈酚苷、槲皮素苷、異鼠李素苷、金圣草黃素苷和芹菜素苷等[3]。類黃酮的生物合成始于1分子的4-香豆酰-輔酶A(coumaroyl-CoA)和3分子的丙二酰-輔酶A(malonyl-CoA)被查爾酮合成酶(chalcone synthase,CHS)催化形成四羥基查爾酮(2′,4′,6′,4-tetrahyroxychalcone,THC),為類黃酮合成提供了基本碳骨架。THC作為重要的中間產物在不同酶的催化下進入不同的代謝途徑,生成不同的物質。THC在查爾酮2′葡糖基轉移酶(chalcone 2′-glucosyltransferases,THC2’GT)的作用下生成在液泡中穩定存在的異杞柳苷(isosalipurposide,ISP,黃色),這也是黃色花牡丹中的重要顯色物質。THC在查爾酮異構酶(chalcone isomerase,CHI)的作用下生成柚皮素(naringenin,黃色),是花青素、黃酮及黃酮醇生物合成的前體物質。柚皮素由黃烷酮3-羥基化酶(flavanone 3-hydroxylase,F3H)催化生成各類花青素苷的必要前體物質二氫山萘酚(dihydrokaempferol,DHK),再由黃酮醇合成酶(flavonol synthase,FLS)催化合成山奈酚(kaempferol,淺黃色)和槲皮素(quercetin,淺黃色)[4-9]。
通過對擬南芥(Arabidopsis thaliana(L.)Heynh.)、金魚草(Antirrhinum majusL.)、玉米(Zea maysL.)、矮牽牛(Petunia hybrida(J.D. Hooker) Vilmorin)等模式植物類黃酮生物合成途徑的深入研究發現,類黃酮合成途徑的分子調控網絡主要由結構基因(structural genes)和調節基因(regulatory genes)共同調控完成[10-12]。其中,MYB轉錄因子家族是植物中最大的轉錄因子家族[13]。MYB轉錄因子在N端都有一段保守的MYB結構域,是DNA的結合區(DNA-binding domain)。MYB轉錄因子的C端有一個轉錄激活區(transcription activation domain),通過折疊成雙親性的螺旋結構從而激活轉錄[14-15]。根據MYB轉錄因子N端R結構(R1、R2、R3)的個數,可以將MYB轉錄因子大致分為R1/R2-MYB、R2R3-MYB、R1R2R3-MYB三個亞類,其中R2R3-MYB是植物中數目最多的一類,它們主要參與細胞分化、激素應答、次生代謝、環境脅迫以及抵御病蟲害,而且能夠調控植物花青素的生物合成[16]。
調控類黃酮合成途徑的MYB基因已從多種植物中分離出來,并對它們的功能進行了廣泛研究。Kobayashi等從四倍體巨峰葡萄(Vitis labruscanaKyoho)中分離出MybA基因,通過調控UFGT基因參與葡萄花青素苷合成的調控[17]。Espley等從蘋果(Malus×domesticaBorkh)中分離出MdMYB10基因,它在同源和異源系統中都能誘導花青素的積累,而且與MdbHLH3和MdbHLH33這2個bHLH蛋白共表達[18]。Chiou等發現,文心蘭(Oncidiumspp.)OgMYB1可以激活黃色唇瓣中的OgCHI和OgDFR的轉錄而誘導花青素的形成[19]。Feng等在亞洲梨品種(Pyrus pyrifoliacv.‘Aoguan’)中分離到1個R2R3-MYB轉錄因子基因PyMYB10,證實在其成熟果實中,果皮中PyMYB10的轉錄量與花青素合成途徑中的PyCHS、PyCHI、PyF3H等基因以及花青素的合成量呈正相關[20]。Yamagishi等從亞洲百合(Lilium‘Montreux’)中分離出2個R2R3-MYB轉錄因子LhMYB6和LhMYB12,對其花青素合成具有正調節作用,并決定了花青素在特定器官和組織中積累[21]。Tian等研究發現,紅葉海棠(Malus‘Flame’)中的McMYB10通過對海棠中McF3'H的正調控在海棠紅葉著色中起著重要作用[22]。Tuan等研究證明,桃(Prunus persicaL.)中的PpMYB10.1是紅皮桃花青素積累的主要調節因子,并具有活化作用[23]。Shi等從茄子(Solanum melongenaL.)中分離出1個R2R3-MYB,命名為SmMYB75,過表達SmMYB75后發現,導致花青素積累量增加,愈傷組織顏色由青變紫[24]。MYB轉錄因子也并非都是激活子,也有一部分MYB轉錄因子起負調控作用。Colanero等從番茄(Solanum lycopersicumL.)中獲得了1個R3-MYB蛋白的突變基因,當其過度表達時,這種蛋白通過負面干擾由內源性MBW復合物介導的花青素生物合成途徑的激活,抑制了番茄幼苗和植株中的花青素生成[25]。Gates等從懸鈴果屬(Iochromaspp.)中發現1個新的R3-MYB轉錄因子等位基因與花色變異密切相關,命名為MYBL1,是一種MYB的轉錄抑制因子,該基因的高表達與花青素代謝途徑上F3′5′H、DFR、ANS基因下調有關[26]。Deng等在香蕉(Musaspp.)中發現1個R2R3-MYB轉錄因子MaMYB4,可以跟CHS、ANS、DFR、bHLH的啟動子結合,從而抑制它們的表達,使花青素的積累量變少[27]。
MYB轉錄因子在滇牡丹類黃酮生物合成途徑中的作用未曾被報道過,本研究基于滇牡丹花瓣的轉錄組數據,對滇牡丹MYB家族進行了成員鑒定及分類。在分類得到的MYB轉錄因子中,依據系統進化樹、同源序列比對、基因差異表達篩選到1個R2R3 MYB轉錄因子PdMYB2可能在類黃酮生物合成途徑中發揮了重要作用。本研究利用亞細胞定位、實時熒光定量PCR、瞬時過表達、轉基因煙草及液相色譜串聯質譜等方法對其進行了功能驗證,為進一步深入分析PdMYB2的功能和調控機制奠定了基礎,并為牡丹花色分子育種提供了候選基因。
1 材料與方法
1.1 實驗材料
本研究以滇牡丹純黃色花為實驗材料,所用材料均采集于云南省迪慶藏族自治州香格里拉縣(29°58′7″ N,99°34′60″ E,海拔3400 m),根據牡丹生長發育年周期的劃分,結合滇牡丹花蕾發育和花朵著色實際情況,采集花朵開放的4個進程:S1,硬蕾期(未著色緊實花朵);S2,透色期(輕微著色,花蕾蓬松);S3,初開期(花朵初開,花朵完全變黃);S4,盛開期(花朵盛開,花藥完全外露)(圖1)。采集時間為2019年5月,采集同一株滇牡丹上的4個時期的花朵,采集3株不同植株作為生物學重復,采集后將每朵花按花器官用錫箔紙包好,液氮速凍,保存于-80 ℃冰箱中。

圖1 滇牡丹花朵開放的4個階段Fig. 1 Four periods of blooming of Paeonia delavayi flowers
1.2 試驗方法
1.2.1 滇牡丹MYB轉錄因子家族成員的鑒定和分析 根據滇牡丹花瓣轉錄組數據庫(NCBI ID:PRJNA772706)的基因注釋信息,分離出所有MYB Isoforms,使用NCBI開放閱讀框工具ORFfinder獲取所有基因的CDS區,運用EMBL-EBI在線工具Pfam(http://pfam.xfam.org/search/sequence)對全部MYB Isoforms的蛋白結構域進行檢索,去除結構域完整度低于30%的序列,將剩余MYB轉錄因子根據相鄰不完全重復區域數目對MYB轉錄因子進行分類,分為R1R2R3-MYB、R2R3-MYB、R1-MYB、4R-MYB及MYB-related,并使用MUSCLE(http://www.ebi.ac.uk/Tools/msa/muscl e/)在線網站對它們進行多序列比對。從擬南芥數據庫在線網站TAIR(https://www.arabidopsis.org/index.jsp)下載擬南芥R2R3-MYB轉錄因子家族數據,運用Mega7.0軟件,將滇牡丹R2R3-MYB與擬南芥R2R3-MYB進行系統發育分析。通過跟擬南芥MYB家族的聚類,預測滇牡丹中與類黃酮生物合成途徑有關的MYB轉錄因子,并結合轉錄組差異表達熱圖,聚焦到可能參與類黃酮生物合成的PdMYB2轉錄因子上,對其進行進一步的分析和驗證。
1.2.2 滇牡丹PdMYB2轉錄因子的克隆及序列分析 通過對前期構建的滇牡丹花瓣全長轉錄組數據庫序列注釋信息進行檢索,獲得滇牡丹PdMYB2(Isoform0011606)序列,使用NCBI開放閱讀框工具ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder/)獲取該基因的CDS區。使用Primer3web(https://primer3.ut.ee/)在線引物設計軟件進行引物設計。克隆引物見表1。用艾德萊植物RNA快速提取試劑盒(貨號:RN38)根據說明書提取RNA,用TaKaRa高保真酶(貨號:R010A)克隆基因。利用生物信息學分析軟件和工具對PdMYB2基因編碼蛋白的理化性質和結構功能進行預測,為對PdMYB2基因的進一步研究和應用提供參考。利用ExPasy中的Prot-Param工具對PdMYB2基因編碼蛋白的基本理化性質進行了分析。利用在線工具Swiss-model預測PdMYB2蛋白的三維結構。利用在線工具NetPhos(http://www.cbs.dtu.dk/services/NetPhos/)預測PdMYB2的磷酸化位點。
1.2.3 實時熒光定量PCR分析 對滇牡丹PdMYB2
基因在滇牡丹花瓣開放的S1~S4時期進行實時熒光定量PCR分析。在將PdMYB2轉煙草后,對該轉錄因子基因在煙草的花、葉、莖中表達量進行實時熒光定量PCR分析。對轉基因煙草NtCHS、NtCHI的表達量進行實時熒光定量PCR分析。實時熒光定量PCR的產物見表1。使用TaKaRa TB Green?PremixEx TaqTM(貨號:RR420A)按照說明書實驗,使用2-△△Ct計算表達量。滇牡丹內參基因為PsPP2A,煙草內參基因為NtCP。

表1 引物Table 1 Primers
1.2.4 亞細胞定位分析 將PdMYB2基因去除終止密碼子后的編碼區構建到PHB-GFP載體上,引物見表1。使用熱擊法將構建好的載體質粒轉化到農桿菌GV3101菌株中。挑取鑒定為陽性的菌落,放入5 mL卡那霉素濃度為50 μg·mL-1、利福平濃度為20 μg·mL-1的LB液體培養基中,震蕩培養12 h左右后,取其中1 mL新鮮菌液,加入100 mL卡那霉素濃度為50 μg·mL-1、利福平濃度為20 μg·mL-1的LB液體培養基中,繼續震蕩培養6~8 h,震蕩培養6 h后開始0.5 h檢測菌液OD600值,菌液OD600值為0.6~0.7時停止搖菌。將菌液分裝至無酶無菌的50 mL離心管中,5000 rpm、10 min離心收菌。在超凈工作臺內倒掉上清液,盡量將上清液去除干凈。用亞細胞定位侵染液重懸菌體,使侵染液的OD600值為0.75。在黑暗中靜置懸菌液3 h,按1:1比例混合含有載體質粒的侵染液和空mCherry侵染液,使用1 mL無菌注射器注射4~6葉期的煙草葉片,注射完成后暗培養12 h后,轉移至光下,進行12 h光照12 h黑暗交替培養2.5 d。2.5 d后將注射過的煙草葉片剪下,剪成0.5 mm × 0.5 mm大小,用0.1 μg·mL-1DAPI染色1~5 min后,用激光共聚焦掃描顯微鏡(卡爾蔡司光學(中國)有限公司,型號:Zeiss LSM510 Meta)觀察煙草細胞的GFP和DAPI熒光表達情況。
1.2.5 葉盤法轉煙草 將PdMYB2基因的CDS區構建到pCAMBIA1302載體上,引物見表1,使用熱激法將構建好的PdMYB2-pCAMBIA1302載體質粒轉化到EHA105農桿菌菌株感受態中。經過菌落PCR的鑒定,挑取鑒定為陽性的菌落,如1.2.4中方法培養菌液,當菌液OD600值為0.2~0.5時停止搖菌,將菌液分裝至無酶無菌的50 mL離心管中,5000 rpm、10 min離心收菌。在超凈工作臺內倒掉上清液,盡量將上清液去除干凈。使用1/2MS液體培養基重懸菌塊,使重懸液OD600值在0.5~0.8之間侵染煙草。取生長健壯的煙草組培苗葉片,修剪掉葉脈和邊緣后,剪成0.5 mm × 0.5 mm大小,將剪好的葉片一部分浸入侵染液,一部分浸入1/2MS液體培養中作為空白對照,不斷晃動,使葉片與菌液充分接觸。3~5 min后取出煙草葉片,在滅菌濾紙上吸干多余的菌液,煙草正面朝上,平鋪于共培養分化培養基(MS + 0.5 mg·L-16-BA + 0.05 mg·L-1NAA + 100 μmol·L-1AS + 瓊脂,調節pH = 5.8)中,封口膜封口,暗培養72 h。暗培養后,將葉片用無菌水清洗3次,再用含200 mg·L-1特美汀的無菌水清洗3次,轉接于分化篩選培養基(MS +0.5 mg·L-16-BA + 0.05 mg·L-1NAA + 20 mg·L-1潮霉素B + 200 mg·L-1特美汀 + 瓊脂,調節pH =5.8)上,封口膜封口,置于光照培養箱中16 h光照8 h黑暗培養。每2周更換1次培養基,待煙草小苗長至2 cm左右,即可切下小苗,轉接于生根培養基(MS + 0.1 mg·L-1NAA + 20 μg·L-1潮霉素B + 200 mg·L-1特美汀 + 瓊脂,調節pH = 5.8)上培養,繼代2次后,能正常生根的即為陽性苗。小苗根生長至2 cm左右時,將小苗從組培瓶內移出,培養箱內緩苗2 d后即可將苗移至溫室培養。
1.2.6 液相色譜分析花瓣中的色素變化 轉基因煙草開花后,觀測煙草花色表型的變化,并采集煙草花瓣部分,液氮速凍,存于-80 ℃冰箱中,使用液質聯用分析系統(LC-MS/MS)的方法對花青素代謝物進行絕對定量檢測。實驗方法參照文獻[28-31]。
將采集的煙草花瓣真空冷凍干燥,用研磨儀30 Hz研磨90 s,至樣品變為粉末狀,稱取50 mg的花瓣粉末,溶解于50 μL的提取液中(提取液為含0.1%鹽酸的50%甲醇水溶液)。溶解后,渦旋震蕩5 min,超聲清洗儀波處理5 min,高速離心機12000 rpm低溫4 ℃離心3 min,吸取上清液后,重復操作1次。將2次獲得的上清液合為一管,用0.22 μm孔徑的微孔濾膜進行過濾,保存于進樣瓶中,用于LC-MS/MS分析。
液相條件主要包括:(1)色譜柱:ACQUITY BEH C181.7 μm,2.1 mm × 100 mm;(2)流動相:A相為超純水(加入0.1%的甲酸),B相為甲醇(加入0.1%的甲酸);(3)洗脫梯度:0.00 min B相比例為5%,6.00 min增至50%,12.00 min增至95%,保持 2 min,14 min降至5%,并平衡2 min;(4)流速0.35 mL·min-1;柱溫40 ℃;進樣量2 μL。
質譜條件主要包括:電噴霧離子源( ESI)溫度550 ℃,正離子模式下質譜電壓 5500 V,氣簾氣(CUR)35 psi。在Q-Trap 6500 + 中,每個離子對是根據優化的去簇電壓(DP) 和碰撞能(CE)進行掃描檢測。
將檢測到的樣本的積分峰面積代入標準曲線線性方程進行計算,最終得到實際樣本中該物質的含量數據。計算公式為:樣本中代謝物的含量(μg·g-1)=C×V×(1000000×m)-1(式中,C:樣本中積分峰面積代入標準曲線得到的濃度值(ng·mL-1);V:提取時所用溶液的體積(μL);m:稱取的樣本質量(g))。
該實驗交由武漢邁特維爾生物科技有限公司(https://www.metware.cn/)完成。
2 結果與分析
2.1 滇牡丹MYB基因家族成員的預測
本研究通過轉錄組注釋,共獲得93個MYB轉錄因子,刪除重復序列后,在Pfam在線蛋白結構域分析網站上進行結構域檢索,去除結構域完整度低于30%的序列后,最終共獲得64個MYB基因家族成員。對這些家族成員進行不完全重復結構域數目統計,分為4個亞類,其中,R2R3-MYB成員有25個,R1R2R3-MYB有1個,4R-MYB有2個,MYB-related有36個。為研究它們之間的系統進化關系,使用MEGA7.0構建NJ樹(Neighbor-Joining)。圖2表明:在滇牡丹純黃色花中,4種類型的MYB蛋白在進化樹中劃分較清楚,同一類型的MYB轉錄因子基本聚在相同的分支,這說明MYB轉錄因子家族在系統進化上具有保守性。
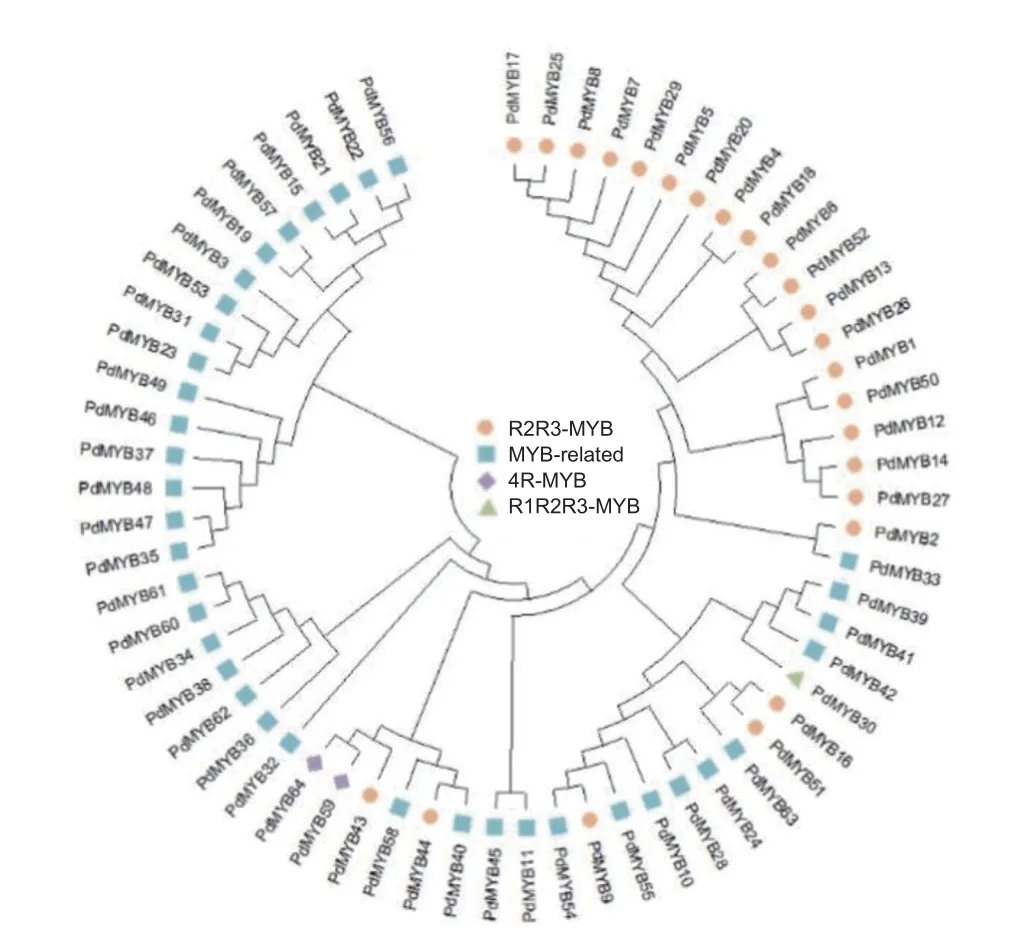
圖2 滇牡丹 MYB 基因家族進化樹分析Fig. 2 Neighbor-Joining tree of MYBs in P. delavayi
2.2 滇牡丹R2R3-MYB基因家族的系統發育分析及功能預測
R2R3-MYB轉錄因子是MYB家族在植物中數目最多的一類,不僅調控植物的次生代謝、細胞分化、激素應答等過程,而且能調控花青素的生物合成。對滇牡丹中所有R2R3-MYB轉錄因子進行堿基數量、氨基酸數量、R2及R3結構域在氨基酸序列中的位置、分子量、親水性及等電點的統計(表2),以進行后續研究。
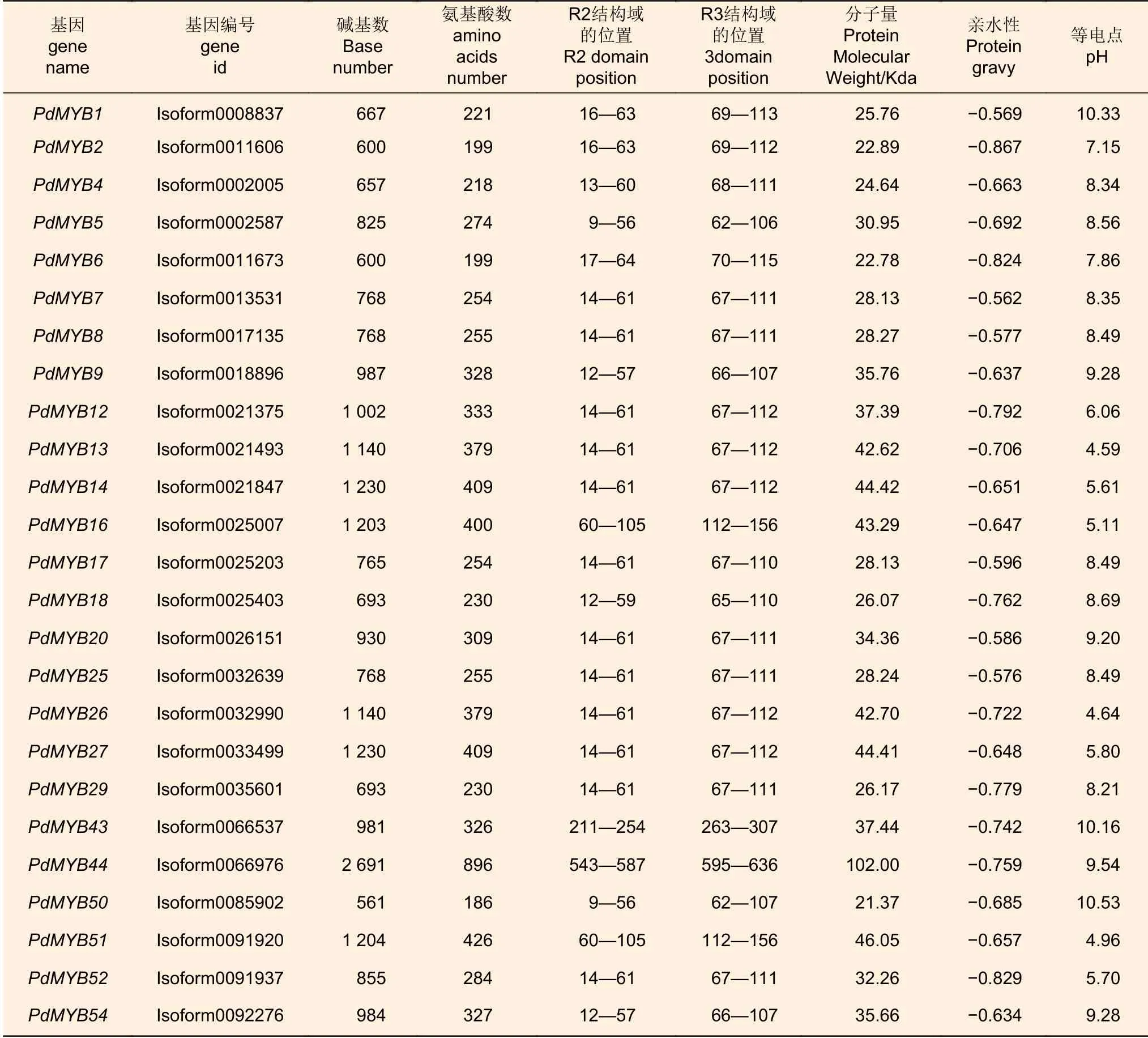
表2 R2R3 MYB理化性質統計Table 2 Statistics of physical and chemical properties of R2R3 MYB
為進一步研究滇牡丹R2R3-MYB轉錄因子的功能,從擬南芥TAIR網站下載擬南芥R2R3-MYB蛋白,將篩選出的25個滇牡丹R2R3-MYB與擬南芥R2R3-MYB轉錄因子構建系統發育樹。擬南芥MYB轉錄因子家族大部分成員的功能都研究得比較清楚,系統發育樹上同一分支的基因在功能上具有同源性和相似性,通過跟擬南芥MYB家族的聚類,可以預測滇牡丹中MYB轉錄因子的功能。在擬南芥中,S4、S5、S6、S7分支參與類黃酮的生物合成。圖3a表明:PdMYB20、PdMYB29、PdMYB8、PdMYB7、PdMYB25與擬南芥第4亞家族的基因聚在一起,可能在類黃酮生物合成途徑中行使轉錄抑制功能。PdMYB1、PdMYB2與擬南芥第5亞家族的AtMYB123聚在一支,研究表明AtMYB123參與原花青素的生物合成,推測PdMYB1、PdMYB2也可能在原花青素合成過程中行使一定的功能。擬南芥的第6亞家族主要參與花青素的生物合成,滇牡丹中沒有MYB轉錄因子聚類到這個亞家族,這可能是由于滇牡丹花瓣純黃,幾乎不含有花青素的原因。PdMYB13、PdMYB26聚類到擬南芥第7亞家族,這一家族的功能是參與黃酮醇的生物合成。
根據轉錄組RPKM數據構建R2R3-MYB轉錄因子表達量熱圖,圖3b表明:25個轉錄因子大體分為2個表達趨勢,一部分隨著花發育上調,一部分隨著花發育下調。從圖中可以看出,聚類在原花青素合成分支的PdMYB2轉錄因子的表達量遠高于其它轉錄因子的表達量,對其進行實時熒光定量PCR的驗證(圖3c),RNA-seq和qRT-PCR數據具有非常密切的相關性,且表達趨勢具有高度的一致性。
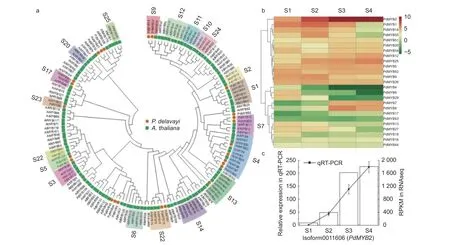
圖3 滇牡丹R2R3-MYB功能預測和表達分析Fig. 3 Functional prediction and expression analysis of peony R2R3-MYB in P. delavayi
2.3 PdMYB2基因克隆及序列分析
使用全長引物克隆PdMYB2的全長CDS序列,獲得PdMYB2序列600 bp(圖4a),經測序,PdTHC2’GT具有從起始密碼子ATG到終止密碼子TAA的完整ORF,編碼199個氨基酸,將PdMYB2登 錄 到 NCBI,登 錄 號 為:OM478634。選擇當歸(Angelica sinensis(Oliv.)Diels,AYA44248.1)、茶(Camellia sinensis(L.)O. Ktze.,ARB51599.1)、葡 萄(Vitis viniferaL.,NP_001268129.1)、黃燈籠辣椒(Capsicum chinenseJacq.,PHT97629.1)、擬 南 芥(A.thaliana,AAM67537.1)和 丹 參(Salvia miltiorrhizaBunge,ADG46002.1)的參與煙草花青素苷合成的轉錄激活因子R2R3-MYB蛋白與PdMYB2進行多重比對(圖4f),在PdMYB2的N-末端發現了2個保守的DNA結合結構域,N-末端的R2和R3 DNA結合結構域是與在其他物種中鑒定的R2R3-MYB轉錄調節因子同源的主要區域。但與其他R2R3-MYB蛋白相比,PdMYB2中與bHLH結合并反應的特征序列顯示出較低的同源性。還觀察到C1和C2基序和C末端的鋅指結構以及保守區的N1、N2和N3基序的同源性非常低。這些結果表明,不同植物中R2R3-MYB蛋白C末端的多樣性。因此,在PdMYB2氨基酸序列中,DNA結合結構域比轉錄激活結構域更保守,這從分子角度解釋了R2R3-MYB在各種植物中功能的相似性和獨特性。使用BLAST和HHBlits對SWISS-MODEL模板庫進行了模板搜索,發現PdMYB2與R2R3-MYB轉錄因子識別靶DNA(target DNA recognition by R2R3-type MYB transcription factor)蛋白模型同源性最高(57.66%)。因此,在模型的基礎上,構建了PdMYB2蛋白的3D模型(圖4b~e)。預測PdMYB2的氨基酸序列包含31個潛在的磷酸化位點,包括20個絲氨酸、6個蘇氨酸和5個酪氨酸。
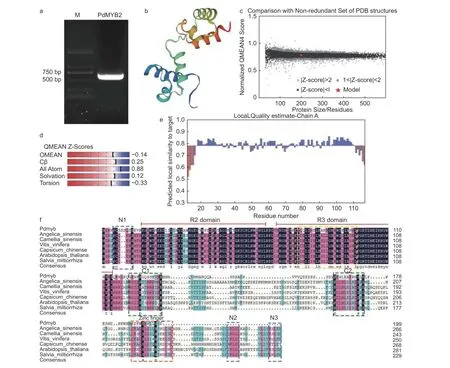
圖4 PdMYB2基因克隆、同源性比對、蛋白質模擬結果及質量評價Fig. 4 PdMYB2 gene cloning, homology comparison of amino acid sequence,protein modelling results and quality estimation.
2.4 PdMYB2基因的亞細胞定位
利用熒光報告基因(GFP)對PdMYB2基因進行亞細胞定位。構建了35S:: PdMYB2-GFP重組載體,以35S::GFP和mCherry共同作為陰性對照,將其在農桿菌的介導下轉化進本氏煙草葉片細胞中,使用激光共聚焦顯微鏡觀察GFP的熒光。圖5顯示:35S::GFP的熒光在細胞核和細胞質中存在,PdMYB2基因的熒光在細胞核中有明顯的熒光表達,在細胞質中有微弱的熒光表達。因此,推斷PdMYB2基因在細胞核和細胞質中均有定位。
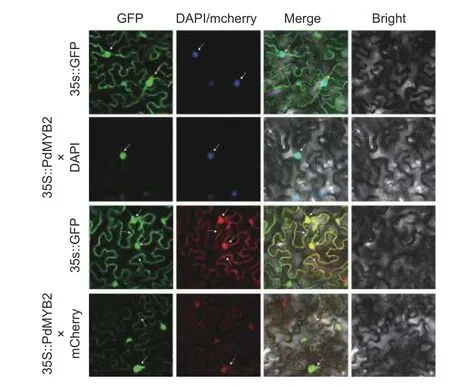
圖5 PdMYB2在煙草中的亞細胞定位Fig. 5 Subcellular localization of PdMYB2 in Nicotiana benthamiana
2.5 PdMYB2基因在煙草中的過表達
2.5.1PdMYB2在煙草中的過表達 為進一步驗證PdMYB2在類黃酮途徑上的調控功能,將35S::PdMYB2-pCAMBIA1302載體通過葉盤法介導入煙草中。以Hygromycin B為抗性篩選標簽,篩選出6個過表達PdMYB2的獨立轉基因煙草品系(line1~line6),岀瓶后移至溫室中,在相同光照、水分、溫度條件下培養。提取每個煙草品系(line1~line6)及野生型煙草(WT,Wild Type)的DNA,并以提取的DNA為模板,使用全長引物對PdMYB2基因進行克隆。瓊脂糖凝膠電泳的結果顯示:轉化PdMYB2基因在各轉基因株系中均可以檢測到條帶,而野生型煙草中未檢測到該條帶(圖6a)。對6個煙草株系進行qRT-PCR的驗證,結果表明:PdMYB2基因在不同組織中均有表達,表達量為莖>花>葉(圖6b)。
對煙草開花后表型進行觀測,過表達PdMYB2的煙草植株開花后,6個煙草株系的花色均比野生型的煙草花色為紅色且顯著變深(圖6c)。對過表達PdMYB2基因的煙草花瓣中煙草自身的NtCHS、NtCHI基因的變化量進行實時熒光定量PCR分析,結果表明:過表達PdMYB2基因后,煙草花瓣中NtCHS和NtCHI基因表達量明顯上調(圖6d、e),且NtCHI的表達量上調水平高于NtCHS基因表達量,這說明在煙草中過表達PdMYB2基因確實影響了煙草類黃酮合成途徑上基因的表達量。對過表達PdMYB2基因的煙草和野生型煙草進行花青素苷的定性定量分析,進一步驗證表型的變化、類黃酮合成途徑結構基因表達量的變化與類黃酮合成途徑色素含量變化的一致性。對花青素苷含量進行絕對定量后,結果顯示:與野生型相比,過表達PdMYB2基因株系中大多數花青素苷成分都有不同程度的上調,其中,矢車菊素苷、天竺葵素苷、芍藥花素苷和矮牽牛素苷顯示出顯著的上調差異(圖6f)。對單個色素成分及含量進行分析,矢車菊素-3-O-蕓香糖苷(Cyanidin-3-O-rutinoside)、矢車菊素-3-O-葡萄糖苷(Cyanidin-3-O-glucoside)、天竺葵素-3-O-蕓香糖苷(Pelargonidin-3-O-rutinoside)和飛燕草素-3-O-蕓香糖苷-5-O-葡萄糖(Delphinidin-3-Orutinoside-5-O-glucoside)的含量極顯著增加,導致了花色的顯著差異(圖6g)。
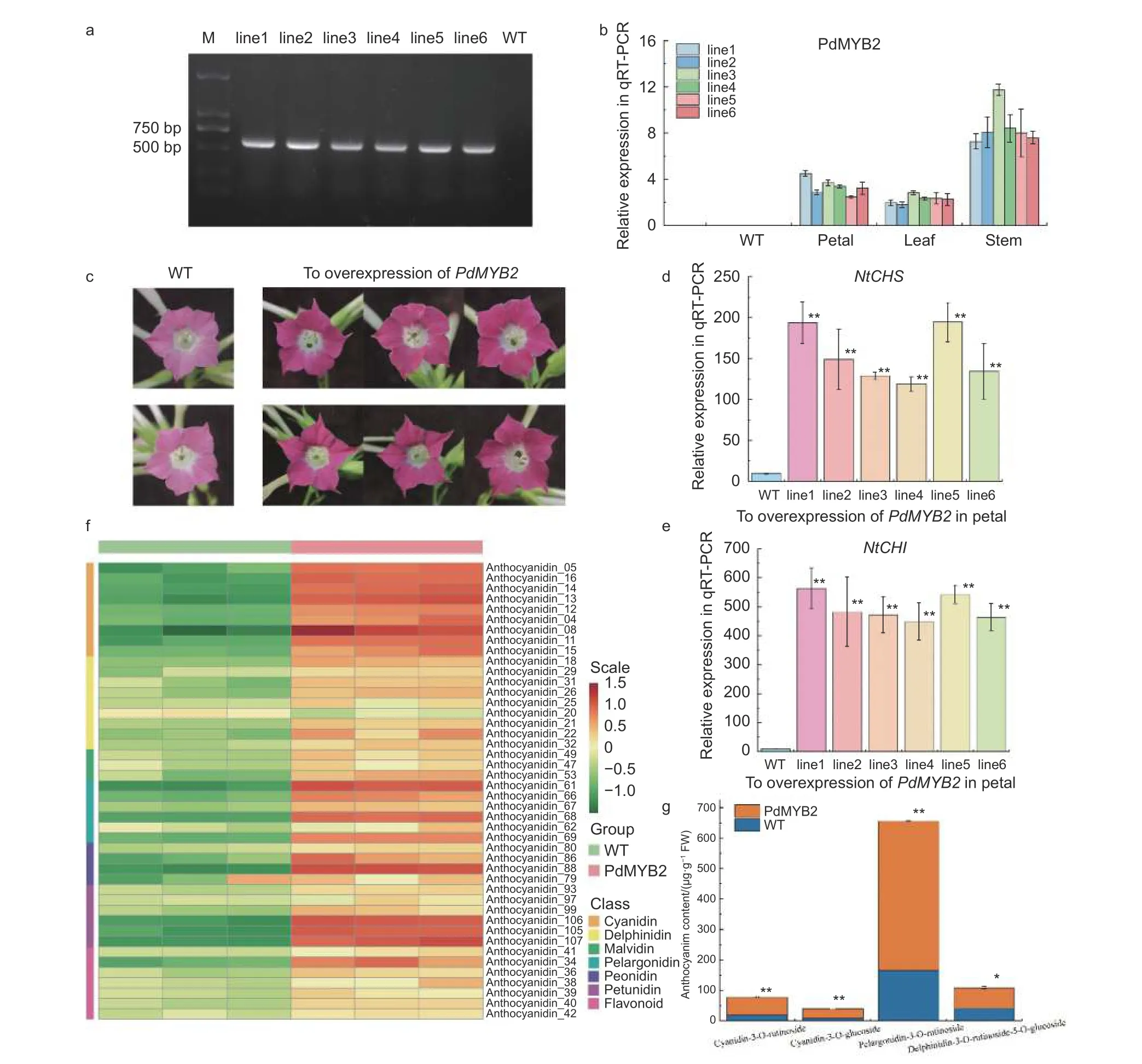
圖6 過表達PdMYB2基因煙草株系的功能分析Fig. 6 Functional analysis of tobacco lines overexpressing PdMYB2
3 討論
本研究的主要目的是了解滇牡丹類黃酮生物合成過程中的轉錄控制。本研究首次對滇牡丹中MYB轉錄因子家族成員進行鑒定,共鑒定到64個MYB基因家族成員,分別為R2R3-MYB成員25個,R1R2R3-MYB 1個,4R-MYB 2個,MYB-related 36個,其中,R2R3-MYB是植物中數目最多的一類,且能夠調控植物類黃酮的生物合成[16]。擬南芥的MYB轉錄因子家族在植物中MYB轉錄因子家族功能研究較深入,筆者將滇牡丹的R2R3-MYB與擬南芥R2R3-MYB一起構建鄰接樹,由于MYB轉錄因子結構域的保守性,筆者認為處于相鄰位置的滇牡丹R2R3-MYB轉錄因子與擬南芥R2R3-MYB轉錄因子具有更相似的結構,從而具有相似的功能。在擬南芥中,S4、S5、S6、S7亞家族是跟色素合成相關的亞家族[32]。在第4亞家族中,AtMYB3、AtMYB4、AtMYB32[33-34]、AtMYB8[35]、AtMYB6、AtMYB7[36]被證實可以作為轉錄激活因子和抑制因子。在第5亞家族中,AtMYB123(TT2)可以調控原花青素的積累[37],苦蕎麥中分離的TT2基因也有相同功能[38]。在第6亞家族中,過表達AtMYB75、AtMYB90[33]可以導致花青素苷的積累。在第7亞家族中,AtMYB11、AtMYB12[33]被證實可以調控黃酮醇的產生,甚至AtMYB12可以直接調控番茄組織中黃酮醇的產生[39]。由此,聚類在S4亞家族的PdMYB20、PdMYB29、PdMYB8、PdMYB7、PdMYB25,聚類在S5亞家族的PdMYB1以及聚類在S7亞家族的PdMYB13、PdMYB26是后續研究的主要目標。
根據與擬南芥R2R3-MYB轉錄因子聚類結果及轉錄組表達量,筆者將PdMYB2基因從滇牡丹花瓣中分離出來。亞細胞定位顯示,PdMYB2定位在細胞核和細胞質中。通常MYB轉錄因子大多在核中定位,PdMYB2在細胞質中的定位說明PdMYB2不完全進核,推測不但有轉錄因子功能,可能還有其他功能,比如與bHLH或WD40轉錄因子的互作,或者受誘導進核[40-42]。磷酸化是MYB蛋白重要的翻譯后修飾。翻譯后修飾建立了一種連接信號通路和反應的機制,根據信號,在適當的時間內調節蛋白質的表達和活性[43]。如磷酸化的RGPR-p117基因可以增強細胞中的調節鈣蛋白mRNA表達,且RGPR-p117的表達模式為通過激素刺激后的蛋白激酶C信號傳導介導后,在NRK52E細胞中從細胞質轉運到細胞核[44]。本研究中,預測PdMYB2有31個磷酸化位點,包括20個絲氨酸、6個蘇氨酸和5個酪氨酸,并且PdMYB2被證明定位在細胞核和細胞質中,這與RGPR-p117相似。因此,推測PdMYB2可以通過磷酸化位點的磷酸化和去磷酸化的共價修飾決定其生理活性,這表明PdMYB2可能參與了細胞器功能的調節。
為進一步探明PdMYB2在類黃酮合成過程中的作用,利用葉盤法將PdMYB2基因轉化進煙草中進行穩定表達。在穩定過表達PdMYB2的轉基因煙草花瓣中,NtCHI、NtCHS基因的表達量明顯上調,且過表達PdMYB2后,NtCHI表達上調的幅度大于NtCHS,這可能是由于基因的級聯效應造成的。
調控類黃酮合成途徑的MYB基因已從多種植物中分離出來,不同的MYB轉錄因子可以引起不同種類的色素積累,其調控的酶基因也不相同。Kobayashi等從四倍體巨峰葡萄中分離出的MybA基因通過表達UFGT基因參與葡萄花青素苷合成的調控[17]。Espley等從蘋果中分離出的MdMYB10基因在同源和異源系統中都能誘導花青素的積累,而且與MdbHLH3和MdbHLH33這2個bHLH蛋白共表達[18]。Chiou等研究發現,文心蘭OgMYB1可以激活黃色唇瓣中的OgCHI和OgDFR的轉錄而誘導紅色素的形成[19]。Tian等研究發現,海棠中的McMYB10通過對海棠中McF3'H的正調控在紅葉著色中起著重要作用[22]。由于PdMYB2在滇牡丹花瓣發育過程中呈現了高表達量,而純黃滇牡丹花瓣中沒有肉眼可見的紅色素產生,筆者推測PdMYB2并不直接調控CHI基因的表達,而是通過調控CHS來調控下游基因的表達。Gu等在牡丹中發現1個R2R3-MYB基因PsMYB12,研究表明,PsMYB12與bHLH和WD40蛋白在直接激活PsCHS表達來調控花瓣斑點的形成[45]。在滇牡丹中PdMYB2是否與bHLH、WD40互相作用以及是否直接與CHS作用,是后續研究的重點。
4 結論
本研究對滇牡丹中MYB轉錄因子家族的成員進行鑒定和分析。鑒定到1個R2R3-MYB轉錄因子PdMYB2,通過對PdMYB2基因進行序列分析和功能驗證,結果顯示PdMYB2基因定位在細胞質和細胞核中,在類黃酮生物合成過程中對類黃酮的積累量具有正調控作用,在煙草中過表達PdMYB2可以促進花青苷的積累。對轉基因煙草株系的NtCHS、NtCHI進行實時熒光定量PCR的分析,PdMYB2可以提高NtCHS、NtCHI在花瓣中的表達量。

