n-HA/PA66復合人工椎體在胸腰椎結核椎體重建的運用
徐軍,王宇飛,張亞寧
(臨汾市人民醫院脊柱矯形科,山西臨汾 041000)
結核病灶清除聯合植骨融合內固定是胸腰椎結核治療的經典術式,但清除病灶后對骨缺損處的重建一直是該術式的重要問題[1]。納米羥基磷灰石/聚酰胺 66 (nano-hydroxyapatite/polyamide 66,n-HA/PA66)人工骨材料目前已在脊柱創傷、脊椎退行性病變、腫瘤等獲得了一定的運用,其結構、形態及彈性模量與正常椎體相似,相容性、骨傳導性優良,但用于脊柱結核的椎體重建還少有報道[2]。本院近年將n-HA/PA66復合人工椎體用于胸腰椎結核的椎體重建治療,獲得了良好的椎體融合及近期支撐效果,報道如下。
1 資料與方法
1.1 一般資料
本研究觀察對象為2018年2月~2019年2月本院收治的32例胸腰椎結核患者,男18例,女14例,年齡28~68歲,平均(44.68±5.04)歲;ASIA分級B級3例,C級17例,D級7例,E級5例;患病節段為T7~L4;單節段患病19例,兩節段9例,三節段4例。
1.2 納入與排除標準
納入標準:經病史、臨床表現、影像、實驗室檢查等確診為胸腰椎結核;符合手術指征,即有神經損害癥狀,或脊柱病理性骨折造成穩定性破壞,或形成死骨、冷膿腫、竇道,抗結核治療無效;結核病灶累及3個節段以內,且呈連續分布。排除標準:Cobb角過大;合并嚴重骨質疏松癥;合并腦卒中、冠心病等疾病致手術不耐受;既往有脊柱骨折史或手術治療史。
1.3 手術方法
所有患者術前均服用異煙肼、利福平、吡嗪酰胺、乙胺丁醇等進行常規抗結核治療2~4 周或更長時間,給予制動、營養干預等基礎治療,待血沉正常或<60 mm/h方可開展手術治療。采用病灶清除聯合n-HA/PA66復合人工椎體重建治療的基本方案。通常選擇左側入路, 若右側較大體積膿腫、椎體嚴重破壞或明顯的硬膜受壓則考慮右側入路。T3~T10選擇經胸入路,T11~L2選擇切除第11或12肋骨,經胸或腹膜后、胸膜外入路,L3~L5選擇腹膜外入路,對于術前影像檢查提示有明顯的髂窩、腰大肌膿腫者,需作倒“八”字切口引流膿腫。 顯露患病節段后,將肉芽組織、壞死椎間盤、死骨等徹底刮除,注意硬化骨包繞空洞的處理,使硬膜囊壓迫解除。大量生理鹽水進行術腔沖洗,根據骨缺損情況將n-HA/PA66 人工椎體(圖1)裁剪成適宜長度,填入肋骨顆粒后置入椎間,完成支撐植骨。n-HA/PA66 人工椎體外壁多孔,中空呈規則圓柱,外徑、內徑、壁厚分別為18 mm、10 mm、4 mm,四壁小孔直徑3 mm,人工椎體高度 30~55 mm。 將短段肋骨置于人工椎體前方或外側加強植骨。內固定根據手術節段具體情況選擇,通常進行雙釘棒固定,透視檢查椎體支撐以及釘棒固定情況。反復生理鹽水沖洗后局部留置1 g鏈霉素粉劑,胸椎患病者留置胸腔閉式引流,其余節段采用常規引流,逐層縫合切口。引流量低于50 mL/d后拔管,適時佩帶支具下床,術后盡可能避免負重,支具保護3個月。術后使用常規“四聯”抗結核治療,時間12個月以上。

圖1 HA/PA66 人工椎體示意圖
1.4 觀察指標
記錄患者手術完成情況、并發癥發生情況,術前、術后1個月、末次隨訪時評價后凸Cobb角、VAS評分,檢測紅細胞沉降率(erythrocyte sedimentation rate,ESR),末次隨訪評價ASIA分級[3]改善情況。
1.5 統計學分析
2 結果
所有患者均完成手術,平均用時(174.11±23.01)min,出血量(658.71±38.24)mL,住院時間(12.12±2.18)d;術后1例出現腦脊液漏,采用甘露醇降壓、頭低腳高位臥床等針對性治療措施后停止;1例發生少量胸腔積液,給予保守治療、隨訪,2周后胸腔積液包裹明顯縮小;1例切口感染,切口延遲愈合,給予抗生素治療后痊愈;末次隨訪融合率為100%。所有患者獲得完整隨訪,隨訪2~4年,平均(3.12±0.28)年;術后1個月、末次隨訪時,Cobb角、VAS評分、ESR均顯著低于術前(P<0.05),見表1;末次隨訪ASIA分級較術前顯著改善(P<0.05),見表2。

表1 手術前后Cobb角、VAS評分、ESR比較
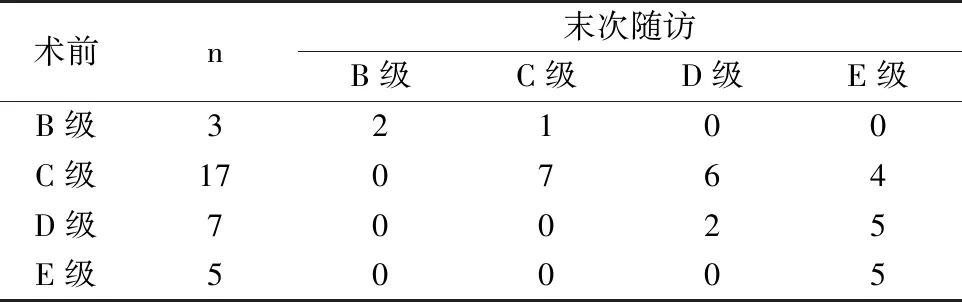
表2 手術前后ASIA分級比較
3 討論
對于胸腰椎結核的手術治療,病灶清除術后進行穩定性重建是促進骨愈合、植骨融合、預防結核復發的關健因素[4]。目前,植骨材料主要包括自體髂骨、肋骨、異體腓骨以及人工材料鈦網等,但均存在一定的局限性。例如肋骨呈弧形,兩端接觸面積、長寬比例不適,易導致植骨下沉、吸收等;選擇自體髂骨會發生取骨區并發癥,且骨支撐強度不足;選擇異體腓骨的替代過程較長且難以預測,易出現骨不連,還存在一定的排斥反應;鈦網彈性模量較正常骨質明顯更高,并且結核患者由于疼痛、營養不良等因素導致骨質條件較差,遠期支撐體下沉風險較高[5]。
n-HA/PA66材料由納米羥基磷灰石晶體以納米級顆粒直徑均勻分布于聚酰胺(PA66)中,通過常壓共溶法加工制成;羥基磷灰石(hydroxy-apatite,HA)是人體骨骼、牙齒的重要無機成分, PA66具有類似于骨膠原的結構,作為醫學材料已應用多年,兩者生物相容性較佳;另外,n-HA/PA66材料植入體內,其表面能形成片狀及針狀磷灰石晶體層,植入物與受體骨間界面產生橋聯作用,緊密鍵性結合確保其優良的生物活性[6]。目前n-HA/PA66材料已在脊柱創傷、腫瘤等的治療中獲得運用且臨床效果確切,其支撐強度高、具備生物安全性、融合率高,為其用于胸腰椎結核進行支撐植骨提供理論依據,為脊重建柱穩定性提供了選擇。另外,有學者認為,n-HA/PA66由于具備良好的生物相容性,能促進抗菌藥物、免疫細胞在材料中分布,促進結核桿菌的清除[7]。本研究顯示,所有患者術后1個月、末次隨訪時Cobb角、VAS評分、ESR均顯著低于術前(P<0.05);末次隨訪ASIA分級較術前顯著改善(P<0.05),結果提示,病灶清除聯合n-HA/PA66復合人工椎體重建治療在畸形矯正、椎體支撐以及脊髓功能恢復方面具有良好的近期療效,其具備以下優點[8-9]:①熱穩定性、材料均一性、生物力學性能良好,且不致敏、無細胞毒性、無免疫排斥,生物安全性良好;②結構、形態及彈性模量與正常椎體相似,可恢復、維持生物學力線,對前柱的支撐力較強,上、下端齒狀突起能夠降低移位及植骨塊吸收風險,支撐強度大,矯正丟失較少;③術中切除的肋骨骨量大,多能夠滿足支撐植骨的填充,無需取自體髂骨。本研究結果顯示,末次隨訪時融合率達到100%,證實n-HA/PA66復合人工椎體具有良好的融合效果。
本研究1例患者發生腦脊液漏,采用甘露醇降壓、頭低腳高位臥床等針對性治療措施后停止,術中在清除硬脊膜囊前方病灶時,應遵循病灶、周圍骨質、椎管毗鄰皮質骨的順序;1例患者術后出現胸腔積液,術中應注意病灶徹底清除、反復生理鹽水沖洗,同時術中切除肋骨頭應盡可能保護肋骨下方的胸膜;1例切口感染,切口延遲愈合,給予抗生素治療后痊愈;在常規抗感染治療的基礎上,還應該通過加強營養、注意更換敷料等多方面進行感染預防。

