籽瓜多糖對益生菌生長促進效應及其結構表征
常雪花,錢雅雯,王振菊,魏佳,吳斌,張政*
(1.巴音郭楞職業技術學院生物工程學院 新疆 庫爾勒 841000;2.新疆農業科學院農產品貯藏加工研究所,新疆 烏魯木齊 830091;3.新疆農產品加工與保鮮重點實驗室,新疆 烏魯木齊 830091)
籽瓜(Citrullus lanatus ssp.Vulgaris var.megalaspermus Lin et Chao),屬葫蘆科(Cucurbitaceae)西瓜屬(Citrullus genus),是新疆重要的特色農作物之一。隨著新疆優勢農產品區域化布局的進一步推進,籽瓜產業迅速發展。2020年,籽瓜播種面積達84 990萬m2,產量為195 451 t,其產量僅次于番茄和辣椒[1]。長期以來,取籽加工為籽瓜最主要產品形式,超過籽瓜總質量90%以上的瓜瓤和瓜皮被直接廢棄,其副產物綜合利用率較低,這導致籽瓜產業整體產品附加值不高,嚴重阻礙了籽瓜產業升級轉型和可持續發展[2-3]。
近年來,多糖在功能性食品領域受到越來越多的關注。以益生元為導向的多糖篩選和開發已逐漸成熟,成為調節腸道菌群以維持身體健康的主要策略之一[4-5]。枸杞多糖具有益生元特性,能增強腸道微生物群,促進嗜酸乳桿菌和長雙歧桿菌的體外生長[6]。此外,Ouyang等[7]從山藥中分離出的 YPN、YPN-Ⅰ、YPN-Ⅱ和YPN-Ⅲ4個多糖組分能明顯促進嗜熱鏈球菌的生長。課題組前期利用響應面法優化籽瓜多糖的超聲輔助水提取工藝,提取出的籽瓜多糖含量達到6.03%[8]。這表明籽瓜可作為一種多糖的生物來源。籽瓜粗多糖能夠緩解細胞氧化應激損傷[9]。從“內蒙黑中片”籽瓜中分離純化的多糖SI具有較好的抗氧化能力,能抑制酵母菌的體外生長[10]。目前,人們對籽瓜多糖功能性作用的認知主要局限于其抗氧化活性和抑菌活性,這不能充分和科學地評價籽瓜多糖的功能特性。籽瓜多糖是否能與枸杞和山藥多糖等一樣,作為一種潛在的益生元仍需進一步研究。
本文以新疆籽瓜為試驗材料,對籽瓜多糖進行分離、純化,比較各組分對益生菌生長影響的差異性,明確最優組分的一級結構,為籽瓜多糖生物活性與結構表征間構效關系以及籽瓜高附加產品的開發提供理論基礎。
1 材料與方法
1.1 材料與試劑
籽瓜于2021年8月采摘于新疆焉耆縣籽瓜種植園。
青春雙歧桿菌、長雙歧桿菌、嬰兒雙歧桿菌、嗜酸乳桿菌:中國普通微生物菌種保藏管理中心;DEAE纖維素DE-52填料:上海遠業生物科技有限公司;石油醚、氫氧化鈉、硫酸:天津市北聯精細化學品開發有限公司;溴化鉀、氯化鈉、磷酸二氫鈉、磷酸氫二鈉、硫酸鐵、葡萄糖:福晨(天津)化學試劑有限公司;牛肉浸粉、大豆蛋白胨、胰蛋白胨、酵母浸粉、肝浸粉:青島海博生物技術有限公司。以上試劑均為分析純。
1.2 儀器與設備
1260高效液相色譜儀:安捷倫科技(中國)有限公司;GCMS-QP2010 SE氣相色譜-質譜聯用儀:島津(上海)實驗器材有限公司;FTIR-650傅里葉變換紅外光譜儀:天津港東科技股份有限公司;Bruker AV-600MHz核磁共振儀:布魯克(北京)科技有限公司;GJ-25C冷凍干燥機:北京四環科學儀器廠有限公司;RE100-Pro旋轉蒸發儀:美國SCILOGEX公司;HH-2恒溫水浴鍋:江蘇金壇市榮華儀器制造有限公司;UV-2600紫外可見分光光度計、PHS-3C pH計:上海耶茂儀器設備有限公司;LDZX-30KB高壓滅菌鍋:上海鼎謙生物科技有限公司;圓底立式厭氧培養袋:青島海博生物技術有限公司;DHG-9023A鼓風干燥箱、SHP-250生化培養箱:上海精宏實驗設備有限公司。
1.3 試驗方法
1.3.1 籽瓜多糖的提取和分離
將籽瓜去翠衣皮、切塊、去籽、留瓜瓤,經40℃低溫干燥48 h后粉碎,經100目篩網過濾得到籽瓜干粉。將籽瓜干粉按原料:石油醚為1∶3(g/mL)的料液比加入石油醚原液,室溫(20±5)℃下浸泡12 h后,采用旋轉蒸發儀濃縮體積,回收石油醚。重復2次,除去脂溶性雜質,最后放入40℃烘箱內干燥,得到籽瓜干粉原料。
采用課題組前期優化的超聲輔助水提法提取籽瓜多糖[6]。籽瓜多糖分離參考Zhu等[11]的方法,略有修改。取1g籽瓜干粉溶解在30mL蒸餾水中,42℃、220W超聲輔助提取2 h后,12 000 r/min離心10 min。將上清液緩慢倒入DEAE纖維素色譜柱中。隨后調整流速至15 mL/min,分別用4組溶劑(3倍柱體積的蒸餾水、0.2 mol/L NaCl、0.5 mol/L NaCl和 2.0 mol/L NaCl)洗脫。采用苯酚硫酸法在490 nm處檢測洗脫液吸光度。
1.3.2 菌株培養
稱取牛肉浸粉3.0 g,可溶性淀粉0.5 g,L-半胱氨酸0.5 g,大豆蛋白胨、胰蛋白胨各5.0 g,酵母浸粉、肝浸粉各 5.0 g,葡萄糖 10.0 g,NaCl、K2HPO4、KH2PO4各1.0 g以及 FeSO4·7H2O 0.01 g,用蒸餾水溶解,定容至1 000 mL并調節pH值為7.2,再加入20.0 g瓊脂,即為雙歧桿菌培養基。
取蛋白胨、牛肉浸粉各10.0 g,酵母提取物5.0 g,葡萄糖20.0 g,K2HPO42.0 g和MgSO40.1 g溶解后,定容至1 000 mL并調節pH值為6.5,再加入15.0 g瓊脂,即為嗜酸乳桿菌培養基。
配制的液體培養基在121℃高壓滅菌30 min后,置于滅菌厭氧培養袋中,形成厭氧環境。使用0.3 mL無菌水對不同菌種凍干粉進行溶解,并在培養基中接種。將接種后的培養基放入厭氧培養袋中迅速加入厭氧產氣包,并且快速封口。隨后置于37℃培養箱中培養48 h。通過劃線平板法,對培養完畢的菌液進行接種,37℃環境下進行厭氧培養48 h。抽取單菌置于滅菌處理后的液體培養基,再于37℃培養48 h。
1.3.3 益生菌的增殖和產酸測定
益生菌的增殖測定參考包曉瑋等[12]的方法,略有修改。試管中加入10 mL培養基,在121℃下高溫滅菌20 min。向培養基中添加籽瓜多糖組分使其終濃度為2%。對活化狀態的試驗菌株進行接種,37℃厭氧密封條件下培養48 h,以1.3.2中配制的培養基為對照(CK)。測定各液體培養基的pH值,從而探究籽瓜多糖對試驗菌株增殖和產酸影響的差異。
1.3.4 籽瓜多糖對益生菌生長速率的影響
益生菌生長速率的測定參考Ouyang等[7]的方法,稍作修改。在試管內倒入10 mL培養基,再分別加入200 mg的SMP-1、SMP-2和SMP-3,得到3種含2.0%多糖組分培養基。經蒸餾水溶解,4 000 r/min下離心10 min,取上清液。在121℃下對該培養基進行高溫滅菌20 min。對活化狀態的4種菌株依次進行接種,厭氧條件下培養48 h。以1.3.2中配制的培養基為對照(CK)。分別在 0、4、8、16、24、32、40 和 48 h 測定培養液的吸光度(660 nm)。繪制4株菌在添加籽瓜多糖的培養基的生長曲線,評價4種腸道益生菌在多糖環境下的生長速率。
1.3.5 分子量的測定
分子量的測定參考Zhou等[13]的方法,略有改動。將100 mg粗多糖溶解至3 mL蒸餾水中,12 000 r/min離心10 min,取多糖溶液上清液進行上樣,利用多糖凝膠純化系統結合示差檢測器進行純化樣品,并且在線檢測收集。將收集液通過旋轉蒸發儀進行濃縮、冷凍干燥,得到凝膠柱分離純化過的多糖用于分子量測定。
取適量SMP-1配制成5 mg/mL溶液,12 000 r/min離心10 min,上清液用0.22 μm微孔濾膜過濾,然后將樣品轉置于1.8 mL進樣瓶中,進樣量20 μL。以不同相對分子質量的葡聚糖[分子質量分別為1 152、11 600、23 800、48 600、80 900、148 000、273 000、409 800 重均分子量(Mw)]作為標準品,作標準曲線,測定多糖的相對分子質量,得到峰位分子量、重均分子量、數均分子量校正曲線。根據標準品曲線,計算出樣品的分子量大小。
1.3.6 多糖的單糖組成分析
多糖的單糖組成分析參考Xu等[14]的方法,采用高效液相色譜儀進行分析。
1.3.7 紅外光譜分析
精密稱取SMP-1 2 mg和溴化鉀200 mg,壓制成片,空白采用溴化鉀粉末壓片而成。分別置于FTIR-650傅里葉變換紅外光譜儀中進行掃描記錄。
1.3.8 甲基化分析
甲基化分析參考Xu等[14]的方法。采用GCMS-QP-2010 SE氣相色譜質譜聯用儀對乙酰化產物進行測定。
氣相色譜質譜聯用(gas chromatograph-mass spectrometer,GC-MS)條件:色譜柱30 m×0.25 mm×0.25 μm;升溫條件為起始120℃,從3℃/min逐漸升溫,直到250℃;進樣口和檢測器溫度均為250℃,以氦氣為載氣,使流速達1 mL/min。
1.3.9 核磁共振分析
稱取SMP-1樣品50 mg,將其溶于0.5 mL重水中并冷凍干燥,重復3次,以充分交換活潑氫。然后將冷凍干燥后的樣品再用0.5 mL重水溶解。采用Bruker AV-600 MHz核磁共振(nuclear magnetic resonance,NMR)采集1H NMR譜、13C NMR譜、DEPT 135譜、氫-氫相關譜(H-H correlation spectroscopy,HH-COSY)、異核單量子關系譜(heteronuclear singular quantum correlation,HSQC)、異核多鍵相關譜(heteronuclear multiple bond correlation,HMBC)和核歐沃豪斯效應譜(nuclear overhauser effect spectroscopy,NOESY)分析多糖結構。
1.4 數據處理
試驗數據采用Microsoft excel 2010和SPSS 22.0進行圖形處理和分析。單個試驗均設置3個重復,采用均值±標準差形式表示試驗結果。
2 結果與分析
2.1 籽瓜多糖的分離
籽瓜多糖的洗脫曲線見圖1。
不同多糖組分的荷電性質存在差異,通過提高洗脫溶劑(NaCl)的離子強度從離子交換器中分離多糖組分。DEAE纖維素DE-52是分離多糖的常用介質,適用于各種中性和酸性多糖的分離。由圖1可知,籽瓜多糖在使用DEAE纖維素DE-52分離后,觀察到3個洗脫峰,并分別命名為SMP-1、SMP-2和SMP-3。收集3個組分,濃縮、脫鹽和凍干以進行下一步試驗。
2.2 籽瓜多糖組分對益生菌產酸的影響
培養基pH值的變化可以間接反映益生菌的生長狀況,青春雙歧桿菌、嬰兒雙歧桿菌、長雙歧桿菌和嗜酸乳桿菌培養基pH值變化見圖2。
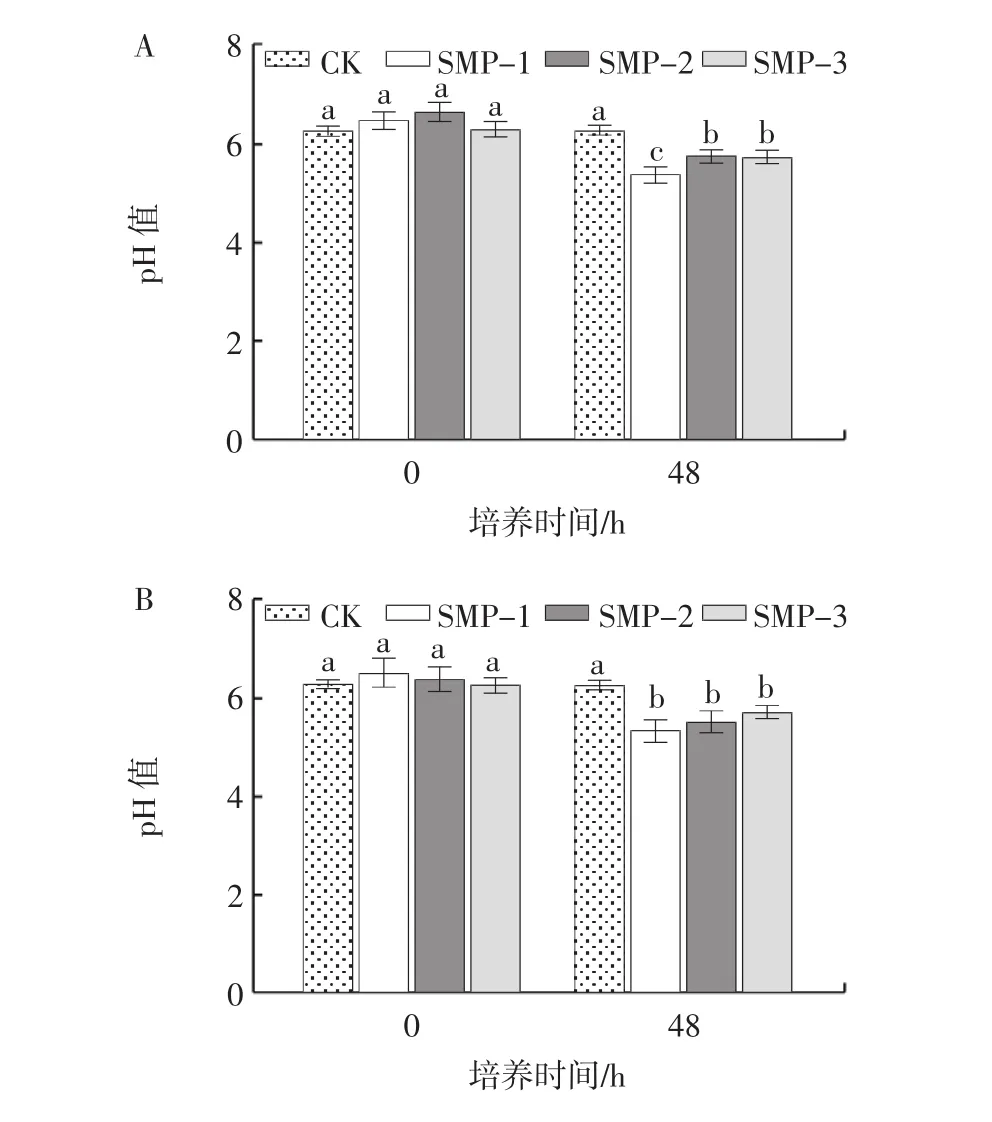
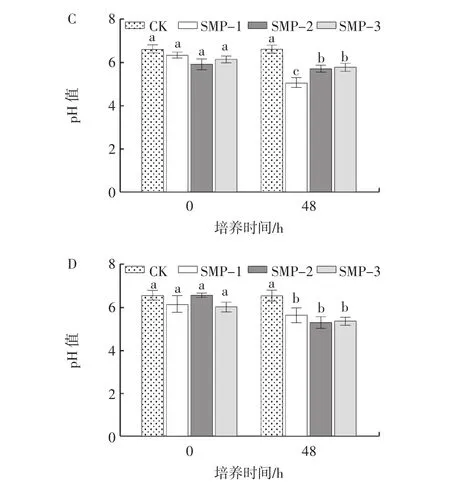
圖2 籽瓜多糖組分對青春雙歧桿菌、嬰兒雙歧桿菌、長雙歧桿菌和嗜酸乳桿菌培養基pH值的影響Fig.2 Effects of seed melon polysaccharides on media pH of Bifidobacterium adolescentis,Bifidobacterium longum,Bifidobacterium infantis and lactobacillus acidophilus
由圖2可知,隨著培養時間的延長,SMP-1、SMP-2和SMP-3組的pH值均逐漸下降,且3個籽瓜多糖組分均顯著促進了益生菌的增殖。對于青春雙歧桿菌和長雙歧桿菌,培養48 h時,SMP-1、SMP-2和SMP-3組的pH值均顯著低于對照組(p<0.05),且SMP-1的增殖作用優于SMP-2和SMP-3組(p<0.05)。而在接種嬰兒雙歧桿菌和嗜酸乳桿菌培養48 h時,SMP-1、SMP-2和SMP-3組間pH值無顯著差異(p>0.05)。結果表明,籽瓜多糖更好地被益生菌利用,促進益生菌的增殖。綜合考慮,選擇SMP-1進行后續試驗。
2.3 籽瓜多糖對益生菌生長速率產生的影響
600 nm波長下的OD值是反映益生菌生長狀況的方法之一,OD值與益生菌生長呈正比。籽瓜多糖組分SMP-1、SMP-2和SMP-3對青春雙歧桿菌、嬰兒雙歧桿菌、長雙歧桿菌和嗜酸乳桿菌生長的促進作用如圖3所示。

圖3 籽瓜多糖組分對青春雙歧桿菌、嬰兒雙歧桿菌、長雙歧桿菌和嗜酸乳桿菌生長速率的影響Fig.3 Effects of seed melon polysaccharides on the growth rate of Bifidobacterium adolescentis,Bifidobacterium longum,Bifidobacterium infantis and lactobacillus acidophilus
在添加籽瓜多糖SMP-1、SMP-2和SMP-3的培養基中,青春雙歧桿菌培養48 h后,OD600nm維持穩定(圖3A),這表明青春雙歧桿菌已處于相對平穩的生長狀態。8 h后,SMP-1對青春雙歧桿菌的促生長作用比各組分差異都顯著(p<0.05)。嬰兒雙歧桿菌培養32 h后SMP-2組OD600nm達到最大值,而嗜酸乳桿菌SMP-3組OD600nm最高(圖3B和圖3D),且培養結束時,嬰兒雙歧桿菌SMP-2組的OD600nm和嗜酸乳桿菌SMP-3組均高于對照和SMP-1組(p<0.05)。對于長雙歧桿菌,SMP-1組的OD600nm在16 h后始終顯著高于 SMP-2和 SMP-3組(p<0.05),說明 SMP-1對長雙歧桿菌的促生長作用要優于SMP-2和SMP-3(圖3C)。
綜上所述,SMP-1、SMP-2和SMP-3對益生菌的促進作用的影響存在差異,但3個組分均能促進4個益生菌的生長繁殖。結果表明,籽瓜多糖可能是一類潛在的益生元。
2.4 相對分子量分析
根據多糖組分對益生菌生長影響的測試結果,選擇SMP-1進行進一步的結構表征。SMP-1高效凝膠滲透色譜如圖4所示。

圖4 籽瓜多糖SMP-1高效凝膠滲透色譜分析Fig.4 High-performance gel permeation chromatography profiles of SMP-1 of seed melon polysaccharides
由圖4可知,SMP-1有3個吸收峰,有進一步分離純化的空間,其分子量為97 403 Da。
2.5 單糖成分分析
SMP-1單糖成分分析見圖5。籽瓜多糖SMP-1的單糖組成和物質的量百分比見表1。

圖5 單糖標準品和籽瓜多糖SMP-1的單糖組成Fig.5 Monosaccharide composition of standard and SMP-1

表1 籽瓜多糖SMP-1的單糖組成和物質的量百分比Table 1 Monosaccharide composition and molar percentage of SMP-1 of seed melon polysaccharides
由圖5可知,單糖標準品的出峰順序分別為鼠李糖、巖藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖。各單糖標準品分離效果明顯,峰形尖銳,可用于后續SMP-1單糖組成比對分析。比對結果如表1所示,在7個單糖中,SMP-1多糖僅含有阿拉伯糖和半乳糖,其物質的量百分比分別為0.271%和0.729%。
2.6 紅外圖譜分析
籽瓜多糖SMP-1的紅外光譜見圖6。
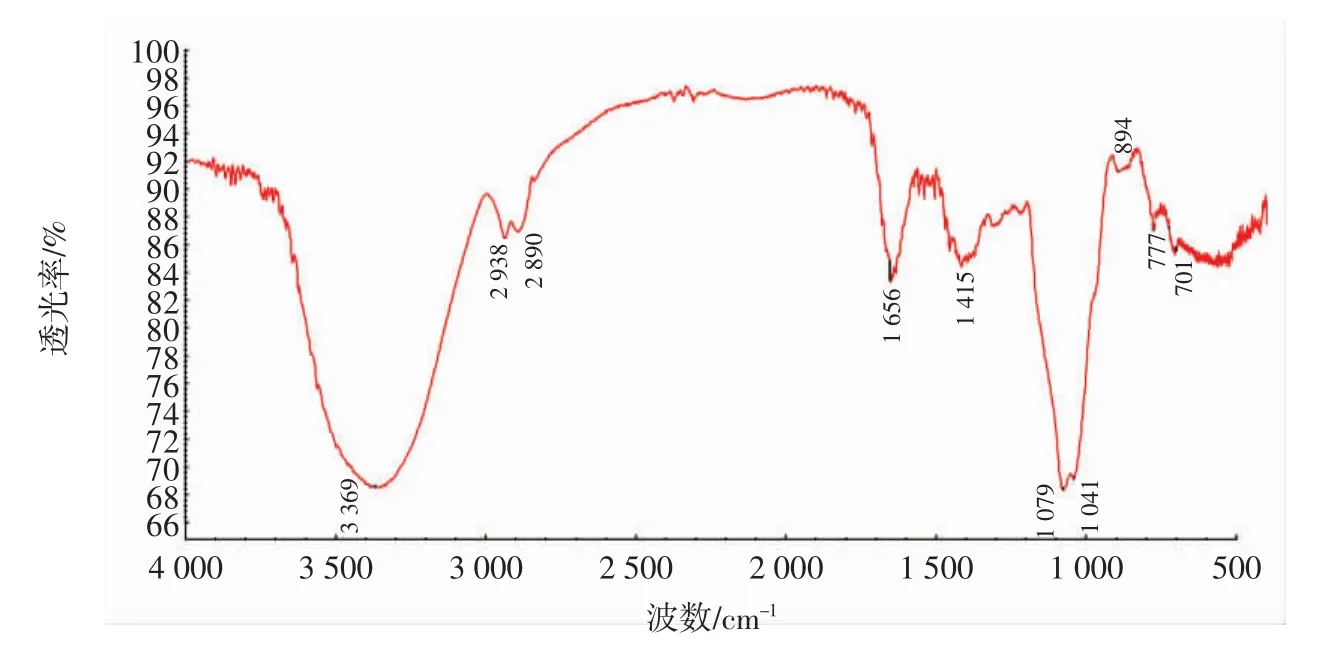
圖6 籽瓜多糖SMP-1的紅外光譜圖Fig.6 Infrared spectrum of SMP-1 of seed melon polysaccharides
由圖6可知,多糖類物質的典型特征吸收帶在3 600 cm-1~3 200 cm-1處為-OH處的振動吸收峰,該區域的吸收峰,實質上也是糖類表現的特征峰,即3 369 cm-1,可作為糖類相應的特征峰。于1 656 cm-1處有1個吸收峰,歸屬于C=O的伸縮振動。1 415 cm-1歸屬于C-O的伸縮振動引起的吸收峰。在1 079 cm-1處有吸收峰為C-O伸縮振動引起的。在1 041 cm-1處吸收峰屬于O-H變角振動,該紅外存在777 cm-1吸收峰,歸屬于對稱環伸縮振動。896 cm-1存在吸收峰,歸屬于半乳吡喃糖環的β-端基差向異構的C-H變角振動;但β-端構型推斷并不能完全確定,需要做核磁分析進一步確定。
2.7 甲基化分析
單糖殘基的類型是由甲基化分析來確定。完全甲基化的籽瓜多糖SMP-1經水解、還原和乙酰化,最后得到部分甲基化的糖醇乙酸酯,然后采用氣相色譜質譜聯用儀(gas chromatography-mass spectrometry,GCMS)分析檢測SMP-1的單糖種類、連接方式以及組成比例,籽瓜多糖SMP-1的甲基化分析見表2。
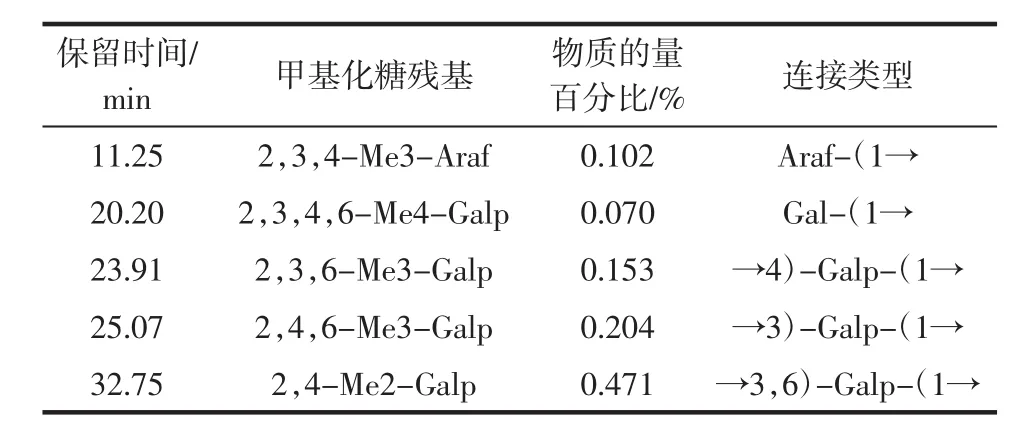
表2 籽瓜多糖SMP-1的甲基化分析Table 2 Methylation analysis of SMP-1 of seed melon polysaccharides
由表2可知,占比較多的是由→3)-Galp-(1→和→3,6)-Galp-(1→組成,糖苷鍵連接方式較為復雜。
2.8 核磁共振分析
采用核磁共振一維圖譜(1H NMR、13C NMR)和二維圖譜(COSY、HSQC和HMBC)對籽瓜多糖SMP-1的糖殘基組成,以及各糖殘基在多糖分子鏈中的鏈接方式進行分析,結果見圖7和圖8。

圖8 籽瓜多糖SMP-1的二維NMR圖譜Fig.8 Two dimensional NMR spectra of SMP-1 of seed melon polysaccharides
由圖7A可知,化學位移介于3.0~5.5。化學位移為3.2~4.0 表示糖環質子信號,基質子峰 5.16、5.01、δ4.56、4.46、4.44的信號峰集中分布在 4.3~5.5。
由圖7B可知,核磁碳譜信號化學位移分布于60~120。由碳譜可知,異頭碳信號峰為110.62、109.25、105.73、104.79、104.51,異頭碳信號區域主要在 93~105。而非異頭碳信號峰為 85.22、83.48、82.69、82.43、82.27、81.47、79.04、77.95、77.84、77.53、76.50、76.33、75.87、75.10、74.67、74.33、74.11、74.00、73.20、72.12、71.61、71.23、70.74、70.00、69.85、62.64、62.37、62.10、61.37、非異頭碳信號都集中在60~85。根據單糖組成結果,該多糖由阿拉伯糖和半乳糖組成,說明該多糖主要為阿拉伯半乳聚糖。
由圖7C可知,在SMP-1的Dept135圖譜中,70.72、68.62、62.63、62.41、62.36、62.10 峰為倒峰,表明為 C6的化學位移。70.72向高場遷移,表明存在取代。
籽瓜多糖SMP-1的二維NMR圖譜見圖8。
由圖8A可知,H1-2的信號為4.47/3.57;H2-3的信號為3.57/3.68;H3-4的信號為3.68/4.05;H4-5的信號為4.05/3.87;H5-6a的信號為3.87/3.96,可以推斷出H1、H2、H3、H4、H5、H6a 分別為 4.47、3.57、3.68、4.05、3.87、3.96。對應的 C1-C5 為 104.69、71.31、81.5、69.82、74.81、70.76;圖8B 顯示,異頭碳信號為 104.69,HSQC圖譜中對應的異頭氫信號是4.47。因此,該信號應歸屬于糖苷鍵→3,6)-Galp-(1→。
由圖8C可知,多糖的糖苷鍵信號進行歸屬:糖苷鍵→4)-β-D-Galp-(1→的異頭碳和→3)-β-D-Galp-(1→的H3存在相關峰,可見具有→4)-β-D-Galp-(1→3)-β-D-Galp-(1→;糖苷鍵→3)-β-D-Galp-(1→的異頭碳和→3,6)-β-D-Galp-(1→的 H6b 存在相關峰,可見具有→3)-β-D-Galp-(1→3,6)-β-DGalp-(1→;→3,6)-β-D-Galp-(1→異頭氫與自身的→3,6)-β-D-Galp-(1→的 C6 有相關峰,表明存在→3,6)-β-D-Galp-(1→3,6)-β-D-Galp-(1→;糖苷鍵→3,6)-β-D-Galp-(1→的異頭碳 104.69 與→4)-β-D-Galp-(1→的 H4 4.08 有相關信號峰,為→3,6)-β-D-Galp-(1→4)-β-D-Galp-(1→的鏈接方式。
根據類似規律并結合HMBC圖譜和NOESY圖譜,對所有糖苷鍵信號進行歸屬,結果見表3。
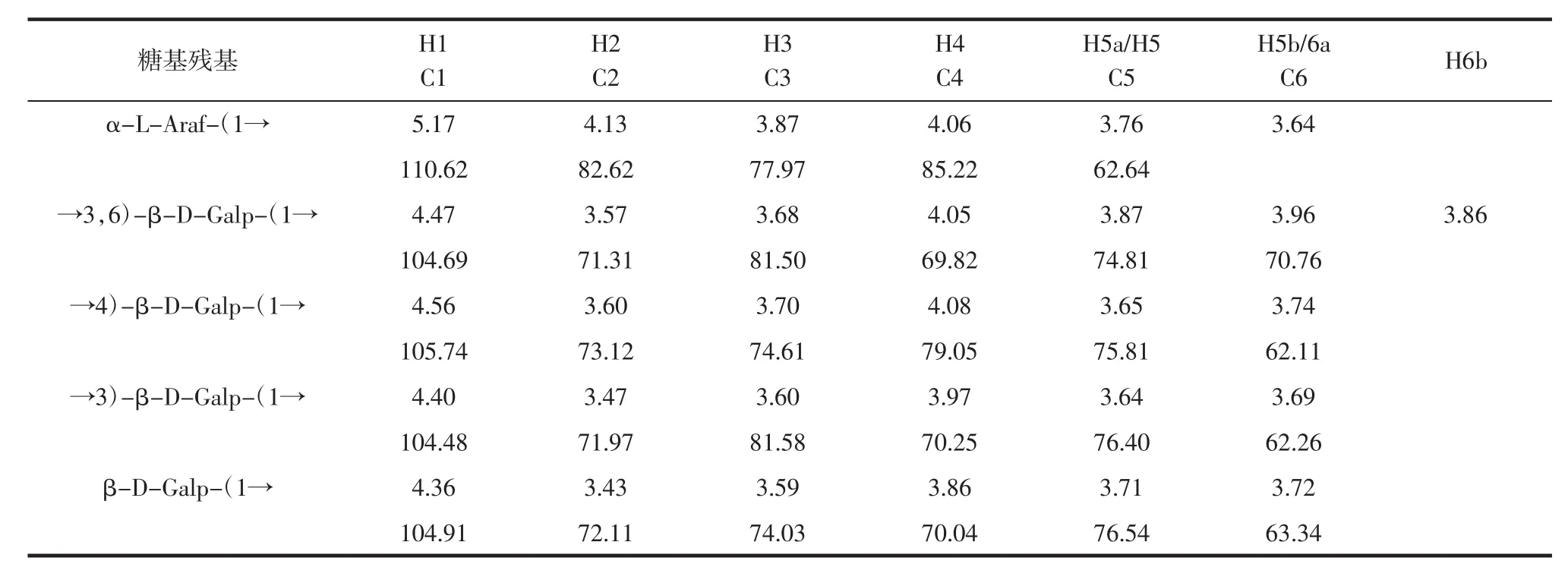
表3 糖苷鍵信號歸屬Table 3 Glycoside bond signal assignment
2.9 SMP-1基本結構特征
通過單糖組成、紅外光譜、甲基化、核磁共振等結果表明,籽瓜多糖SMP-1的基本結構特征是:SMP-1為1種中性多糖,由半乳糖和阿拉伯糖組成。推斷該多糖的主鏈連接方式為→6)-β-D-Galp-(1→3)-β-D-Galp-(1→的糖苷鍵,而端基是由 α-L-Araf-(1→通過O-3鍵連接在主鏈上。籽瓜多糖SMP-1的一級結構見圖9。
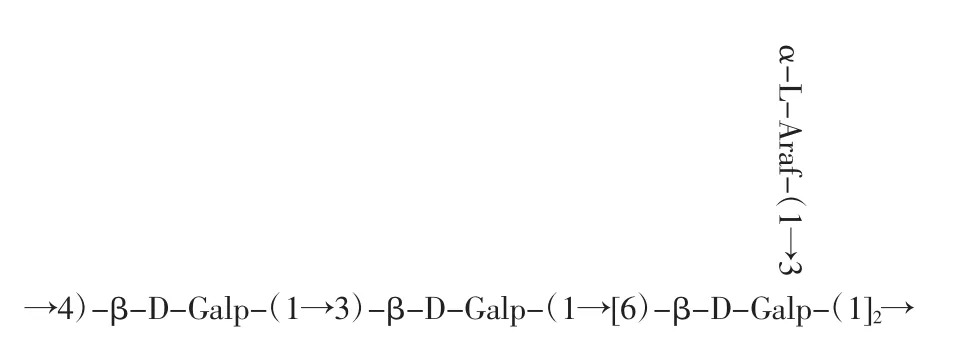
圖9 籽瓜多糖SMP-1的一級結構Fig.9 Primary structure of SMP-1 of seed melon polysaccharides
3 討論與結論
人體腸道菌群存在著多種細菌,是一個復雜的細菌生態系統[15-16]。大量研究表明,多糖能促進益生菌體外生長[17-18]。前期研究發現,廢棄籽瓜瓜瓤可以作為獲取多糖的重要來源之一[8]。在本試驗中,經分離純化后得到SMP-1、SMP-2和SMP-3 3個多糖組分,它們均能誘導與調節青春雙歧桿菌、嬰兒雙歧桿菌、長雙歧桿菌和嗜酸乳桿菌的增殖,且SMP-1的效果優于SMP-2和SMP-3。上述結果表明,籽瓜多糖是一種潛在的益生元且對腸道益生菌具有促進增殖的效果。聚合度會影響糖類對益生菌的增殖作用,聚合度越低其分子量越小,更容易被益生菌利用[19-20]。郝林華等[21]認為多糖對益生菌的促生長作用較明顯的為高純度、β-型糖苷鍵連接的低聚糖,從而證實益生元作用與糖的結構、純度等因素有關。因此,基于籽瓜多糖對益生菌生長效應的試驗結果,選擇SMP-1進一步的結構表征。
多糖自身的生物活性與其分子量、化學組成和結構均有很大的關聯[22]。在南瓜中,與雜多糖ATPS-PP-2相比,低分子量的ATPS-PP-1對胰島細胞具有更好的降血糖活性[23]。較豐富的糖醛酸能改變植物多糖結合物的理化性質和溶解度,具有較高的抗氧化活性[24]。本試驗結果表明,SMP-1的分子量為97.40 kDa。其組分由阿拉伯糖和半乳糖構成,所包含的單糖種類較少。與其他植物來源相比,SMP-1的單糖組成與它們存在較大差異,這可能是由品種間差異造成的[25-26]。植物多糖的結構特征,如β-(1)-→3)-在主鏈中的連接對多糖的生物活動至關重要[27]。由(1→3)和(1→4)-Glc p 糖苷連接的南瓜多糖具有更好的降血糖活性[23]。本試驗借助紅外光譜掃描、甲基化以及核磁共振波譜分析等多種手段,對SMP-1相應的一級結構予以表征,可推斷其結構式為主鏈連接方式,主要包含的糖苷鍵為→6)-β-D-Galp-(1→3)-β-D-Galp-(1→,端基是由 α-LAraf-(1→通過O-3鍵連接在主鏈上。
綜上所述,籽瓜多糖是一種潛在的益生元,可以明顯促進青春雙歧桿菌、嬰兒雙歧桿菌、長雙歧桿菌和嗜酸乳桿菌的生長。SMP-1構效關系分析表明,籽瓜多糖SMP-1的促生長作用可能與其分子量、單糖組成和糖苷鍵結構的差異有關。籽瓜多糖SMP-1的主鏈連接方式為→6)-β-D-Galp-(1→3)-β-D-Galp-(1→的糖苷鍵,而端基α-L-Araf-(1→通過O-3鍵連接在主鏈上。本研究主要分析籽瓜多糖對于益生菌生長的促進效應,為籽瓜多糖的進一步開發利用奠定基礎。為了深入了解籽瓜多糖的作用機理,有必要進一步分離純化籽瓜多糖,并對其高級結構和功能進行詳細研究。

