阪崎克羅諾桿菌耐干燥相關基因ESA-00281的功能研究
呂文,張正陽,李萍,杜欣軍*,王碩
(1.食品營養與安全國家重點實驗室,天津科技大學食品科學與工程學院,天津 300457;2.天津市食品科學與健康重點實驗室,南開大學醫學院,天津 300071)
阪崎克羅諾桿菌是一種兼性厭氧革蘭氏陰性細菌,不產生孢子,但具有形成生物膜的能力,可以在人類和動物的腸道中存活[1]。該菌是一種食源性病原體,通常檢出于嬰兒配方奶粉中。該致病菌可以引起嬰幼兒菌血癥、腦膜炎和壞死性小腸結腸炎等,死亡率較高[2]。此外,該細菌還會感染免疫功能減弱的老年人和成年人,并導致肺炎、結膜炎、傷口感染和尿路感染等[3-4]。這種細菌對各類極端外部環境表現出不同的抵抗力,例如耐酸性[5]、耐藥性[6]和耐壓力性[7]。與其他細菌相比,耐干燥性是阪崎克羅諾桿菌最突出的環境抵抗能力,這也是導致食品污染、引起嬰幼兒感染的重要原因[8-10]。因此,研究阪崎克羅諾桿菌的耐干燥機制具有重要意義,能夠為防治該病原菌提供重要的參考。
目前的研究表明,生物膜、海藻糖和細胞中的相容物質有利于阪崎克羅諾桿菌對抗周圍環境中的不利因素。生物膜不僅有助于細菌附著在一些物體的表面,還能增強微生物在各種環境中的抵抗力[11]。生物膜的產生可以增強細菌在低水活度環境中的生存能力,同時增強細胞對外界環境壓力的抵抗能力[12]。在低水分條件下,阪崎克羅諾桿菌可以產生大量的海藻糖。海藻糖可穩定磷脂膜和蛋白質之間的結構,以抵抗有害的外部干燥環境[13]。此外,細胞中相容物質的攝取和合成,如脯氨酸、甜菜堿、甘氨酸、膽堿也可以在滲透調節過程中發揮關鍵作用,從而保護菌株細胞免受干燥環境造成的損害[14]。雖然目前對于阪崎克羅諾桿菌耐干燥機制已經開展了一些研究,但并未發現屬于該菌的獨特機制,因此,很難解釋阪崎克羅諾桿菌突出的干燥抵抗能力。需要進一步研究該致病菌突出耐干燥能力的潛在機制。
前期對一株耐干燥能力較強的阪崎克羅諾桿菌進行了蛋白質組學分析,從蛋白表達水平分析了菌株在干燥刺激前后蛋白表達的差異[15]。其中,ESA-00281基因編碼的假設蛋白表現出明顯的表達差異。對比分析顯示,它與鼠傷寒沙門氏菌中對應的同系物STM3155相似度為51.88%,STM3155由于在半固體培養基中表達情況類似于其他的運動相關基因,因此,被描述為運動基因[16]。Hartmann等[11]通過轉座子突變構建阪崎克羅諾桿菌ESA-00281突變體發現,該基因對生物膜結構有強烈影響,且有助于與Caco-2腸上皮細胞的黏附。但該基因對阪崎克羅諾桿菌脫水耐受性的影響及其作用機制尚需進一步研究。
本研究構建阪崎克羅諾桿菌ATCC BAA-894的ESA-00281基因敲除菌株和回補菌株,基于對野生株、突變株及回補株的耐干燥能力、表面疏水性、膜透過性以及運動性、生物膜形成能力進行比較分析,探究ESA-00281基因在阪崎克羅諾桿菌耐干燥過程中的可能作用機制,可為阪崎克羅諾桿菌的防控提供參考。
1 材料與方法
1.1 材料與試劑
阪崎克羅諾桿菌標準菌株ATCC BAA-894:美國菌種保藏中心。S17lambda pir菌株、DH5α菌株、pCVD442質粒等為食品營養與安全國家重點實驗室保存。
限制性內切酶BamHI、SalI:美國NEB公司;DNA提取試劑盒:天根生化科技有限公司;肉膏蛋白胨培養基(lauria broth,LB):美國BD公司;平板計數瓊脂培養基:國藥集團化學試劑有限公司;RPMI-1640培養液:賽默飛世爾科技(中國)有限公司;質粒小提試劑盒:美國OMEGA公司;無縫克隆和組裝試劑盒:中國諾唯贊生物科技有限公司;甲醛(分析純):上海生工生物有限公司;結晶紫、1-N-苯基萘胺(分析純)、二甲苯(分析純):天津泰進科技有限公司。
1.2 主要儀器
DYY-6C型電泳儀、WD-9405B型水平搖床:北京市六一儀器廠;德國Eppendorf公司;UV-Vis紫外可見分光光度計:上海光譜儀器有限公司;HCJ-4C型磁力攪拌水浴鍋:蘇州東鵬儀器制造有限公司;5424C-150339型臺式離心機:艾本德中國有限公司;LBI-250型生化培養箱:上海龍躍儀器設備有限公司;OHG-914385型電熱恒溫鼓風干燥箱:上海新苗醫療器械制造有限公司;Sunrise Basic酶標儀:奧地利Tecan公司。
1.3 試驗方法
1.3.1 引物設計
參考美國國立生物技術信息中心(National Center for Biotechnology Information,NCBI)阪崎克羅諾桿菌ATCC BAA-894基因序列設計引物(Genbank序列號:NC_009778.1),引物序列見表1,引物位置見圖1。

圖1 引物位置示意圖Fig.1 Locations of primers

表1 試驗引物Table 1 Primers for test
1.3.2 ESA-00281基因缺失突變體的構建
在阪崎克羅諾桿菌ATCC BAA-894中,使用pCVD442自殺載體介導的同源重組實現ESA-00281基因的敲除[17]。使用引物pCVD442F和pCVD442R(表1)對pCVD442進行線性化。使用兩對引物ESA-00281UF/ESA-00281UR和ESA-00281DF/ESA-00281 DR(表1)從阪崎克羅諾桿菌ATCC BAA-894的DNA中擴增ESA-00281的上下同源臂。使用商用無縫克隆和組裝試劑盒將上游和下游片段克隆到pCVD442自殺載體中,生成目標載體pCVD442-Q-H。將目標載體轉化到大腸桿菌S17 lambda pir,然后通過電轉化構建缺失突變體ΔESA-00281。
1.3.3 回補菌株的構建
使用含有限制性內切酶位點的cpESA-00281F/cpESA-00281R引物(表1)從阪崎克羅諾桿菌ATCC BAA-894的基因組DNA中擴增ESA-00281基因。將產物克隆到pACYC184,轉移到突變體中獲得回補菌株cpESA-00281。對重組質粒和回補菌株中ESA-00281編碼區的核苷酸序列進行測序驗證。
1.3.4 生長曲線的測定
取活化后的菌液按照1∶100(體積比)接種于LB液體培養基中培養14 h。從轉接開始,每隔1 h取樣,測定OD600。用LB液體培養基作為空白對照。測定菌液OD600直至平臺期,最后繪制出生長曲線。比較阪崎克羅諾桿菌ATCC BAA-894野生型菌株、ΔESA-00281突變株和回補株生長曲線的差異。每個樣本作3個平行。
1.3.5 耐干燥性評估
將菌株活化,以1∶100(體積比)將10μL培養12h~14 h的菌液接種于1 mL LB液體培養基培養到對數期(OD600值為0.6~0.8),平板計數瓊脂培養基培養12 h~14 h后進行平板計數,得到干燥前的菌落總數。將對數期的菌液加入96孔板并置于滅菌的干燥器中(內有500 g脫水硅膠),封口膜密封,每個干燥器內放置1個96孔細胞培養板,置于溫度為37℃、濕度為45%的恒溫培養箱恒溫恒濕培養6 d后取出96孔板,在每個孔中加入200 μL/孔的磷酸鹽緩沖溶液,梯度稀釋后平板計數瓊脂培養基培養12 h~14 h后進行平板計數,得到干燥后的菌落總數。以上步驟重復3次,計算死亡率。死亡率越高,耐干燥能力越弱。
1.3.6 表面疏水性評估
將菌株接種于LB液體培養基中,置于搖床中振蕩培養(37℃、200 r/min)12 h~14 h。5 000 r/min離心5 min后收集菌體,用磷酸鹽緩沖溶液沖洗3次后,將OD600調至0.5,將2 mL細菌懸浮液與400 μL二甲苯混合液在室溫(25±1)℃下培養2 h,取出水相物質測定OD600值,記為H。細菌表面疏水性指數(H/%)計算公式為H/%=(0.5-H)/0.5 ×100[18]。
1.3.7 生物膜形成能力評估
將菌株接種于10 mL LB液體培養基中,37℃培養至細胞密度達到107CFU/mL,各取100 μL菌液加入96孔細胞培養板中,以無菌的LB培養基為空白對照,置于37℃恒溫培養箱靜置培養48 h。48 h后取出96孔板,將懸浮的菌液吸出,待平板完全干透后于孔中加入200 μL 99%甲醇將生物膜固定15 min,吸出上清液,將平板晾干。隨后,向孔中加入200 μL 0.1%結晶紫(crystal violet,CV)溶液。30 min后取出多余的 CV,用生理鹽水清洗3次,將結晶紫溶液洗凈。最后,加入200 μL 95%乙醇釋放結合的CV。使用Sunrise Basic酶標儀在570 nm處測量吸光度。
1.3.8 運動能力評估
運動性分析參考文獻[19]稍加修改。將菌株接種于LB液體培養基中,置于搖床中振蕩培養(37℃、200 r/min)12 h~14 h。吸取 5 μL 菌液滴于軟瓊脂平板(含0.3%瓊脂的LB瓊脂培養基)中央,待無菌風吹干后封口膜密封于30℃恒溫培養箱倒置培養12 h~14 h,觀察菌落大小。
1.3.9 膜透過性評估
將菌株接種于LB液體培養基中,振蕩培養(37℃、200 r/min)12 h~14 h。12 000 r/min離心 1 min獲得菌體沉淀,用磷酸緩沖鹽溶液洗滌3次后,利用磷酸緩沖鹽溶液將菌體復溶至OD600值為0.5。取1.92 mL細胞懸液和80 μL熒光探針1-N-苯基萘胺混合,設置熒光分光光度計的寬度、激發波長和發射波長分別設置為5、350 nm和420 nm,在此條件下監測混合物的熒光強度[20]。
1.4 數據處理與統計學分析
使用Origin8.0進行統計分析。每個試驗獨立重復3次,以確保重復性。所有結果均采用鄧肯多區間檢驗和方差分析(ANOVA)進行分析,以分析組間的差異。
2 結果與分析
2.1 ESA-00281缺失突變體和回補菌株的構建與驗證
構建ESA-00281基因敲除突變體ΔESA-00281及相應的回補菌株cpESA-00281。突變株和回補株的聚合酶鏈式反應(polymerase chain reaction,PCR)驗證結果見圖2。

圖2 突變株和回補株的PCR驗證Fig.2 PCR validation of the mutant and complementary strains
利用ESA-00281F/R和YZESA-00281F/R引物對突變株進行驗證,利用ESA-00281F/R對回補株進行驗證。結果顯示,ESA-00281F/R引物對在野生株、突變株和回補株中擴增片段大小為367 bp、無擴增、367 bp,YZESA-00281F/R引物對在野生株和突變株中擴增片段大小分別為979、577 bp,證明敲除株和回補株均構建成功。
2.2 ESA-00281在阪崎克羅諾桿菌ATCC BAA-894中的作用分析
2.2.1 阪崎克羅諾桿菌野生株、突變株及回補株生長曲線的測定
Research on coupled heating system of air source heat pump and gas boiler
用紫外可見分光光度計測定生長曲線,結果見圖3。

圖3 阪崎克羅諾桿菌野生株、突變株及回補株的生長曲線Fig.3 Growth curves of wild,mutant and complementary strains of C.sakazakii
由圖3可知,與野生株相比,ΔESA-00281突變體及cpESA-00281回補株表現出類似的生長速度,回補株相對于其他兩株菌先進入對數期,但三者均符合細菌正常生長的規律,OD600均于10 h左右開始保持穩定。結果表明,生長性能并不受基因缺失的影響,排除了不同生長規律對后續試驗結果的影響。
2.2.2 阪崎克羅諾桿菌野生株、ΔESA-00281突變株及回補株耐干燥性評估
對阪崎克羅諾桿菌野生株、突變株及回補株6 d干燥脅迫下的死亡率進行檢測,結果見圖4。

圖4 阪崎克羅諾桿菌野生株、突變株及回補株的干燥死亡率Fig.4 Desiccation-induced mortality rates of wild,mutant and complementary strains of C.sakazakii
由圖4可知,野生株、突變株、回補株的干燥死亡率分別為56.02%、64.78%、57.84%。干燥刺激后,相對于野生株 WT,ΔESA-00281突變株的死亡率有所升高,回補株的死亡率則與野生株大致相同,表明ESA-00281基因的缺失降低了阪崎克羅諾桿菌的干燥耐受能力,ESA-00281在阪崎克羅諾桿菌抵御干燥環境過程中起到正向作用。
2.2.3 表面疏水性分析
對野生株、ΔESA-00281突變株及其回補株的表面疏水性進行了比較分析,結果見圖5。
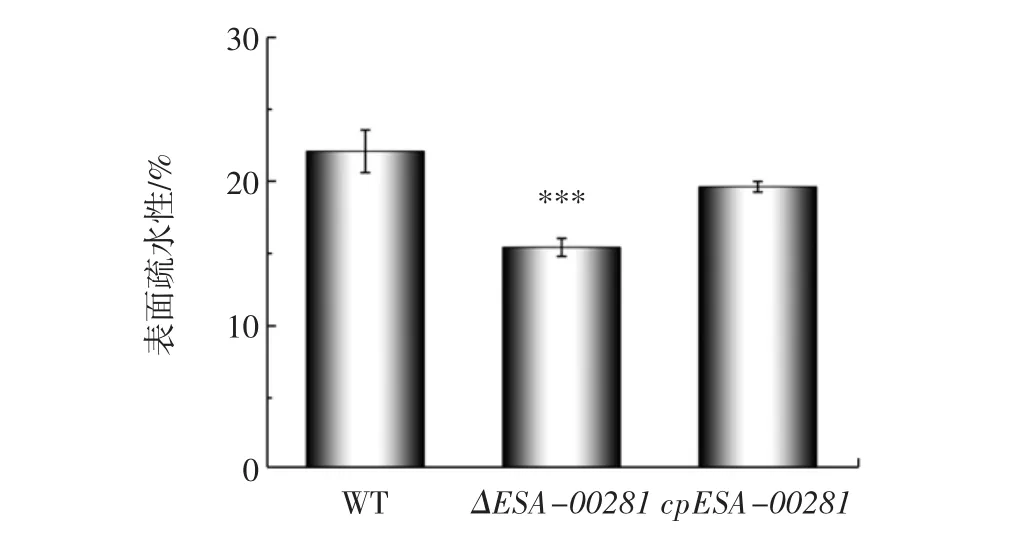
圖5 阪崎克羅諾桿菌野生株、突變株及回補株細胞表面疏水性Fig.5 Cell surface hydrophobicity of wild,mutant and complementary strains of C.sakazakii
2.2.4 生物膜形成能力分析
采用結晶紫染色研究ESA-00281基因對阪崎克羅諾桿菌ATCC BAA-894生物膜形成的影響,結果見圖6。
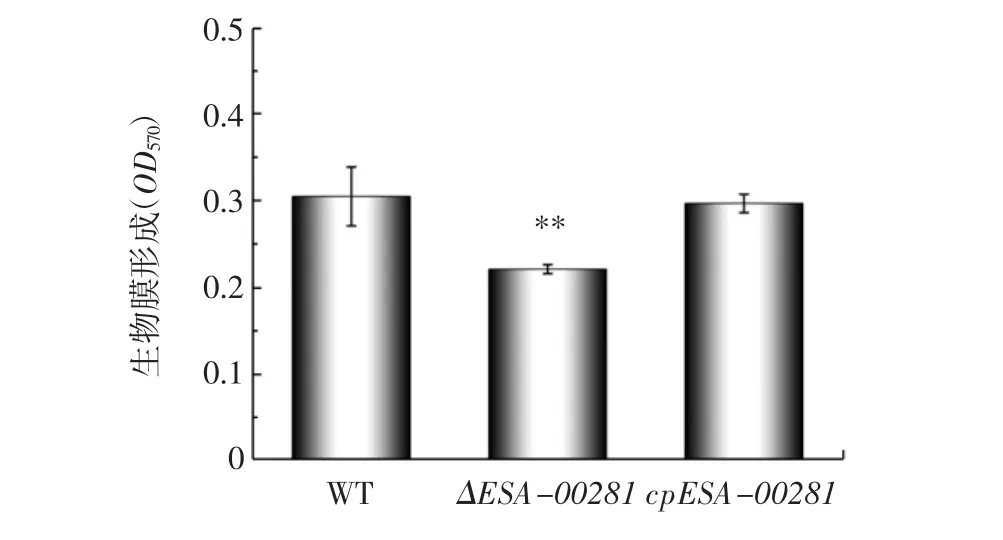
圖6 阪崎克羅諾桿菌野生株、突變株及回補株的生物膜形成能力比較Fig.6 Biofilm formation capacity of wild,mutant and complementary strains of C.sakazakii
由圖6可知,與野生型相比,ΔESA-00281突變株的生物膜量明顯減少,回補株的生物膜形成能力與野生株相似。結果表明,ESA-00281基因在生物膜形成方面發揮正向作用。
2.2.5 運動能力分析
阪崎克羅諾桿菌在半固體培養基培養可以形成明顯的運動環。野生株(WT)、ΔESA-00281突變株和cpESA-00281回補株的菌株運動性結果見圖7。

圖7 阪崎克羅諾桿菌野生株、突變株及回補株的運動性鑒定Fig.7 Mobility identification of wild,mutant and complementary strains of C.sakazakii
由圖7可知,與野生株相比,ΔESA-00281突變株的運動環直徑無明顯變化,表明ESA-00281對阪崎克羅諾桿菌的運動性無關。
2.2.6 膜透過性測定結果
對阪崎克羅諾桿菌野生株、ΔESA-00281突變株及回補株細胞的外膜通透性進行測定,結果見圖8。
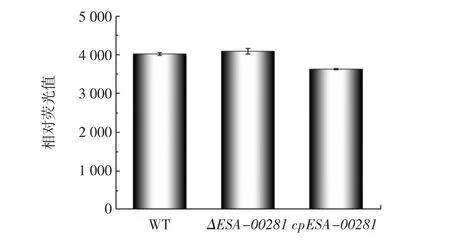
圖8 阪崎克羅諾桿菌野生株、突變株及回補株細胞膜通透性測定Fig.8 Membrane permeability of wild,mutant and complementary strains of C.sakazakii
由圖8可知,與野生株相比,ΔESA-00281突變株的膜通透性無明顯變化,說明ESA-00281基因的缺失并不會影響其外膜通透性。
3 討論與結論
以上試驗說明,ESA-00281基因對菌體生長、運動性以及細胞膜通透性無明顯影響,可通過調節細胞表面疏水性及生物膜的形成能力等機制以抵抗外界環境的壓力并確保生命活動的正常進行,從而應對干燥脅迫,調節菌株的耐干燥性能。在面對外界復雜的生存環境時,最先感知到外界變化并作出響應的往往是細菌細胞的表面,細菌細胞的表面具有許多生物活性物質,它們體現了細菌生命活動的情況,其變化會影響細胞的表面疏水性。在液體環境中,細胞表面的疏水作用使細胞表面具有一定的黏附能力[21],從而增強其生存能力。文獻[11]表明,該基因對Caco-2細胞的黏附有一定的影響。因此,ESA-00281基因缺失導致的表面疏水性降低可能是該突變株耐干燥能力下降的原因之一。細菌細胞形成菌膜能有效提高對外界環境的耐受性[22]。一般認為,細菌可以通過形成生物膜以增加對干燥環境的抵抗力[23]。很多報道已經顯示,菌膜形成對沙門氏菌[24]、單核細胞增生李斯特菌[25]和大腸桿菌抵抗干燥環境具有重要作用[26]。本結果表明,ESA-00281可能通過促進生物膜的形成進而增強耐干燥能力。
本文利用基因敲除技術構建了ΔESA-00281突變株,并以此研究阪崎克羅諾桿菌ATCC BAA-894中該基因的功能。對阪崎克羅諾桿菌ATCC BAA-894野生株及ΔESA-00281突變株的耐干燥性比較結果顯示,ESA-00281基因缺失后菌株在干燥脅迫下的死亡率有所升高,表明該基因在阪崎克羅諾桿菌耐干燥中發揮正向作用。此外,對阪崎克羅諾桿菌ATCC BAA-894野生株及ΔESA-00281突變株的生理活性進行比較分析,結果顯示,ESA-00281對于阪崎克羅諾桿菌的生物膜形成及表面疏水性發揮正向調節作用,表明該基因可能通過改變表面疏水性來調節生物膜的形成和對介質的黏附,從而正向調節菌株的耐干燥能力。

