舒肝和絡醒脾方對肝纖維化模型大鼠肝組織Wnt/β-Catenin信號通路的影響
王奎淞, 張秋菊, 魏書瑤, 殷世鵬, 李婕妠, 陳世玉, 郭嘉琪, 趙鯤鵬
甘肅中醫藥大學 a.中醫臨床學院, b.基礎醫學院, c.公共衛生學院, d.圖書館古籍部, 蘭州 730000
肝纖維化是各種慢性肝損傷導致的肝內膠原纖維異常增生的病理過程,是多種慢性肝病發展至肝硬化的必經階段。由于其形成機制十分復雜,目前在臨床上尚無理想的、公認的抗纖維化特效藥物[1]。中藥復方湯劑具有經多靶點、多途徑發揮作用的特點,在抗肝纖維化治療中具有獨特優勢。甘肅省國醫大師周信有教授將肝纖維化“細胞外基質沉積(肝損傷)-肝纖維化特征性改變(纖維化)-大量假小葉形成(肝硬化)”過程提煉為中醫學“絡脈瘀滯-微小癥積-癥積形成”理論,提出“舒肝和絡醒脾法”學說,并基于此結合臨床驗效擬舒肝和絡醒脾方,具有舒肝醒脾、祛瘀活絡、益氣養血之功效[2]。
Wnt/β-Catenin是具有調節細胞增殖和分化功能的Wnt家族經典蛋白信號通路,當該信號通路被激活后,可以調節許多器官的纖維化發展過程,與肝纖維化疾病的發生發展密切相關[3]。且該通路Wnt1/β-Catenin/Cyclin D1導致肝纖維化形成的機理與“舒肝和絡醒脾法”學說不謀而合。故本研究旨在觀察舒肝和絡醒脾方對CCl4誘導的肝纖維化模型大鼠的治療作用,并探討其是否通過調控Wnt/β-Catenin信號通路發揮影響,驗證“舒肝和絡醒脾法”學說的科學性,并為該復方的臨床應用提供實驗數據支撐和理論依據。
1 資料與方法
1.1 實驗材料
1.1.1 動物 雄性6周齡SPF級Wistar大鼠60只,體質量(200±20)g,飼養于室溫20~25 ℃,濕度50%~65%的12 h光暗循環環境,自由進食和飲水,由甘肅中醫藥大學實驗動物中心提供,實驗動物生產許可證編號:SCXK(甘)2020-0001,實驗動物使用許可證編號:SYXK(甘)2020-0009。
1.1.2 藥物及制備 舒肝和絡醒脾方組成:醋柴胡10 g、岷當歸15 g、炙黃芪12 g、莪術12 g、鱉甲10 g、枳椇子10 g,購于甘肅中醫藥大學附屬醫院。灌胃藥劑采用水提法將各單味藥物按臨床用藥比例混合制備:(1)加5倍量水不浸泡,回流提取0.5 h,趁熱過濾;(2)藥渣再加4倍量水回流提取0.5 h,趁熱過濾,并將濾液合并;(3)高劑量組濃縮至每1 mL含生藥1.24 g,低劑量組稀釋至每1 mL含生藥0.31 g[4]。陽性對照組藥物選用水飛薊賓葡甲胺片(江蘇中興藥業有限公司,批號:H32026145,0.5 mg/片)。
1.1.3 試劑及耗材 食用玉米油(上海益海嘉里金龍魚糧油食品股份有限公司,生產標準號:SC10161048100337);CCl4分析純(恒興試劑,批號:20120211);HE染色試劑盒(Solarbio,批號:G1120);Masson染色試劑盒(Solarbio,批號:G1343);RIPA裂解液(Solarbio,批號:20200730);BCA試劑盒(Solarbio,批號:20200817);羥脯氨酸(HYP)堿水解法檢測試劑盒(南京建成生物工程研究所,批號A030-2-1);AST、ALT、Alb和總蛋白使用全自動生化儀配套試劑檢測(ROCHE,批號:56902901,57938901,57927501,57378001);Wnt1兔抗單克隆抗體(GeneTex,批號:GTX105955);β-Catenin兔抗單克隆抗體(GeneTex,批號:GTX101435);Cyclin D1兔抗單克隆抗體(GeneTex,批號:GTX108624);GAPDH兔抗多克隆抗體(ImmunoWay,批號:YM3215);ECL化學發光超敏顯色試劑盒(YEASEN,批號:S2018081);RNA純化試劑盒(TaKaRa,批號:9767);熒光定量試劑盒(TaKaRa,批號:RR820A);反轉錄試劑盒(TaKaRa,批號:RR047A)。
1.1.4 主要儀器 全自動組織脫水切片機(Leica Biosystems,CM3050S);顯微鏡及圖像采集系統(OLYMPUS,BX53);全自動生化分析儀(ROCHE,COBAS C311);實時熒光定量PCR系統(Bio-Rad,CFX96);電泳儀(BIO-RAD,041BR 109973);全能型蛋白轉印系統(Bio-Rad,Trans-Blot Turbo);全能型成像系統(Bio-Rad ,Chemi Doc MP);酶標儀(Bio-Rad,Mark1509),精密電子天平(OHAUS,AR224CN)。
1.2 動物分組、造模及藥物干預 60只Wistar大鼠使用簡單隨機化分組法分為空白對照組、模型組、陽性對照組和舒肝和絡醒脾方高、中、低劑量組6組,每組10只。分組法如下操作:(1)將60只大鼠從1~60編號;(2)繪制隨機數字表,從數字表中任意數字開始,以同一方向順序得到每只大鼠的隨機數字;(3)隨機數除以組數求余數,整除則余數取組數;(4)按余數分組;(5)調整[5]。分組后,除正常對照組外,其余各組均腹腔注射1.0 mL/kg的40%CCl4玉米油溶液,每周2次,持續8周[6]。肝纖維大鼠模型成功的標志為:肝組織HE切片能觀察到明顯纖維間隔形成[7]。空白對照組和模型組給予10 mL/kg生理鹽水灌胃,陽性對照組用水飛薊賓葡甲胺溶液50 mg/kg灌胃,舒肝和絡醒脾方高、中、低劑量組分別按12.42 g/kg、6.21 g/kg和3.11 g/kg(生藥/體質量)灌胃,每日1次,持續8周。給藥量計算方法參照《實驗藥理方法學》[8],大鼠劑量=人臨床劑量/70 kg×6.3。末次給藥后次日,大鼠以45 mg/kg體質量腹腔注射3%戊巴比妥鈉溶液麻醉。腹主動脈穿刺取血后,離心取血清,-80 ℃保存備用。于肝右葉切取肝組織(1 cm×1 cm×1 cm)浸于4%多聚甲醛固定液中做預切片處理;取肝左葉組織(1 cm×1 cm×1 cm)用于提取總蛋白和總RNA。
1.3 研究方法
1.3.1 大鼠生理狀況的觀察 每日觀察大鼠生長、進食、飲水、毛色、糞便、尿量及顏色、活動、死亡情況。使用精密電子天平每周稱量并記錄各大鼠體質量。
1.3.2 血液學指標檢測 取大鼠腹主動脈血血清用堿水解比色法檢測大鼠血清中HYP含量,于全自動生化分析儀檢測大鼠AST、ALT、總蛋白、Alb指標水平。
1.3.3 肝組織病理學觀察 取甲醛固定的部分肝臟脫水、石蠟包埋、切片后做常規HE染色與Masson染色。常規HE染色評估采用鏡下觀察方法,每張切片選取3個不同視野,觀察纖維化程度,綜合參考臨床肝炎分級和肝纖維化分期標準對肝臟損傷程度進行評分,評分越高代表肝纖維化程度越嚴重(表1)[1]。

表1 慢性肝炎分級和肝纖維化分期標準
Masson染色切片評估采用膠原容積分數半定量分析法。每張切片選取3個不同視野,使用Image-pro Plus 6.0軟件選取相同的綠色作為判斷所有照片膠原纖維的統一標準,分析得出膠原纖維占整個組織面積的比率即膠原纖維的面積百分比(%)[9]。
1.3.4 RT-qPCR法檢測肝組織中Wnt1、β-Catenin和Cyclin D1 mRNA的表達 取肝組織100 mg,液氮速凍后研磨,使用RNA純化試劑盒提取總RNA,RT-q PCR檢測Wnt1,β-Catenin和Cyclin D1的mRNA水平。取2 μg RNA反轉錄合成cDNA,以cDNA為模板,按qPCR試劑盒說明書擴增。根據 qPCR所得的Ct值,以β-actin為內參計算2-ΔΔCt,計算結果以空白對照組表達水平進行歸一化處理。PCR引物由北京擎科生物科技有限公司設計合成(表2)。
1.3.5 Western blot法檢測肝組織中Wnt1、β-Catenin和Cyclin D1蛋白的表達 取肝組織100 mg,粗剪碎加入RIPA裂解液,經4 ℃低溫高速離心機12 000 r/min,30 min離心后取上清液進行BCA法蛋白濃度測定以計算上樣量后加入4×loading buffer 上樣緩沖液,使用振蕩恒溫金屬浴100 ℃煮沸10 min變性。根據Western blot標準操作步驟依次進行電泳、轉膜、封閉,分別孵育Wnt1(1∶2000)、β-Catenin(1∶2000)、Cyclin D1(1∶2000)和內參蛋白GAPDH(1∶2000),ECL發光顯影,凝膠成像,使用Image J與GraphPad Prism 9.0軟件進行Wnt1、β-Catenin、Cyclin D1及GAPDH 顯影條帶的相對灰度值分析。

表2 PCR引物列表
2 結果
2.1 舒肝和絡醒脾方對大鼠生理狀況的影響 造模過程中,空白組大鼠無死亡,余10只;模型組死亡4只,余6只;陽性對照組死亡1只,余9只;舒肝和絡醒脾方高劑量組死亡1只,余9只;舒肝和絡醒脾方中劑量組死亡2只,余8只;舒肝和絡醒脾方低劑量組死亡3只,余7只。經觀察,空白對照組大鼠,體質量正常,皮毛光澤,食量正常,活動靈敏,健康狀況良好。模型組大鼠明顯消瘦,體質量減輕,毛色暗淡,精神不佳,進食進水少,糞便溏稀,尿色發黃。陽性對照組與舒肝和絡醒脾方組大鼠精神狀態尚可,活動度有所增加,反應較快,進食、飲水、毛色、糞便、尿量及皮毛光澤度有所改善,其中舒肝和絡醒脾方高、中劑量組效果較為明顯。
2.2 舒肝和絡醒脾方對大鼠肝組織血液學指標的影響
與空白對照組比較,模型組大鼠血清中HYP、ALT、AST和Glo水平顯著升高(P值均<0.05),總蛋白、Alb和Alb/Glo(A/G)水平明顯降低(P值均<0.05),提示造模成功。與模型組比較,陽性對照組和舒肝和絡醒脾方干預后大鼠血清中HYP、ALT、AST和Glo水平顯著降低(P值均<0.05),總蛋白、Alb和A/G水平明顯升高(P值均<0.05);與陽性對照組比較,舒肝和絡醒脾方低劑量組的ALT、 AST水平顯著升高(P值均<0.05),總蛋白、Alb和A/G水平明顯降低(P值均<0.05)。上述結果提示,舒肝和絡醒脾方和水飛薊賓葡甲胺對CCl4誘導的肝纖維化模型大鼠的肝損傷具有保護作用,對大鼠的膠原蛋白分解代謝功能具有促進作用,且提示水飛薊賓葡甲胺效果比舒肝和絡醒脾方低劑量顯著,但舒肝和絡醒脾方高、中劑量效果與水飛薊賓葡甲胺基本等效(表3、4)。
2.3 舒肝和絡醒脾方對肝臟病理學結構變化的影響及肝損傷程度評分 HE染色顯示:空白對照組大鼠肝臟分為6葉,色暗紅,邊角銳利,質地柔軟;肝小葉結構清晰,肝索及肝竇圍繞中央靜脈呈放射狀排列;模型組大鼠肝臟顏色變淺,邊角變鈍,質地變韌,并出現大小不等的結節,可見門靜脈中度纖維化伴大量纖維間隔,肝小葉內纖維結締組織彌漫增生形成纖維間隔,小葉周圍及匯管區可見變性壞死的肝細胞,形成假小葉;與模型組比較,各用藥組大鼠肝臟纖維結締組織增生、分割明顯減輕,肝小葉輪廓相對清晰,肝細胞變性壞死程度減輕,肝臟形態、顏色和質地接近正常;陽性對照組可見門靜脈輕度纖維化伴少量纖維間隔,肝細胞輕微脂肪變;舒肝和絡醒脾方低劑量組可見明顯門靜脈纖維化伴少量纖維間隔;舒肝和絡醒脾方中劑量組可見少量門靜脈輕微纖維化;舒肝和絡醒脾方高劑量組未觀察到明顯異常(圖1,表5)。Masson染色顯示:空白對照組僅匯管區血管有少量膠原沉積;模型組肝組織門靜脈中度纖維化伴大量纖維間隔,匯管區可見明顯纖維間隔,肝小葉結構破壞,并形成假小葉,膠原沉積顯著增多(P<0.05);與模型組比較,舒肝和絡醒脾方低劑量組雖然能有效減少膠原沉積(P<0.05),但仍可觀察到明顯的門靜脈纖維化伴少量纖維間隔和假小葉,其余各藥物干預組纖維化程度均明顯減輕,膠原沉積顯著減少(P<0.05);與陽性對照組比較,舒肝和洛醒脾方高劑量組膠原沉積的治療效果方面優于水飛薊賓葡甲胺組舒肝和絡醒脾方中、低劑量組(P值均<0.05),與舒肝和絡醒脾方高劑量組基本等效(圖2,表6)。上述結果提示,舒肝和絡醒脾方能夠明顯改善肝纖維化大鼠肝組織病理改變及纖維化程度。舒肝和絡醒脾和低劑量具有輕微藥效作用,舒肝和絡醒脾方中劑量和水飛薊賓葡甲胺具有一定治療作用,舒肝和絡醒脾方高劑量具有明顯藥效作用。
2.4 舒肝和絡醒脾方對大鼠肝組織中Wnt1、β-Catenin和Cyclin D1 mRNA水平的影響 與空白對照組比較,模型組大鼠肝組織中Wnt1、β-Catenin和Cyclin D1mRNA表達水平顯著升高(P值均<0.05);與模型組比較,各藥物治療組大鼠肝組織中Wnt1、β-Catenin和Cyclin D1 mRNA的水平顯著降低(P值均<0.05)。上述結果提示,水飛薊賓葡甲胺和舒肝和絡醒脾方對于調控Wnt/β-Catenin信號通路的關鍵配體Wnt1、β-Catenin和Cyclin D1的mRNA表達水平有顯著作用,且各藥物治療組效果無明顯差異(表7)。

表3 各組HYP、ALT、AST表達水平比較

表4 各組TP、Alb、Glo和A/G表達水平比較
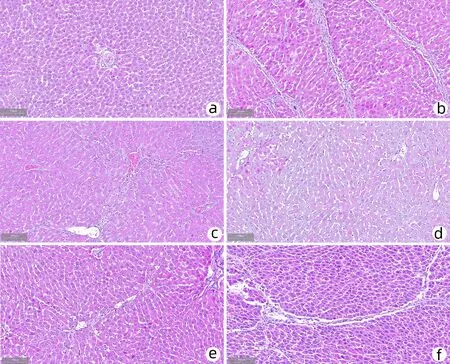
注:a,正常對照組;b,模型組;c,陽性對照組;d,舒肝和絡醒脾方高劑量組;e,舒肝和絡醒脾方中劑量組;f,舒肝和絡醒脾方低劑量組。

注:a,正常對照組;b,模型組;c,陽性對照組;d,舒肝和絡醒脾方高劑量組;e,舒肝和絡醒脾方中劑量組;f,舒肝和絡醒脾方低劑量組。
2.5 舒肝和絡醒脾方對大鼠肝組織中Wnt1、β-Catenin、Cyclin D1蛋白表達的影響 Western blot 結果顯示,與空白對照組比較,模型組大鼠肝組織中Wnt1、β-Catenin和Cyclin D1蛋白的表達水平均顯著升高(P值均<0.05);與模型組比較,除舒肝和絡醒脾方低劑量組外,其余各治療組肝組織中Wnt1、β-Catenin和Cyclin D1的蛋白表達水平顯著降低(P值均<0.05);與陽性對照組比較,舒肝和絡醒脾方中、低劑量組在β-Catenin蛋白水平表達上顯著升高(P值均<0.05)。上述結果提示,水飛薊賓葡甲胺和舒肝和絡醒脾方高、中劑量能夠抑制CCl4誘導的肝纖維化模型大鼠Wnt/β-Catenin信號通路相關蛋白Wnt1、β-Catenin和Cyclin D1的蛋白表達水平,且提示水飛薊賓葡甲胺與舒肝和絡醒脾方高劑量對于該通路關鍵蛋白 β-Catenin調控作用優于舒肝和絡醒脾方中劑量(圖3,表8)。

表5 各組HE染色切片分級及評分
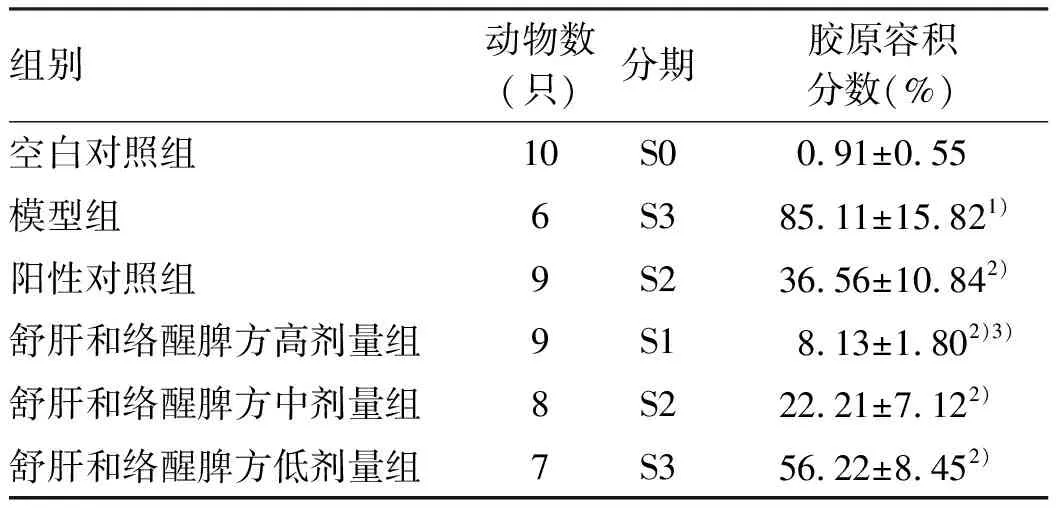
表6 各組Masson染色切片肝纖維化分級及膠原容積分數半定量分析結果

表7 各組大鼠肝組織中Wnt1、β-Catenin和 CyclinD1 mRNA 的表達

表8 各組大鼠組織Wnt1、β-Catenin和 CyclinD1 蛋白表達水平比較

注:空白,空白對照組;模型,模型組;陽性,陽性對照組;高,舒肝和絡醒脾方高劑量組;中,舒肝和絡醒脾方中劑量組;低,舒肝和絡醒脾方低劑量組。
3 討論
肝纖維化是所有慢性肝病共同的病理基礎。臨床上,肝硬化導致的腹水、上消化道出血、肝衰竭、肝細胞癌等均為肝纖維化的顯性表達。雖然肝纖維化的發病機制尚未完全闡明,但主要是由于“慢性肝損傷-促靜息肝星狀細胞轉化肌成纖維細胞和細胞外過度沉積的發生-導致肝纖維化病理變化”。肝纖維化于中醫屬“脅痛”“積聚”“肝著”等病癥范疇。甘肅省國醫大師周信有教授基于“肝藏血”“脾統血”“久病入絡”和“肝體陰用陽”理論,將現代醫學的“慢性肝損傷-肝纖維化-肝硬化形成”疾病進展提煉為中醫學“絡脈瘀滯-微小癥積-癥積形成”的理論,提出“益氣養血、祛瘀活絡、舒肝醒脾”的治療大法,即“舒肝和絡醒脾法”學說,且結合臨床驗效擬專方舒肝和絡醒脾方。該方由醋柴胡,岷當歸,炙黃芪,莪術,鱉甲,枳椇子六味藥構成,以醋柴胡舒肝行氣,岷當歸養血和絡,炙黃芪益氣扶正,鱉甲去痞除癥,莪術破血通絡,枳椇子醒脾解毒,共奏舒肝醒脾、祛瘀活絡、益氣養血之功效。針對肝纖維化絡脈瘀滯、肝郁脾困,氣血失和,進而形成微小癥積的病機和證候要素,辨證施治,臨床確有良效[10]。臨床研究[11-13]表明,該方能夠有效改善肝纖維化患者臨床癥狀,并促進肝功能恢復。已完成的基礎研究[4]證實,舒肝和絡醒脾方能夠顯著降低CCl4誘導肝纖維化大鼠的透明質酸、Ⅳ型膠原和肝瞬時彈性成像指數水平,以發揮抗纖維化治療作用。
由于無論是肝纖維化發病的分子機制,還是Wnt/β-Catenin信號通路的轉導機制均暗合“舒肝和絡醒脾法”學說的學術思想,為了進一步揭示舒肝和絡醒脾方的抗肝纖維化機制,印證“舒肝和絡醒脾法”學說的科學性,本課題組檢測了與肝纖維化進展密切相關的經典信號通路Wnt/β-Catenin的主要相關蛋白。Wnt信號通路在HSC的激活和肝纖維化發生發展中起到重要作用。Wnt1是肝損傷后激活的細胞因子,可導致β-Catenin大量聚集,促進HSC的活化[14]。β-Catenin的活性可以促進肝臟修復反應和疾病的發展,β-Catenin的表達水平越高,肝纖維化程度越高,沉默β-Catenin可以抑制膠原的分泌和HSC的增殖,介導細胞凋亡[15]。大量游離的β-Catenin到細胞核后能促進Wnt靶基因的轉錄,并激活細胞周期蛋白Cyclin D1。Cyclin D1對細胞周期的正調控會加速活化HSC的增殖,當Cyclin D1表達被抑制時HSC的增殖也受到抑制,發生凋亡[16]。臨床常通過血液學指標聯合病理學診斷(HE染色、Masson染色)確定肝纖維化。血液學指標分為直接型指標和間接型指標,直接指標HYP作為膠原組織的主要成分可以衡量體內膠原含量,反映纖維化程度。間接指標如ALT、AST可反映肝實質損害指標水平,與肝臟合成功能指標總蛋白、Alb和Glo協同參照,可作為評價肝功能和纖維化水平的間接評價指標[1]。
本研究采用水飛薊賓葡甲胺和不同劑量的舒肝和絡醒脾方對CCl4誘導的肝纖維化模型大鼠進行干預,結果顯示,舒肝和絡醒脾方和水飛薊賓葡甲胺能夠發揮顯著的抗肝纖維化治療作用。其中,舒肝和絡醒脾方高劑量能夠明顯改善大鼠的生理狀況、肝功能、肝臟的膠原蛋白分解代謝水平和肝組織病理改變及纖維化程度,且與水飛薊賓葡甲胺基本等效,治療效果優于舒肝和絡醒脾方中、低劑量。在調控信號通路Wnt/β-Catenin主要蛋白Wnt1、β-Catenin和Cyclin D1的mRNA水平和蛋白表達方面,舒肝和絡醒脾方高劑量對于關鍵蛋白 β-Catenin調控作用明顯優于舒肝和絡醒脾方中、低劑量,且與水飛薊賓葡甲胺基本等效。上述結果提示,舒肝和絡醒脾方的抗肝纖維化作用可能與抑制Wnt/β-Catenin信號通路相關蛋白活化有關,且以舒肝和絡醒脾方高劑量效果最為明顯,與戴琦等[17]益氣活血利水湯抑制慢性肝纖維化的研究結果較為一致。上述結果也提示,肝纖維化發病的分子機制和Wnt/β-Catenin信號通路的轉導機制均符合“舒肝和絡醒脾法”學說的學術思想,驗證了學說的科學性和有效性。
本研究的創新之處在基于“舒肝和絡醒脾法”學說,把握肝纖維化絡脈瘀滯、肝郁脾困,氣血失和,進而形成微小癥積的病機和證候要素,遵循扶正祛邪的總則,以舒肝醒脾、祛瘀活絡、益氣養血立法,創立舒肝和絡醒脾方,在基礎及臨床研究中均證實本方能有效發揮抗肝纖維化治療作用,印證了“舒肝和絡醒脾法”學說的科學性和有效性。應用中醫藥復方干預肝絡微小癥積的發展,亦體現了中醫學“治未病”的思想。本實驗雖然從生理學、病理學和血液學方面驗證了舒肝和絡醒脾方的抗肝纖維化治療作用,并初步了解其抗纖維化機制可能是通過調控Wnt/β-Catenin信號通路發揮作用,但由于復方中藥成分的復雜性,是否有其他信號通路參與仍需進一步驗證,且舒肝和絡醒脾方對于脾臟血液動力學及免疫功能是否具有調控作用仍需進一步探索。
倫理學聲明:本研究方案于2019年3月8日經由甘肅中醫藥大學實驗動物倫理委員會審批,批號:2019-140,符合實驗室動物管理與使用準則。
利益沖突聲明:本研究不存在研究者、倫理委員會成員以及與公開研究成果有關的利益沖突。
作者貢獻聲明:王奎淞負責課題設計,資料分析,撰寫論文;魏書瑤、殷世鵬、李婕妠、陳世玉、郭嘉琪參與收集數據,修改論文;趙鯤鵬、張秋菊負責擬定寫作思路,指導撰寫文章并最后定稿。

