自動化DNA 組裝儀器研制
陳 紅,榮 振,王升啟
(軍事科學院軍事醫學研究院微生物流行病研究所,北京 100850)
DNA 組裝方法是整個合成生物學的基礎,合成生物學依賴于將組裝的特定DNA 片段導入細胞內發揮功能來實現目的,DNA 組裝技術是實現合成生物學各種目的的關鍵技術,但設計并合成基因組的能力還遠遠落后于已掌握的合理設計生物元件的能力。隨著合成生物學的發展,研究者開發了依賴于DNA 聚合酶或DNA 連接酶的不同DNA 組裝技術;為了降低組裝成本和便于實現DNA 組裝的自動化,也發展了一些非酶依賴的DNA 組裝技術;而幾百KB 到MB 的大片段DNA 的組裝則多數依賴于微生物體內重組[1]。
2002 年,合成的脊髓灰質炎病毒cDNA 被RNA聚合酶轉錄成病毒RNA,在無細胞提取物中翻譯和復制,從而產生傳染性脊髓灰質炎病毒的從頭合成[2],表明僅通過序列,就可以通過體外化學合成感染因子。2008 年Venter 研究組利用TAR(Transformation Associated Recombination)方法在釀酒酵母體內完成了生殖道支原體基因組的最后一步組裝[3]。2009 年,Gibson 開發了DNA 多片段體外一步拼接的方法,將核酸外切酶、聚合酶和連接酶加入反應體系,50 ℃孵育60 min即可完成組裝[4]。2010 年,Venter 團隊和Smith 團隊合成了長達1.08 MB 的蕈狀支原體基因組,成功轉入到山羊支原體宿主細胞內,是人工合成基因創造新細胞的歷史性一步[5]。2017 年,紐約大學Boeke 教授團隊在“人工合成酵母基因組計劃(Sc2.0)”中,用同源重組的方法,成功組裝了大片段的DNA 且同時置換了野生型染色體[6]。同年,我國天津大學[7-8]、清華大學[9]、深圳華大基因研究院[10]完成了4 條釀酒酵母染色體的全合成,且合成的染色體經過人工設計,刪除了無用序列,比天然染色體的基因序列更短。
國內也發展了多種DNA 組裝新技術。趙國屏院士團隊開發出位點特異性重組串聯SSRTA、核酸內切酶連接、MASTER 連接及iBrick 等組裝方法[11-12];覃重軍研究員團隊發展出CasHRA 技術[13],實現胞內多個100 KB 以上DNA 片段組裝;戴俊彪研究員團隊建立了可用于代謝工程優化和蛋白表達的YeastFab 和EcoExpress DNA 組裝技術[14-15];趙惠民教授團隊提出一種高效準確的多片段DNA 組裝方法雙引物組裝(Twinprimer non-enzymatic DNA assembly,TPA)[16],這是一種在不使用酶的情況下將PCR 反應擴增的片段組裝成質粒的方法。TPA 克隆無疤痕且與序列無關,即使不使用酶,TPA 的性能也與目前可用的一些最好的體外組裝方法相當。
雖然DNA 組裝的方法技術已經很成熟,但完成DNA 組裝相關的實驗成本太高、耗費的時間太長、占用的人力太多。本文研制了一種DNA 組裝儀器,可以自動化、快速地滿足DNA 組裝實驗中的移液要求及溫度控制條件。
1 DNA 組裝儀設計
針對現有的DNA 組裝中常見的通量低、速度慢及自動化程度低等問題,本文從工程學角度出發,合理設計DNA 組裝儀的結構,搭建原理樣機并完成相應控制系統的開發。
自動化DNA 組裝儀是一個綜合自動移液、運動控制與循環控制溫度于一體的多模塊、集成化儀器,對運動的準確定位、精確移液及溫度控制要求較高。如圖1所示,自動化DNA 組裝儀主要由大底板、移液運動模塊及溫度控制模塊3 大結構部分組成。大底板是整個DNA 組裝儀的基礎,分為底板結構設計和反應試劑裝載區設計,大底板是整個儀器的支撐,移液運動、溫度控制等工作均在底板上進行,底板上放置有槍頭盒、試劑盒、廢液池和溫度控制模塊。移液運動模塊包含二維運動平臺和移液器組件2 部分。溫控模塊由溫度循環模塊及熱蓋結構組成。
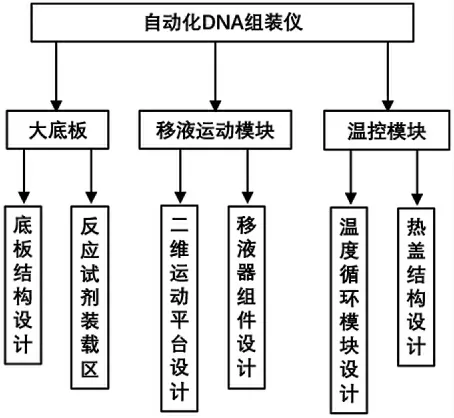
圖1 整機設計架構圖
2 結果與分析
2.1 機械結構
DNA 組裝儀的機械結構組成如圖2 所示。其中,龍門架、大底板、試劑裝載區構成儀器的主題框架;移液器組件、步進電機和直線導軌組成儀器的主要移液運動模塊;熱蓋、溫度循環模塊構成儀器的核心反應溫控模塊。
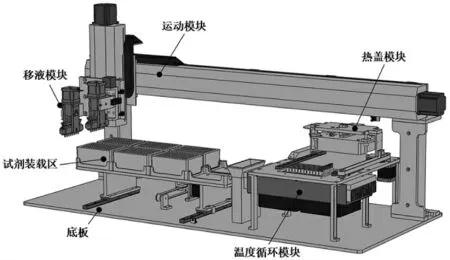
圖2 DNA 組裝儀硬件系統設計圖
儀器整體的運動主要體現在移液器模塊帶動反應體系在水平和垂直方向上頻繁往復移動,所以分別選用X、Z 方向上的步進電機,并根據受力和行程合理設計導軌的載荷和長度,X 軸的行程是107 cm,速度是72.5 mm/s,Z 軸的行程是27 cm,速度是72.5 mm/s。為了提高儀器移液的精度及移液的效率,本文設計了一種八連排移液器組件,通過安裝塊搭載在Z 軸機械臂上,在Z 軸和X 軸的步進電機帶動下,準確到達指定的位置。如圖3 所示,移液器組件主要由微量泵、42 直線電機、機械臂安裝板、導向裝置、8 個單獨的移液器通道及限位開關組成。為了保證吸排液體時的密封性,將移液器與槍頭適配處設計成楔形的結構,與槍頭可以緊密貼合在一起。

圖3 八連排移液器組件結構圖
溫控模塊的設計尺寸為足夠放入一塊96 孔的反應小管,并設計熱蓋進行自動化的開閉。熱蓋結構如圖4 所示,熱蓋內單獨設計加熱片,防止反應體系蒸發后在管壁或頂部凝結,且需要與溫度循環模塊保持緊密接觸。熱蓋設計有可防蒸發的高溫模塊和可以自動進行熱蓋開關的機械運動模塊。
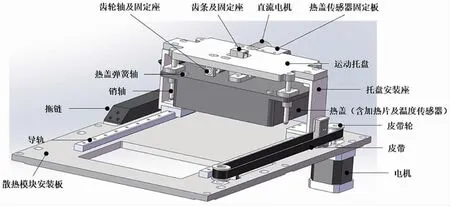
圖4 熱蓋結構設計圖
溫度循環模塊為PCR 擴增提供準確的溫度,結構如圖5 所示,由半導體加熱制冷片、溫度傳感器、試管槽、散熱片、散熱擋片及風扇等組成。電壓是15 V,功率為900 W。
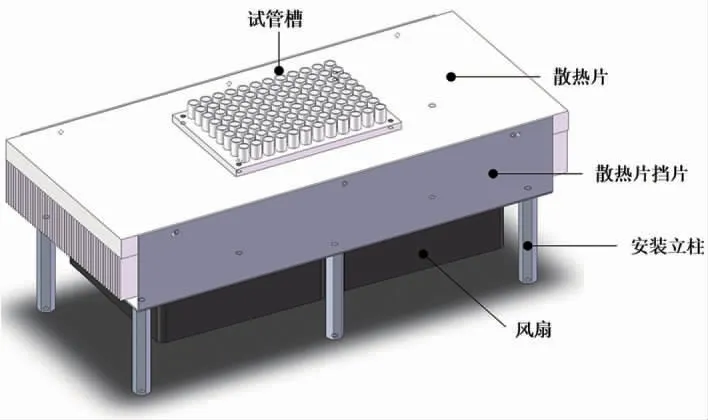
圖5 溫度循環模塊結構設計圖
2.2 控制系統
DNA 組裝儀控制系統由運動控制系統和溫度控制系統構成,其系統框圖如圖6 所示。控制電路主要由主控芯片STM32F103 和溫控芯片STC15W4KS4 構成雙中央處理結構,其中主控芯片主要負責電機脈沖信號輸出、AD 信號轉換、觸摸屏交互、上位機通訊、RCC時鐘控制等,溫控芯片主要作用是接收主控信號、控制加熱片、接收溫度采集信號等。電源轉換芯片則將直流電壓進行轉換,分別輸出3.3 V 和24 V 到控制芯片和步進電機驅動器。
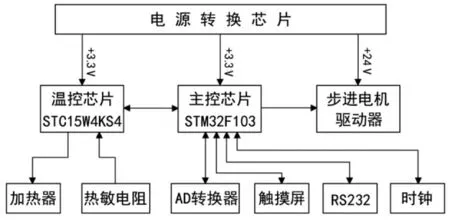
圖6 控制系統框圖
在對2 個電機的控制過程中,需要保持反應體系穩定性的情況下,盡可能提升電機位移速度,減少計時器的中間等待時長,快速將反應體系加入反應孔中。溫度控制除了要在溫度循環器和熱蓋上設置多個熱敏電阻檢測溫度,還需要優化閉環控溫方案、采用PID 算法對控溫參數進行整定,實現對反應孔和熱蓋溫度的快速、精準、穩定控制。
2.3 性能驗證
對自動化DNA 組裝儀進行一次完整的PCR 擴增驗證儀器的溫控性能。PCR 擴增的實驗流程如下:95 ℃3 min,95 ℃10 s,65 ℃5 s,72 ℃1.5 min,變性、退火及延伸這3 個溫度循環25 次,最后72 ℃延伸5 min,總計用時65 min,商業化的PCR 儀器(伯樂的T100 Thermal Cycler)做相同的實驗循環用時85 min,明顯優于商業化的熱循環儀。溫度結果如圖7 所示,溫控性能好,能快速達到PCR 擴增需要的溫度。
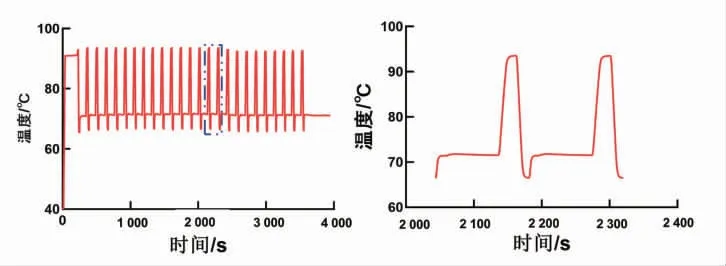
圖7 DNA 組裝儀溫度測量圖
對DNA 組裝儀的八連排移液器組件進行測試,每次吸取相同體積的去離子水,獨立重復3 次,記錄每次移取液體的體積,結果見表1,8 個移液通道對應的變異系數范圍是1.23%~7.55%,移液性能好。
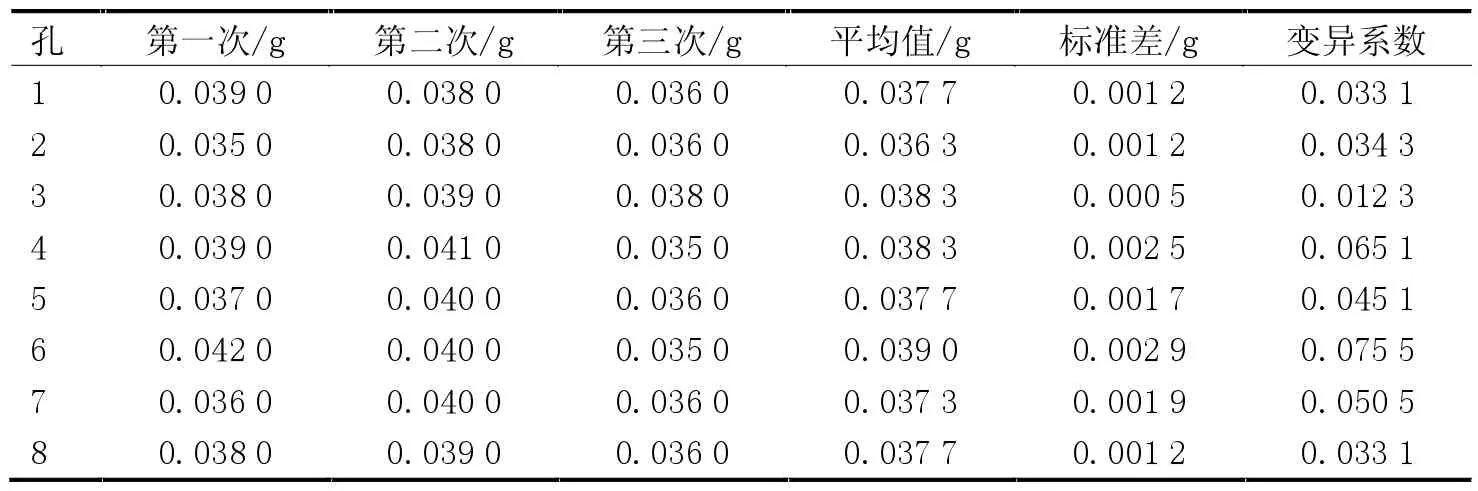
表1 移液性能測試
3 討論
本文對自動化DNA 組裝儀器的設計進行了研究,從儀器的機械結構、各個模塊的布局、硬件電路的設計到溫度的控制算法及上位機控制程序的編寫都進行了詳細介紹。機械部件的選型上,選用57HB115L4 兩相步進電機作為X 軸和Z 軸機械臂的驅動單元,采用MF65 薄膜型熱敏電阻作為溫度傳感器,溫度循環模塊采用半導體加熱制冷片,導熱材料采用鋁合金6063,風扇和散熱片作為散熱模塊。在電路模塊上,選用TMCM-6110 6 軸步進電機驅動器對運動模塊的電機進行控制,設計了主控制器、溫度的采集和控制電路、通訊模塊電路。溫度控制采用簡單易實現的PID 算法,用C 語言編寫了單片機程序,用Python 語言編寫了上位機控制程序。進行了組裝實驗中一次完整的PCR 擴增,記錄了PCR 擴增的溫度變化并繪制成溫度曲線,驗證了溫控系統的性能。對移液器組件的移液性能進行了驗證,變異系數均小于10%,表明移液器組件的移液性能良好。以上結果表明,本文所建立的自動化DNA組裝儀器可以滿足DNA 組裝實驗需要的移液條件及溫度循環條件的要求,但是溫度的檢測量和實際值之間存在小誤差,后續需要進一步優化硬件電路設計。

