CLU基因多態性與缺血性腦卒中后癲癇風險的關系分析
羅佳文,潘家興,李建紅
(1.萬寧市人民醫院 神經內科,海南 萬寧 571500;2.海南醫學院第二附屬醫院 神經內科,海南 海口 570216)
癲癇是由于大腦中(特別是丘腦- 皮質系統和上中腦)高度同步的神經元異常放電引起的一種神經系統疾病,是缺血性腦卒中的常見并發癥之一[1],可增加腦卒中患者的死亡風險[2]。因此,研究卒中后癲癇的發病原因及易感因素具有重要意義。炎癥和細胞凋亡是缺血性腦卒中和癲癇發展的共病基礎[2-4]。聚集素蛋白(CLU)也被稱為載脂蛋白J,是一種多功能伴侶蛋白,參與多種組織的發育、細胞死亡和脂質運輸(CSF)等[5]。動物研究表明,CLU表達降低與癲癇神經元細胞凋亡和炎癥機制有關[6]。從遺傳學機制分析,單核苷酸多態性(SNPs)可能通過改變相關基因的表達來影響疾病的易感性[7]。CLU基因位于染色體8p21- p12上,包含9個外顯子。據報道,CLUSNPs與神經系統疾病相關,如阿爾茨海默病(AD)、帕金森病、多發性硬化和假性剝脫[7-10]。目前7個SNPs(rs9331908、rs11136000、rs867231、rs867230、rs9331888、rs9314349和rs484377)已被識別,它們參與了≥90%CLU基因突變[11],然而CLUSNPs與腦卒中后癲癇之間的關系仍未確定。通過對國際人口數據庫和中國人口數據庫的檢索發現,rs11136000、rs9314349和rs9331949位點的突變頻率相對較高。因此,本研究旨在探討CLUSNPs(rs11136000、rs9314349和rs9331949)與缺血性腦卒中后癲癇易感性的關系。
1 對象與方法
1.1 研究對象
本研究方案經萬寧市人民醫院倫理委員會批準(2017021),所有參與者都提交了書面知情同意書。這項研究是根據《赫爾辛基宣言》進行的。2017年1月至2021年8月,從萬寧市人民醫院神經內科的病房和門診招募缺血性腦卒中患者,通過持續超過24 h的局部神經體征或血管源性癥狀來定義缺血性腦卒中,并通過基線腦部計算機斷層掃描(CT)和(或)磁共振成像(MRI)以及48~72 h后使用對比劑的腦CT來確診[12]。根據臨床癥狀(肢體抽搐、頸部僵硬等癲癇發作癥狀)和陽性腦電圖(EEG)檢查診斷卒中后癲癇[13],最終共收集249例卒中后癲癇患者作為癲癇組,其中男137例,女112例,平均年齡(56.51±15.25)歲。另外選取250例沒有繼發癲癇的腦卒中患者作為對照組,其中男157例,女93例,平均年齡(57.32±11.24)歲。在腦卒中事件發生之前,所有病例都沒經歷過癲癇發作。納入標準:(1) 入院時年齡在18歲以上;(2) 漢族;(3) 急性首發缺血性腦卒中;(4) 完整的醫療和護理資料。排除標準:(1) 短暫性腦缺血發作或原發性出血性腦卒中;(2) 既往有癲癇病史;(3) 抗癲癇藥物治療以預防癲癇發作或其他疾病(如精神病和偏頭痛);(4) 潛在致癇性共病,包括顱內腫瘤、腦手術史或重癥創傷性腦損傷、腦靜脈血栓、大型腦動脈瘤、腦動脈畸形、腦積水和腦血管炎。
1.2 DNA提取和基因分型
使用血液基因組DNA提取試劑盒(北京天根生物科技)從外周血樣本中分離基因組DNA,并在基因分型前儲存于-80 ℃。使用SNaPshot基因分型技術(美國ABI公司)對CLU基因的3個SNPs(rs11136000、rs9314349 和 rs9331949)進行基因分型,確定最小等位基因頻率(MAFs)分別為0.146、0.171和0.232。這些SNPs在多重聚合酶鏈反應(PCR)和SNaPshot分析中使用的引物序列見表1。另外,隨機抽取5%的樣品進行質量控制。
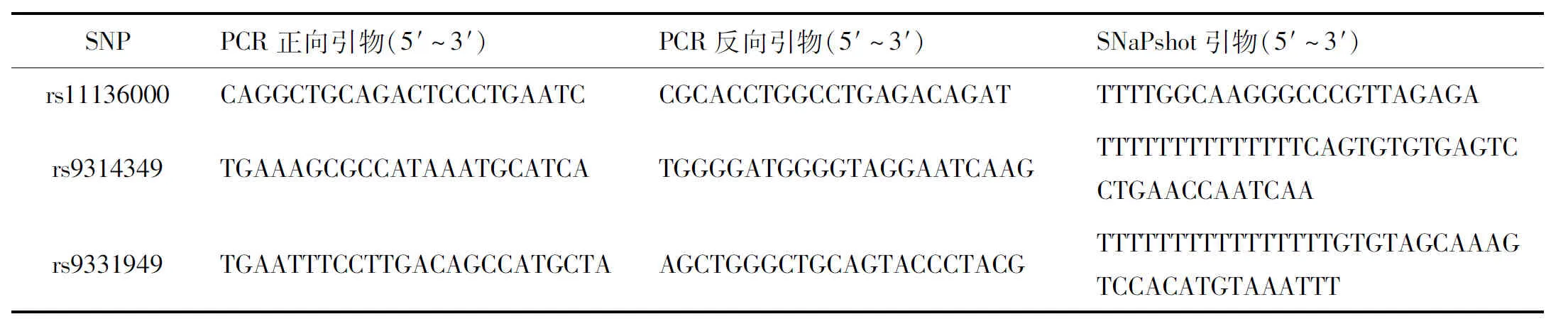
表1 用于SNPs的多重PCR和SNaPshot引物序列
1.3 血清CLU水平檢測
使用腦卒中診斷時(癥狀發作24 h內)的血清樣本。采集靜脈血樣后在室溫下凝結30 min,然后在實驗室離心(1 000 r·min-1,4 ℃,15 min)。采用人凝集素定量酶聯免疫吸附試劑盒測定血清CLU濃度。每個樣本重復測試3次,取平均值。
1.4 統計學處理

2 結 果
2.1 2組患者CLU SNP基因型和等位基因分布
癲癇組與對照組rs11136000位點基因型和等位基因分布頻率差異有統計學意義(P<0.05),但是rs9314349位點和rs9331949位點基因型分布及等位基因頻率差異均無統計學意義(P>0.05),見表2。與TT基因型相比,CC基因型和TC基因型與腦卒中后癲癇風險降低相關,而且這種影響在CC純合子中更為明顯(P<0.05)。這些結果與等位基因C的加性保護效應相一致。

表2 癲癇組和對照組患者CLU基因型和等位基因頻率的分布 例
2.2 性別分層分析
根據性別分層,女性和男性CLUrs11136000位點TC/CC基因型頻率降低與腦卒中后癲癇的關系顯著(P<0.01,表3)。在男性患者中未觀察到C等位基因與腦卒中后癲癇的關系(P>0.05,表4)。
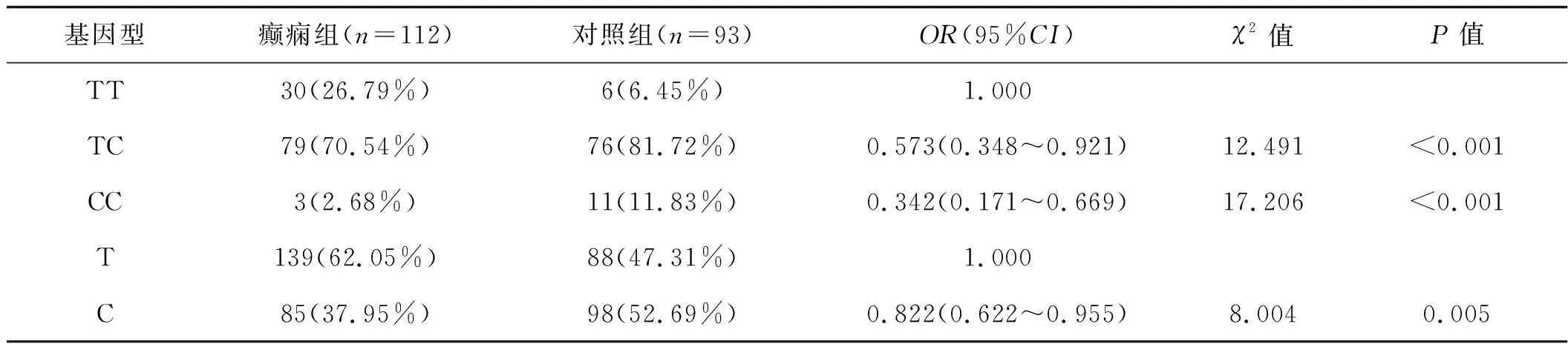
表3 rs11136000位點SNPs與女性腦卒中后癲癇的關系 例
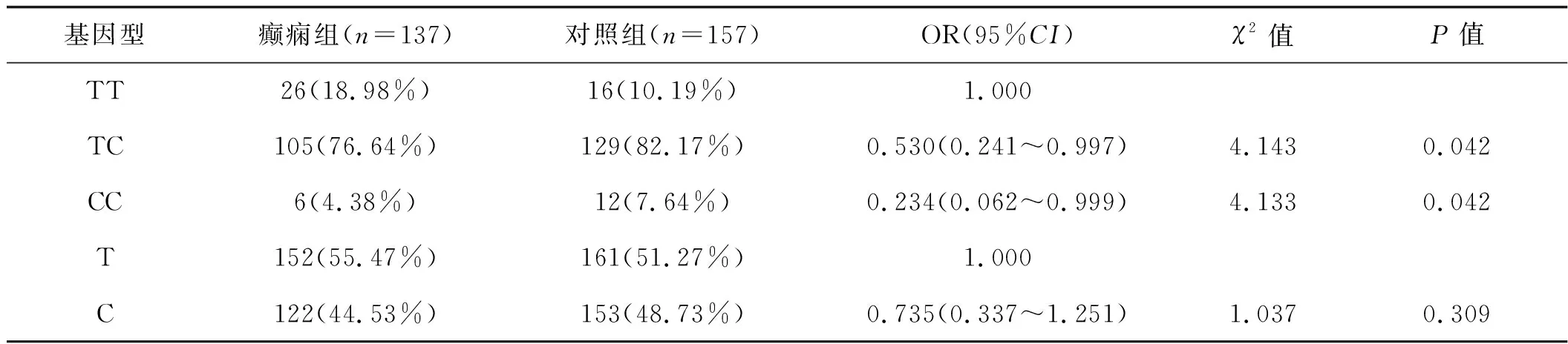
表4 rs11136000位點SNPs與男性腦卒中后癲癇的關系 例
2.3 2組患者臨床特征和血清CLU水平比較
單因素分析顯示,癲癇組與對照組在Charlson’s共病指數>2、卒中偏側性、大動脈粥樣硬化性腦卒中及溶栓治療方面差異有統計學意義(P<0.05),其余變量差異無統計學意義(P>0.05)。見表5。
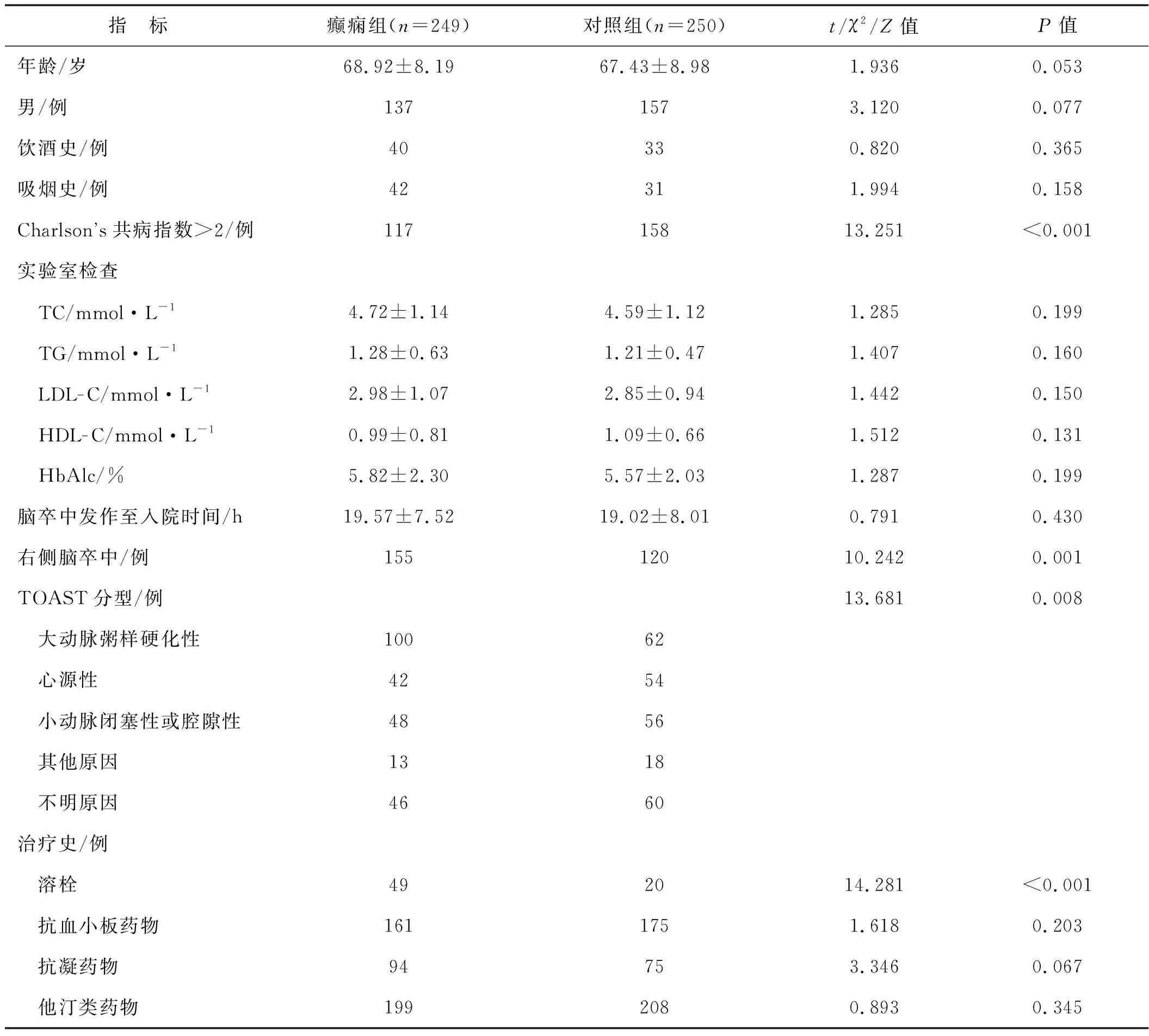
表5 癲癇組與對照組患者基線臨床資料的比較
2.4 多因素Logistic回歸分析
選擇Charlson’s共病指數>2、血清CLU水平、卒中偏側性、大動脈粥樣硬化性腦卒中、性別、年齡、溶栓治療作為自變量,納入多因素Logistic回歸模型,結果顯示,右側腦卒中、大動脈粥樣硬化性、溶栓治療是腦卒中后癲癇易感性的獨立危險因素(P<0.05),而CLU基因rs11136000位點TC基因型和CC基因型都是腦卒中后癲癇發病風險的獨立保護因素(P<0.05)。見表6。
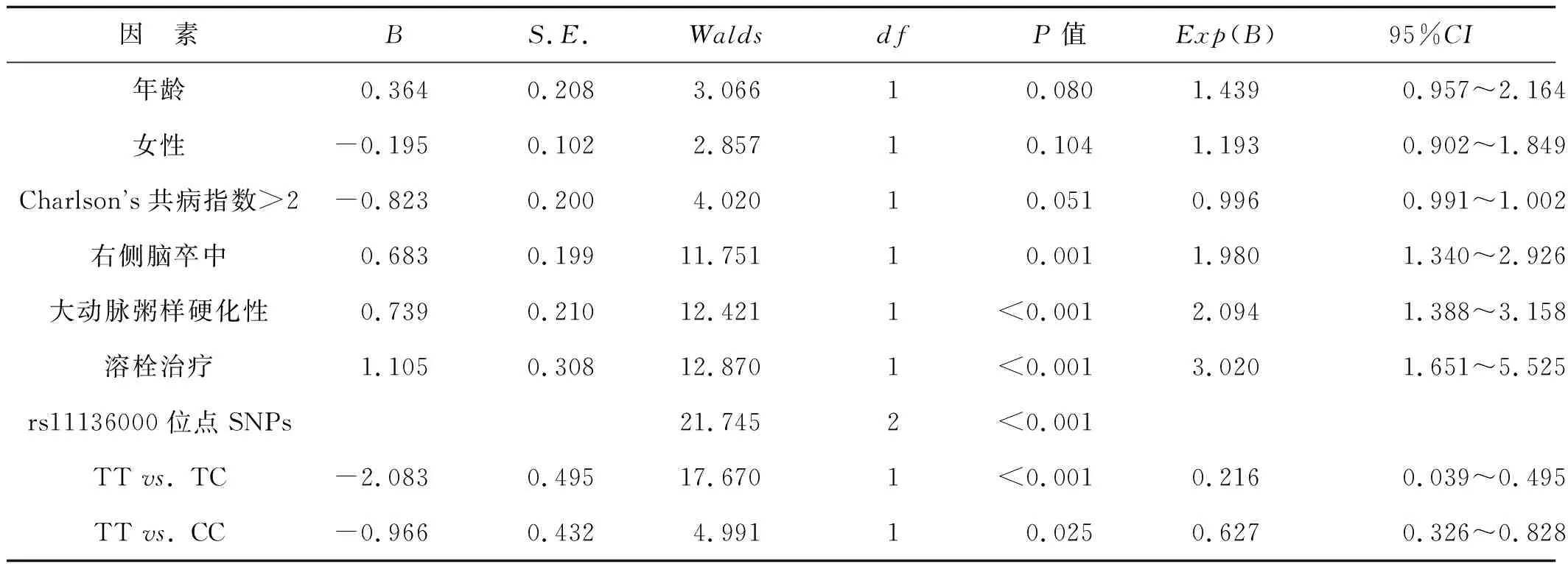
表6 多因素Logistic回歸分析與腦卒中后癲癇發病風險有關的危險因素
2.5 腦卒中后癲癇患者rs11136000位點基因型與血清CLU水平的關系
癲癇組患者血清CLU水平顯著低于對照組[66.86(54.60,82.60)μg· ml-1vs.73.10(57.70,100.50)μg· ml-1,Z=-3.619,P<0.001]。在癲癇組中CLU基因rs11136000位點TC/CC基因型患者(C等位基因攜帶者)血清CLU水平顯著高于TT基因型患者(Z=-3.765,P<0.05)。見圖1。
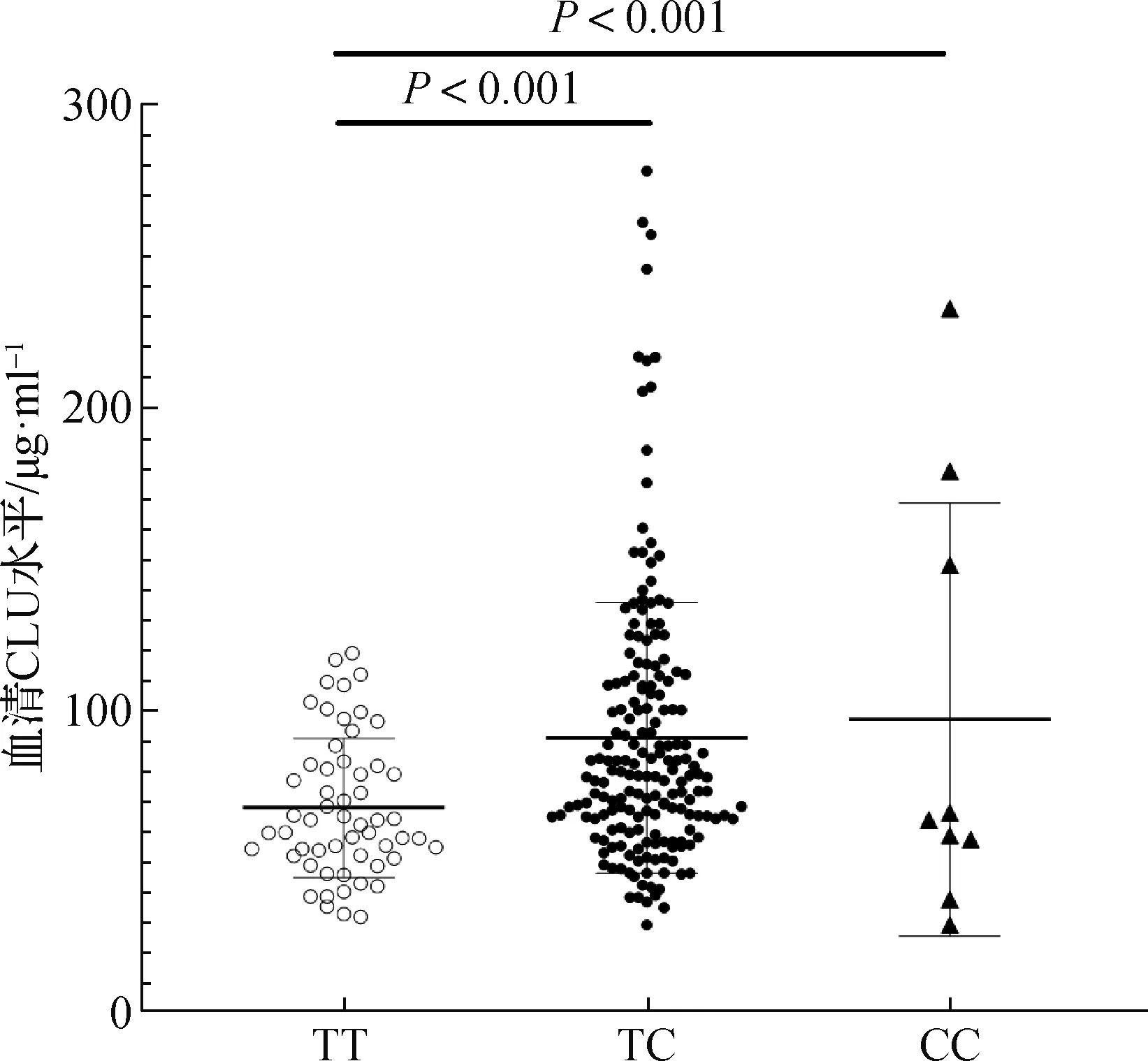
圖1 腦卒中后癲癇患者CLU基因rs11136000位點基因型與血清CLU水平的關系
3 討 論
研究表明,大鼠癲癇持續狀態后垂死的海馬神經元中的CLU mRNA和蛋白水平顯著降低[14]。此外,海馬神經元中核CLU表達降低已被證明伴隨海馬酸誘導的癲癇發作后廣泛的海馬細胞死亡和細胞凋亡[15]。此外,耐藥癲癇患者腦脊液中CLU水平也低于藥物反應性癲癇患者[16]。因此,CLU可能與癲癇的發病機制有關。在本研究中,我們評估了CLU基因rs11136000、rs9314349和rs9331949位點SNPs對腦卒中后癲癇易感性的影響,并發現了rs11136000位點CC/TC基因型和C等位基因頻率增加與缺血性腦卒中后癲癇發病風險呈正向關聯。
CLU基因位于染色體8p21- p12上,包含9個外顯子。SNPs可能通過改變相關基因的表達來影響疾病的易感性。據報道,CLUSNPs與神經系統疾病相關[8- 10]。CCG單倍型(rs2279590- rs11136000- rs9331888)已被成功鑒定為AD的遺傳易感性因子[17]。rs9331949 C等位基因已被證明與漢族遲發性AD風險增加顯著相關[18]。然而,CLUSNPs與腦卒中后癲癇之間的關系仍未確定。我們的研究是首次在小樣本中國漢族人群中調查CLUSNPs與腦卒中后癲癇之間的遺傳學關系,結果顯示攜帶 rs11136000位點C等位基因(保護性等位基因)的腦卒中患者繼發癲癇的風險較低。與上述發現一致的是,一項針對澳大利亞人群的研究中,rs11136000位點C等位基因的攜帶者在穹窿、腰帶、胼胝體和縱向神經束中顯示出明顯的低白質完整性特征,而這些區域是已知的癲癇樣放電的易感區域[19]。癲癇被認為是一種由神經元和(或)神經元群之間結構和功能連接紊亂引起的神經系統疾病。最近基于中國人群的神經成像研究則發現CLU基因rs11136000位點SNPs對旁海馬回灰質萎縮以及海馬的功能連接都有顯著影響[20]。上述遺傳學數據均說明CLU基因rs11136000位點C等位基因頻率降低與缺血性腦卒中后癲癇易感性增加有關。
此外rs11136000位點SNPs也與患者血清CLU水平有關。有報道稱rs11136000可能通過影響可變剪接、mRNA結構穩定性以及隨后的蛋白質生成而增加腦卒中后癲癇風險[21]。在本研究中rs11136000位點CC/TC基因型(C等位基因攜帶者)患者血清CLU水平高于TT基因型患者。CLU是人體內一類重要的蛋白聚糖,可參與多種生物學過程,包括精子成熟、組織分化、組織重塑、膜循環、脂質運輸、細胞增殖和死亡、腫瘤進展和神經退行性疾病等[16]。CLU通過穩定應激蛋白和抑制細胞凋亡從而對腦損傷有一定的保護作用。在AD小鼠模型(PDAPP小鼠)中,上調CLU表達可抑制淀粉樣蛋白沉積并增加神經炎毒性,相關神經炎性營養不良也減少[22]。與野生型小鼠相比,CLU敲除小鼠在永久性大腦中動脈閉塞后愈合過程中組織重塑較慢[23]。這意味著CLU基因與細胞凋亡和炎癥機制有關。此外,CLU也參與癲癇持續狀態后神經細胞死亡過程。人CLU基因主要編碼分泌型異二聚糖蛋白。最近的研究表明,CLU可以分泌到腦脊液和循環血中[24]。Xiao等[25]通過蛋白質組學分析發現,癲癇患者的腦脊液中CLU水平明顯降低。這與本研究結果基本一致。我們亦發現癲癇組患者血清CLU水平顯著低于對照組,因此我們推測,CLU水平降低可能會減弱抗凋亡效應,從而導致缺血性腦卒中后腦神經元死亡,進而增加繼發性癲癇的發作風險。與基礎研究證據一致,當前研究中發現的CLU基因rs11136000位點TC/CC基因型與較高的血清CLU水平之間的正向關系進一步支持了它們對神經元的保護作用。
然而,在這項研究中,我們無法支持CLU基因rs9314349和rs9331949位點SNPs與腦卒中后癲癇易感性之間的聯系。這可能是由于與全基因組關聯研究(GWAS)相比,樣本量相對較小。在我們的研究中,這3個位點的MAF分別為0.146、0.171和0.232,而白種人的MAF報道均>0.349[19,21]。中國人群中MAF較低,因此需要更大的樣本量來檢測SNPs的小或中度遺傳效應。在未來的研究中,通過更大的樣本量或薈萃分析可能會獲得積極的結果。
綜上,在本研究人群中,我們證實了CLU基因rs11136000位點TC/CC基因型分布頻率降低與缺血性腦卒中后癲癇易感性增加有關。但是本研究存在樣本量小、種族背景和病理生理異質性等局限性,我們還需要對不同種族進行更大樣本量的實驗研究或薈萃分析,以闡明CLU多態性與癲癇之間的遺傳關聯。隨著對癲癇發病機制的深入了解,未來也可能會得到不同的結果。

